舒尼替尼对结肠癌细胞Notch信号通路及细胞凋亡的影响
2020-05-09初大可
李 改,初大可
(西安交通大学第一附属医院消化内科,西安 710061;*通讯作者,E-mail:chudake@xjtu.edu.cn)
结肠癌是最常见的消化道恶性肿瘤之一,发病率、死亡率极高,全球每年平均死于结肠癌的患者达60.8万,发病率在男性、女性患者中分别居第三、二位[1,2]。近年来,我国结肠癌发生率快速升高,严重威胁人民生命健康[3,4]。目前临床上通过手术、化疗、放疗、生物治疗等方法治疗结肠癌,但效果及预后不尽如人意,患者5年生存率仅42.7%[5]。因此,寻找更安全高效的抗肿瘤药物仍然是结肠癌治疗的研究重点[6]。舒尼替尼是一种小分子多靶向酪氨酸激酶抑制剂,是一种多靶点的生物靶向抗肿瘤药物,对治疗胃癌等肿瘤疗效显著[7]。舒尼替尼在治疗中对肿瘤分子信号调控网络的作用机制仍有待于深入研究。Notch信号通路是细胞间传导信号的保守通路,是决定细胞命运、组织发育的关键信号通路之一[8]。近来研究发现,Notch信号在肿瘤发生发展过程中起关键作用[9,10]。而Notch信号通路是否在舒尼替尼治疗结肠癌中发挥作用仍需研究证实。因此,本研究将探究舒尼替尼对结肠癌细胞株SW480中Notch信号通路分子及细胞凋亡的影响,以期为舒尼替尼治疗结肠癌的临床应用提供实验依据。
1 材料与方法
1.1 细胞株和试剂
结肠癌细胞株SW480、RPMI1640培养基、胰蛋白酶、化学发光试剂盒,购自上海泽叶生物科技有限公司;胎牛血清、蛋白提取试剂盒、BCA蛋白测定试剂盒、GAPDH抗体、Notch1抗体、N-myc下游调节基因4(N-myc downstream regulated gene 4,NDRG4)抗体、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)抗体、辣根过氧化物酶标记羊抗兔IgG,均购自上海恒斐生物科技有限公司;舒尼替尼(12.5 mg×28粒/盒,国药准字:H20090030)购自辉瑞公司;青霉素、链霉素、Notch4抗体、P53抗体,均购自厦门慧嘉生物科技有限公司;CCK-8试剂、Annexin Ⅴ-FITC/PI细胞凋亡检测试剂盒,均购自北京百奥莱博科技有限公司。
1.2 细胞培养与分组
将结肠癌细胞株SW480培养于含10%胎牛血清、1%青-链霉素的RPMI1640培养基中,37 ℃、5% CO2培养,待细胞贴壁生长融合达到70%-80%,用胰蛋白酶消化、传代培养。取对数期SW480细胞,以1×105个/ml、100 μl/孔接种于96孔培养板,实验分组为:对照组,0.75 μmol/L舒尼替尼组,1.5 μmol/L舒尼替尼组,3.0 μmol/L舒尼替尼组,6.0 μmol/L舒尼替尼组。
1.3 CCK-8法检测各组SW480细胞增殖
设置空白对照组(只加培养基),培养各组SW480细胞,分别于培养24,48,72 h后向各组培养基中加入CCK-8试剂,继续培养2 h,采用全自动酶标仪(波长:490 nm)检测各孔吸光度值(OD)。计算各组SW480细胞在不同浓度舒尼替尼作用下的增殖抑制率,增殖抑制率(%)=(OD对照组-OD舒尼替尼组)/(OD对照组-OD空白对照组)×100%。
1.4 流式细胞仪检测各组SW480细胞凋亡
按1.2分组培养细胞,48 h后收集各组SW480细胞,用胰蛋白酶消化、PBS洗涤,使用400 μl 1×结合缓冲液重悬细胞,转移至离心管中,并调整细胞浓度为1×106个/ml,加入5 μl Annexin Ⅴ-FITC、5 μl PI,避光孵育15 min,于流式细胞仪中检测细胞凋亡率。
1.5 流式细胞仪检测各组SW480细胞周期分布
按1.2分组培养细胞,48 h后收集各组SW480细胞,胰蛋白酶消化,PBS洗涤,-20 ℃预冷的70%乙醇固定过夜,收集细胞,PBS洗涤,加500 μl RNase/PI重悬细胞,避光染色20 min,于流式细胞仪中检测细胞周期分布情况。
1.6 Western blot法检测各组SW480细胞中Notch1、Notch4、P53、NDRG4、Bax蛋白表达
按1.2分组培养细胞,48 h后收集各组SW480细胞,使用蛋白提取试剂盒提取各组细胞总蛋白,BCA蛋白试剂盒测定蛋白浓度并定量,十二烷基硫酸钠—聚丙烯酰胺凝胶电泳分离蛋白质,转移至PDVF膜上,含5%脱脂奶粉的TBST封闭1 h,加入一抗(1 ∶500稀释的Notch1抗体、Notch4抗体、P53抗体、NDRG4抗体、Bax抗体和1 ∶1 000稀释的GAPDH抗体)4 ℃孵育过夜,TBST洗涤后加入二抗(1 ∶1 000稀释的辣根过氧化物酶标记的羊抗兔IgG)室温孵育1 h,TBST洗涤,化学发光法显影,Tanon 600图像分析系统拍摄图像,并分析蛋白条带灰度值,蛋白相对表达水平=目标蛋白灰度值/内参GAPDH蛋白灰度值。
1.7 统计学分析
数据处理采用SPSS 24.0统计学软件。计量资料采用均数±标准差表示,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验。当P<0.05时认为差异有统计学意义。
2 结果
2.1 SW480细胞增殖情况
CCK-8法检测结果显示,各组SW480细胞分别培养24,48,72 h的OD值,计算细胞增殖抑制率。结果显示,随着培养时间的增加,各组SW480细胞增殖抑制率均显著升高(P<0.05)。同一时间点,与对照组相比,不同浓度舒尼替尼组SW480细胞增殖抑制率均显著升高;随着舒尼替尼浓度升高,SW480细胞增殖抑制率均显著升高(P<0.05,见表1)。
2.2 SW480细胞凋亡情况
流式细胞仪检测各组SW480细胞培养48 h的凋亡率,结果显示:与对照组相比,不同浓度舒尼替尼组SW480细胞凋亡率均显著升高(P<0.05),且随着舒尼替尼浓度升高,SW480细胞凋亡率均显著升高(P<0.05,见图1、表2)。
表1 SW480细胞增殖抑制率比较 (n=6,%)
Table 1 Comparison of inhibition rate of SW480 cell proliferation among five groups (n=6,%)
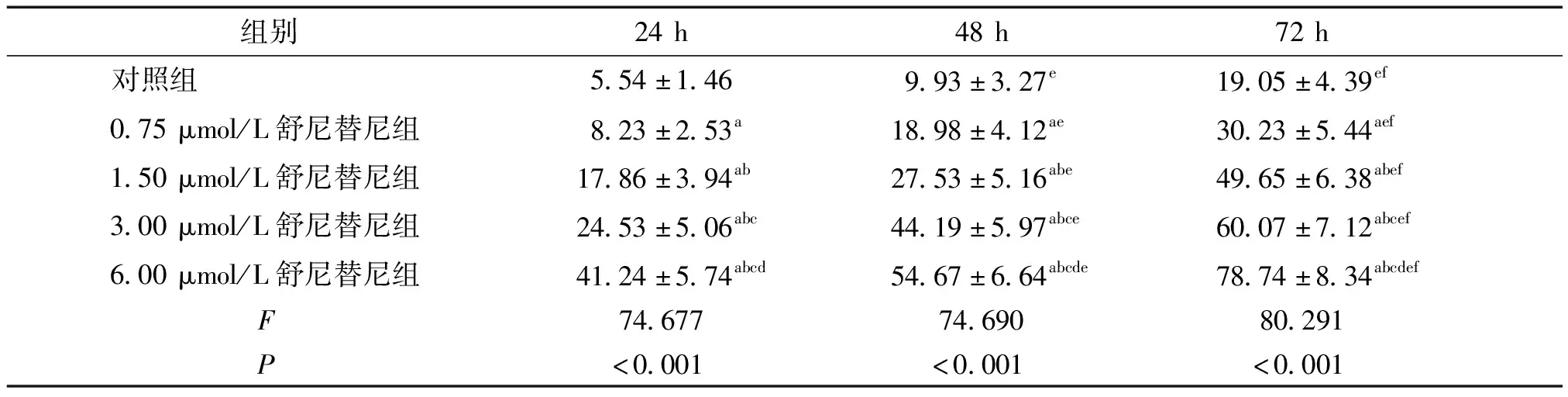
组别 24h48h72h对照组5.54±1.469.93±3.27e19.05±4.39ef0.75μmol/L舒尼替尼组8.23±2.53a18.98±4.12ae30.23±5.44aef1.50μmol/L舒尼替尼组17.86±3.94ab27.53±5.16abe49.65±6.38abef3.00μmol/L舒尼替尼组24.53±5.06abc44.19±5.97abce60.07±7.12abcef6.00μmol/L舒尼替尼组41.24±5.74abcd54.67±6.64abcde78.74±8.34abcdef F74.67774.69080.291 P<0.001<0.001<0.001
与对照组相比,aP<0.05;与0.75 μmol/L组相比,bP<0.05;与1.50 μmol/L组相比,cP<0.05;与3.00 μmol/L组相比,dP<0.05;与24 h相比,eP<0.05;与48 h相比,fP<0.05
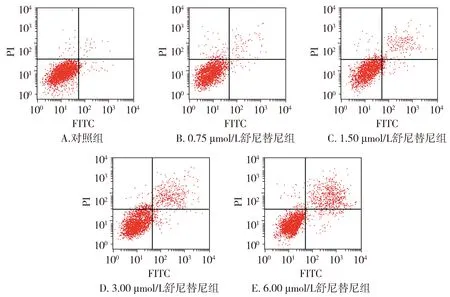
图1 舒尼替尼对SW480细胞凋亡的影响
表2 不同浓度舒尼替尼处理后SW480细胞凋亡率比较 (n=6)
Table 2 Comparison of apoptosis rates of SW480 cells among five groups (n=6)
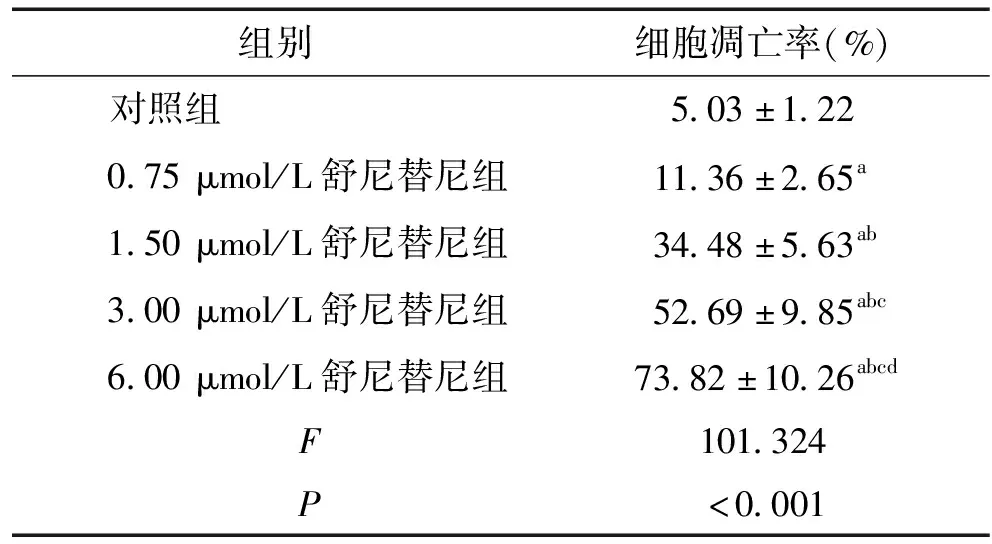
组别 细胞凋亡率(%)对照组5.03±1.220.75μmol/L舒尼替尼组11.36±2.65a1.50μmol/L舒尼替尼组34.48±5.63ab3.00μmol/L舒尼替尼组52.69±9.85abc6.00μmol/L舒尼替尼组73.82±10.26abcd F101.324 P<0.001
与对照组相比,aP<0.05;与0.75 μmol/L组相比,bP<0.05;与1.50 μmol/L组相比,cP<0.05;与3.00 μmol/L组相比,dP<0.05
2.3 SW480细胞周期分布
流式细胞仪检测各组SW480细胞培养48 h的凋亡率,结果显示:与对照组相比,不同浓度舒尼替尼组G0/G1期SW480细胞比例均显著升高(P<0.05),S期、G2/M期SW480细胞比例均显著降低(P<0.05)。随着舒尼替尼浓度升高,G0/G1期SW480细胞比例均显著升高(P<0.05),S期、G2/M期SW480细胞比例均显著降低(P<0.05,见图2,表3)。
2.4 不同浓度舒尼替尼处理后SW480细胞中Notch1、Notch4、P53、NDRG4、Bax蛋白的表达情况
Western blot法检测各组SW480细胞培养48 h后Notch1、Notch4、P53、NDRG4、Bax蛋白表达水平,结果显示:与对照组相比,不同浓度舒尼替尼组SW480细胞中Notch1蛋白表达水平均显著降低(P<0.05),Notch4、P53、NDRG4和Bax蛋白表达水平均显著升高(P<0.05)。随着舒尼替尼浓度的升高,SW480细胞中Notch1蛋白表达水平均显著降低(P<0.05),Notch4、P53、NDRG4、Bax蛋白表达水平均显著升高(P<0.05,见表4,图3)。
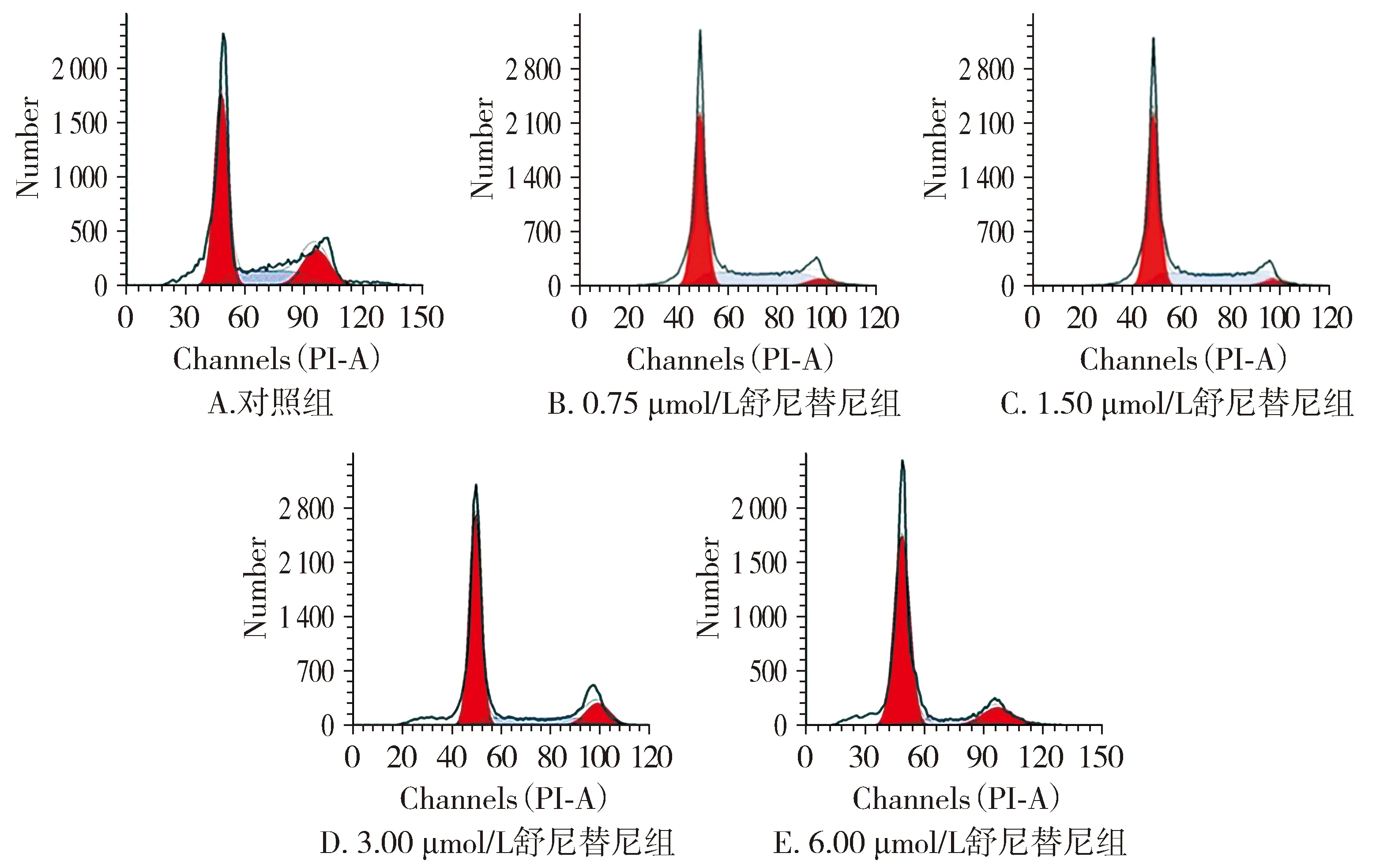
图2 舒尼替尼对SW480细胞周期的影响
表3 不同浓度舒尼替尼处理后SW480细胞周期分布情况比较 (n=6)
Table 3 Comparison of cell cycle distribution of SW480 cell among five groups (n=6)
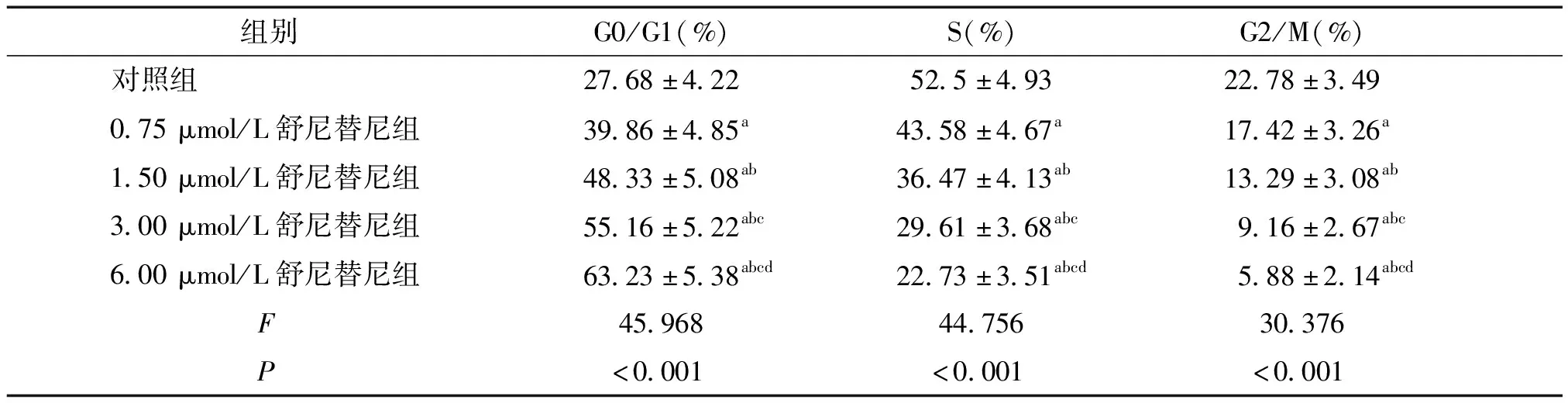
组别 G0/G1(%)S(%)G2/M(%)对照组27.68±4.2252.5±4.9322.78±3.490.75μmol/L舒尼替尼组39.86±4.85a43.58±4.67a17.42±3.26a1.50μmol/L舒尼替尼组48.33±5.08ab36.47±4.13ab13.29±3.08ab3.00μmol/L舒尼替尼组55.16±5.22abc29.61±3.68abc9.16±2.67abc6.00μmol/L舒尼替尼组63.23±5.38abcd22.73±3.51abcd5.88±2.14abcd F45.96844.75630.376 P<0.001<0.001<0.001
与对照组相比,aP<0.05;与0.75 μmol/L组相比,bP<0.05;与1.50 μmol/L组相比,cP<0.05;与3.00 μmol/L组相比,dP<0.05
表4 不同浓度舒尼替尼处理后SW480细胞中Notch1、Notch4、P53、NDRG4、Bax蛋白表达比较 (n=6)
Table 4 Comparison of Notch1, Notch4, P53, NDRG4, Bax protein expression in SW480 cells among five groups (n=6)
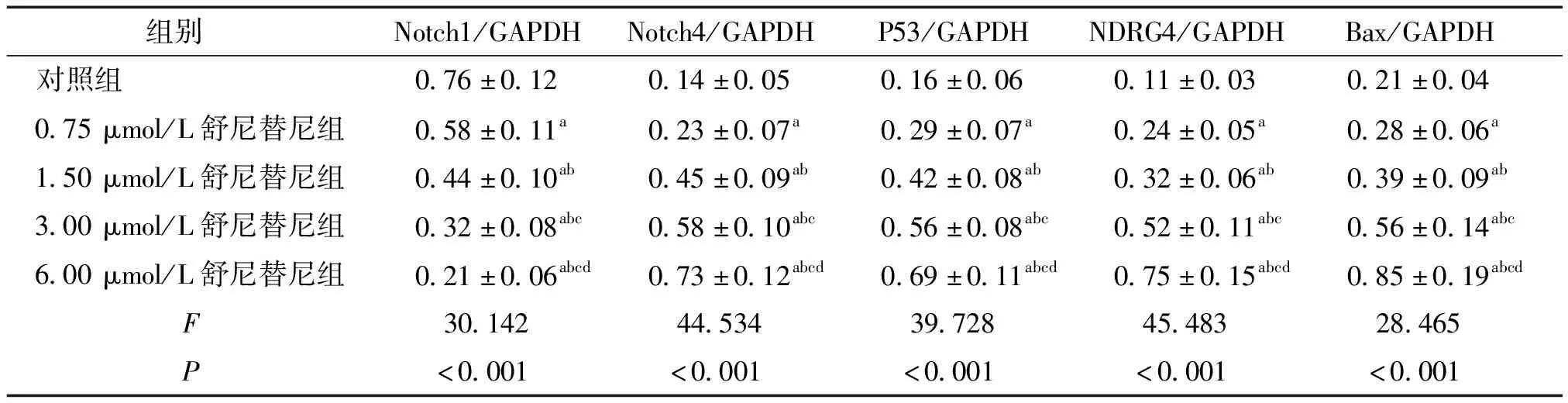
组别 Notch1/GAPDHNotch4/GAPDHP53/GAPDHNDRG4/GAPDHBax/GAPDH对照组0.76±0.120.14±0.050.16±0.060.11±0.030.21±0.040.75μmol/L舒尼替尼组0.58±0.11a0.23±0.07a0.29±0.07a0.24±0.05a0.28±0.06a1.50μmol/L舒尼替尼组0.44±0.10ab0.45±0.09ab0.42±0.08ab0.32±0.06ab0.39±0.09ab3.00μmol/L舒尼替尼组0.32±0.08abc0.58±0.10abc0.56±0.08abc0.52±0.11abc0.56±0.14abc6.00μmol/L舒尼替尼组0.21±0.06abcd0.73±0.12abcd0.69±0.11abcd0.75±0.15abcd0.85±0.19abcd F30.14244.53439.72845.48328.465 P<0.001<0.001<0.001<0.001<0.001
与对照组相比,aP<0.05;与0.75 μmol/L组相比,bP<0.05;与1.50 μmol/L组相比,cP<0.05;与3.00 μmol/L组相比,dP<0.05

图3 舒尼替尼对SW480细胞中Notch1、Notch4、P53、NDRG4、Bax蛋白表达水平的影响
3 讨论
结肠癌是世界三大常见恶性肿瘤之一,严重威胁人类生命健康[11]。舒尼替尼是一种多靶点的生物靶向抗肿瘤药物,通过抑制多条信号转导通路发挥作用[12]。研究证实,舒尼替尼在肾癌、肺癌化疗中的疗效及安全性值得肯定,但对于结肠癌的作用尚鲜有报道[13,14]。季流等[15]研究表明,舒尼替尼联合FOLFOX4治疗转移性结肠癌患者的疗效和安全性值得肯定,但其作用机制尚未完全明确。本研究结果显示,舒尼替尼组SW480细胞凋亡率较对照组均显著升高,且随着舒尼替尼浓度升高,同一时间点SW480细胞增殖抑制率、凋亡率均显著升高,提示舒尼替尼具有抑制结肠癌细胞增殖、诱导凋亡的作用。
细胞增殖、凋亡过程与细胞周期失调密切相关,当细胞周期不受机体正常控制,并不断进入新的循环时,会导致细胞无限增殖,这是导致癌细胞过度增殖的主要原因;当细胞被阻滞于某一周期时,可阻止细胞进入新一轮的细胞周期,进而抑制细胞增殖并诱导其凋亡[16]。本研究结果显示,随着舒尼替尼的处理浓度升高,SW480细胞G0/G1期比例均显著升高,S期、G2/M期比例均显著降低,提示舒尼替尼可能是一种细胞周期特异性药物,能够诱导SW480细胞阻滞于G0/G1期,并阻止细胞进入S期,从而抑制细胞增殖并诱导其凋亡。
Notch信号通路是肿瘤发生、发展过程中的重要通路,其直接参与结肠癌发生发展[17]。既往研究表明,Notch信号在多种肿瘤的增殖调控中发挥着重要而多样的作用,可能存在潜在的调控机制[18-20]。梁璐等[1]和刘少琼等[6]研究表明,黄芩苷、姜黄素均通过抑制Notch1信号通路诱导结肠癌SW480细胞株凋亡。Zhang等[18]研究表明,过度表达Notch4可抑制结直肠癌细胞增殖、迁移和侵袭,同时诱导细胞凋亡。李淑静等[12]研究表明,舒尼替尼通过抑制Notch1表达诱导人胰腺癌细胞凋亡过程。Notch信号可通过非经典信号通路调控多个下游分子,包括NDRG4、P53和Bax等。NDRG4是新型的肿瘤抑制因子,对肿瘤细胞的凋亡具有调控作用,是预测结直肠癌患者总体生存率的指标[21]。p53基因是目前基因研究中最深入、最广泛的肿瘤基因,是调控细胞凋亡的关键分子之一[22]。Bax是B淋巴细胞瘤-2蛋白(B-cell lymphoma-2,Bcl-2)家族的促凋亡成员,可促进细胞凋亡[23]。本研究结果显示,随着舒尼替尼处理浓度升高,SW480细胞中Notch1蛋白表达水平显著降低,Notch4、P53、NDRG4、Bax蛋白表达水平均显著升高,提示舒尼替尼可能通过抑制Notch1蛋白表达,促进Notch4、P53、NDRG4、Bax表达,发挥抑制SW480细胞增殖并诱导其凋亡的作用,但具体调控机制还需进一步研究。
综上所述,舒尼替尼可能通过抑制Notch1蛋白表达、促进Notch4蛋白表达进而调控下游分子信号通路,诱导结肠癌SW480细胞凋亡。
