miR-145靶向PDCD4在缺血性脑卒中的作用机制
2020-05-09刘宏伟姚建辉刘鹏军李卫民
刘宏伟,姚建辉,刘鹏军,李卫民
(1)榆林市第一医院急诊科;2)重症医学科,陕西榆林 719000)
缺血性脑卒中是急重症医学科室常见病之一,是非创伤性残疾的主要原因,也是世界第二大死亡原因[1]。缺血性脑卒中由于脑的供血动脉(颈动脉和椎动脉)狭窄或闭塞、脑供血不足导致的脑组织坏死性疾病,可造成患者永久丧失劳动力,严重影响人们的生活和健康。研究发现,细胞因子介导大量炎性因子释放造成神经干细胞炎性反应以及非正常凋亡是促进缺血性脑卒中发展的主要原因之一[2]。因此,深入探讨调控神经干细胞炎性反应和细胞凋亡的分子机制,是有效缓解缺血性脑卒中进展的主要手段。研究表明,miRNA参与调控缺血性脑卒中引起的神经干细胞凋亡和炎性反应[3],其中,miR-145在缺血性脑卒中后表达下调,高表达时能抑制神经干细胞凋亡缓解缺血性脑卒中的进展[4]。程序性细胞死亡因子4(Programmed cell death 4;PDCD4)在缺血性脑卒中后高表达,并加重缺血性脑卒中的损伤程度[5],同时PDCD4在近年研究中发现能参与调控细胞凋亡及炎性反应[6]。但目前尚无文献报道miR-145通过调控PDCD4参与缺血性脑卒中引起的神经干细胞炎性反应和细胞凋亡。因此,本研究将重点探讨miR-145靶向作用PDCD4调控缺血性脑卒中引起的NE-4C细胞炎性反应和细胞凋亡,为今后临床治疗缺血性脑卒中的研究提供一定参考方向。
1 材料与方法
1.1 细胞与主要试剂
小鼠神经干细胞NE-4C(货 号:BNCC341769)购买于BeNaCulture,胎牛血清(货号:10270106)和DMEM(货号;10566024)培养基购买于Gibco;SYBR Green qPCR(货号:K0252)、First Strand cDNA Synthesis Kit(货号:K1612)和凋亡试剂盒(货号:V13242)均购买于Thermo Fisher公 司;miR-145 mimics/ inhibitor由Gene Pharma公司构建;pmirGLO luciferase Target Expression Vector和双荧光素酶报告基因测试盒(货号:SLDL-100)购买于PuFei生物;免疫印迹一抗(Anti-PDCD4antibody货号:ab51495)及二抗均购自Abcam公司。
1.2 细胞培养转染及处理
将小鼠神经干细胞NE-4C细胞在37℃、5%CO2条件下于10%胎牛血清的DMEM培养基中培养。当NE-4C细胞处于对数生长期时用浓度20μM的H2O2处理NE-4C细胞后,收集经处理过的细胞,根据LipofectamineTM2000 Kit转染miR-145 mimics、sh-PDCD4、miR-145inhibitor,48 h后观察转染效果。
1.3 RT-qPCR检测miRNAs、IL-1β、IL-6和TNF-α 的表达
离心收集各组细胞,采用RNA提取试剂盒提取各组经处理过细胞的总RNA,在测定浓度后,反转录试剂盒将其反转录为cDNA,以cDNA为模板,分别以U6和GAPDH为内参,根据SYBR Green qPCR试剂盒说明书,以U6和GAPDH为内参,检测各组NE-4C细胞目标miRNA或mRNA的表达水平进行扩增,以95℃5 min,94℃30 s,60 ℃30 s为反应条件进行40个循环,采用公式2-△△Ct计算相关基因表达量。其中引物序列,见表1。
1.4 Western blot检测PDCD4蛋白的表达
收集经处理过的细胞,裂解液提取总蛋白后Bio-Rad DC蛋白质测定法检测纯度及浓度,采用10%聚丙烯酰胺凝胶电泳分离蛋白条带,半干法转膜将条带转印到PVDF膜上,采用5%脱脂奶粉室温封闭1 h,用以下稀释过的一抗(Anti-PDCD4antibody 1:1 500)在4℃条件下过夜孵育;弃去一抗洗膜缓冲液洗涤后,加入稀释好的二抗(1:2 000)避光1h后采用显色液进行显色,凝胶成像仪曝光观察并拍照,最后采用Image J对蛋白条带灰度进行定量分析。
1.5 双荧光素酶报告基因实验验证miR-145与PDCD4的调控关系
将含有PDCD4 3'UTR野生型(WT)或突变体(MUT)片段与miR145结合位点的序列插入pmir-GLO luciferase Target Expression Vector中构建mirGLO-PDCD4-WT/MUT荧光素酶报告载体,使用Lipofectamine将载体和对照组转染HEK 293T细胞,转染48 h后,双荧光素酶报告基因测试盒检测荧光素酶活性。
1.6 Annexin-V-FITC实验检测NE-4C细胞凋亡水平
收集处于对数生长期经处理的NE-4C细胞,PBS清洗3次,离心弃上清,将NE-4C细胞与预冷的1×结合缓冲液、5μL Annexin V-FITC和5μL PI均匀混合后避光孵育10 min,上机检测NE-4C细胞凋亡水平。
1.7 统计学处理
采用SPSS和GraphPad Prism软件对实验结果进行分析和绘图;以()表示,其中两组间比较采用t检验,多组间比较采用单因素方差分析。数据以P<0.05为差异有统计学意义。

表1 PCR引物序列Tab.1 Primer sequence for PCR
2 结果
2.1 H2O2 处理促进NE-4C细胞凋亡和产生炎性反应
RT-qPCR检测结果表明,使用H2O2处理后,IL-1β、IL-6及TNF-α 的表达水平高于未处理组(P<0.01),见图1A。流式细胞仪检测结果表明,与对照组相比,H2O2处理促进了NE-4C细胞凋亡水平(P<0.01),见图1B。以上结果可知,H2O2处理能促进NE-4C细胞凋亡和产生炎性反应。
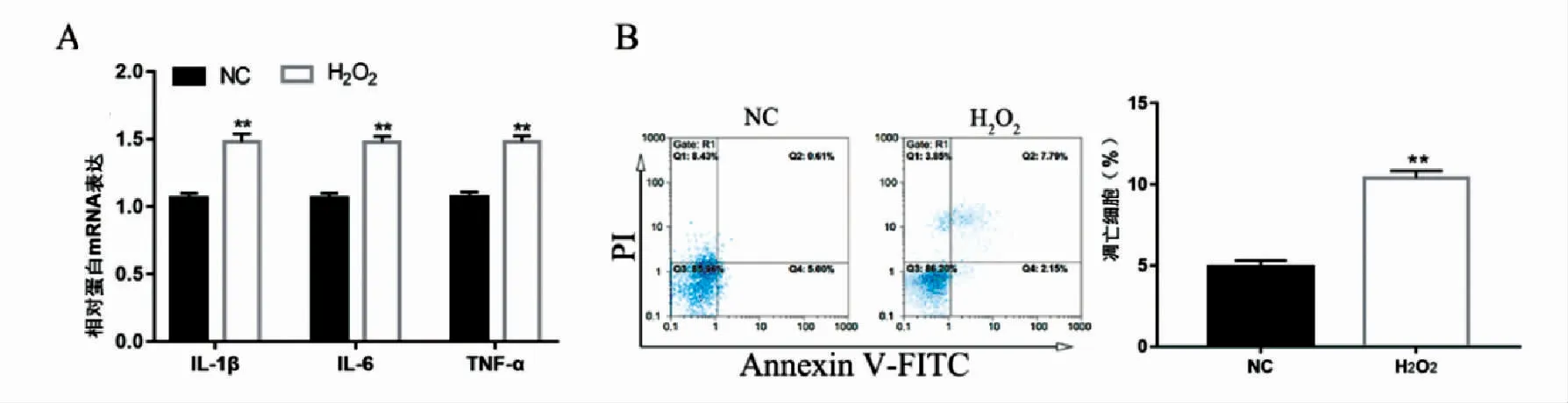
图1 H2O2 处理促进NE-4C细胞凋亡和产生炎性反应Fig.1 H2O2 treatment promotes apoptosis and inflammatory response in NE-4C cells
2.2 H2O2 处理下调NE-4C细胞中miR-145的表达
RT-qPCR结果表明,与未处理组相比,在H2O2处理的NE-4C细胞中miR-19a、miR-130、miR-145以及miR-224-3p表达均下调(P<0.05),其中miR-145表达水平最低(P<0.01)。以上结果表明,异常低表达的miR-145可能与NE-4C细胞凋亡和炎性反应有关,见图2。
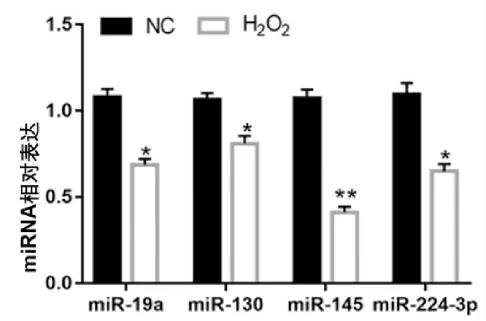
图2 H2O2 处理下调NE-4C细胞中miR-145的表达Fig.2 H2O2 treatment down-regulates the expression of miR-145 in NE-4C cells
2.3 过表达miR-145抑制H2O2 诱导NE-4C细胞凋亡和炎性反应
RT-qPCR结果表明,与NC和H2O2处理组相比,过表达miR-145显著上调了NE-4C细胞miR-145的表达水平(P<0.01),图3A;同时RT-qPCR检测结果发现,与NC和H2O2处理组相比相比,过表达miR-145并采用H2O2处理后显著下调了IL-1β、IL-6及TNF-α 的表达(P<0.01),图3B;而只采用H2O2处理与NC组差异无统计学意义。流细胞仪检测结果表明,与NC和H2O处理2组相比,过表达miR-145并采用H2O2处理显著抑制了H2O2诱导的NE-4C细胞凋亡(P<0.01),图3C。此实验结果可知,过表达miR-145缓解H2O2诱导NE-4C细胞凋亡和炎性反应。
2.4 miR-145靶向下调PDCD4的表达水平
通 过 Microrna(www.microrna.org/microrna/home.do)数据库的预测结果发现,PDCD4是miR-145的潜在靶基因,见图4A。双荧光素酶报告基因实验结果表明,过表达miR-145显著抑制PDCD42野生型质粒内荧光强度(P<0.01),见图4B,而突变型质粒荧光强度与对照组无显著差异。同时,Western blot检测结果显示,在NE-4C细胞中过表达miR-145显著抑制PDCD4的表达水平(P<0.01),见图4C。以上实验结果表明miR145靶向下调PDCD4的表达水平。
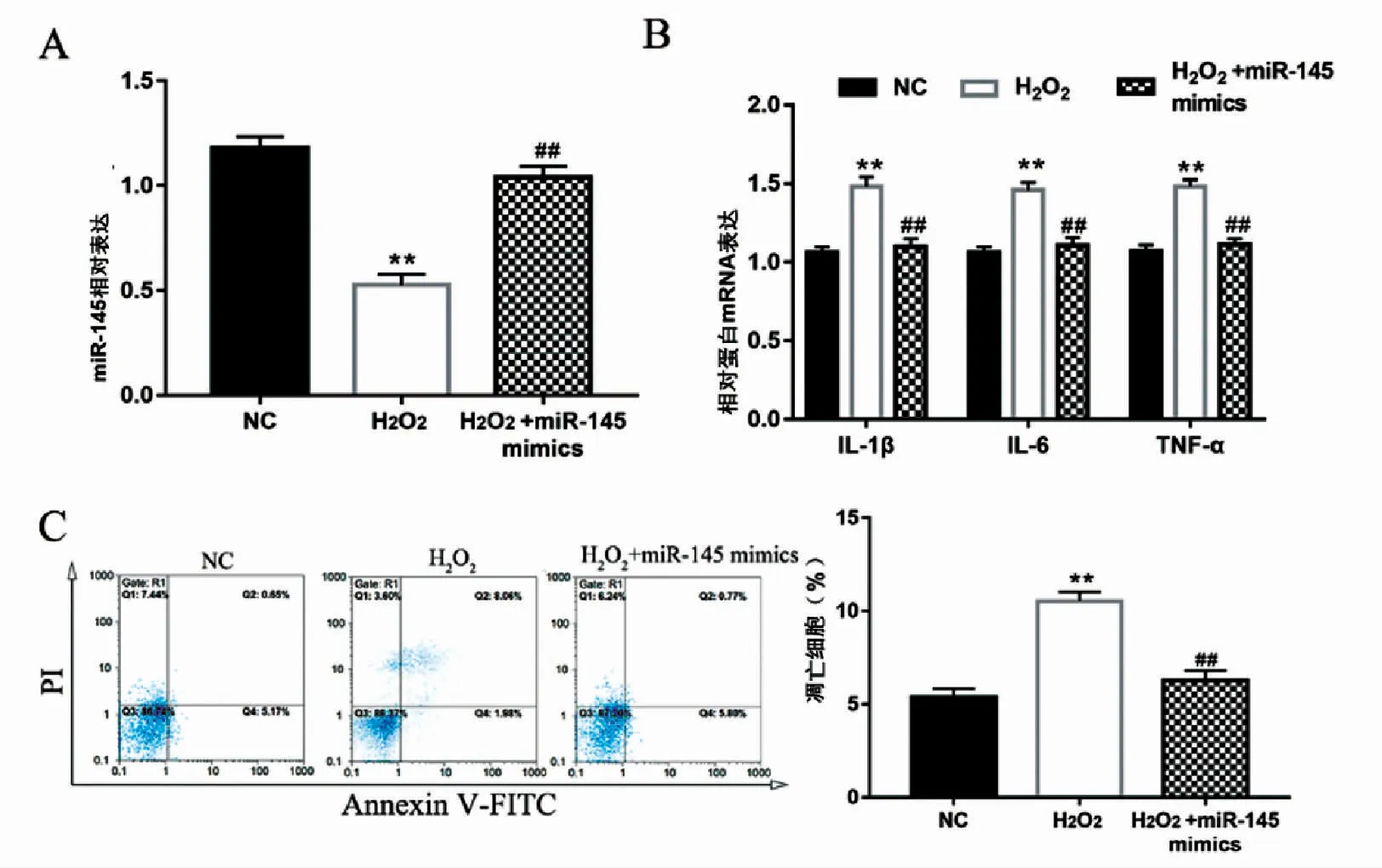
图3 过表达miR-145抑制H2O2 诱导NE-4C细胞凋亡和炎性反应Fig.3 Overexpression of miR-145 inhibits H2O2-induced apoptosis and inflammatory response in NE-4C cells
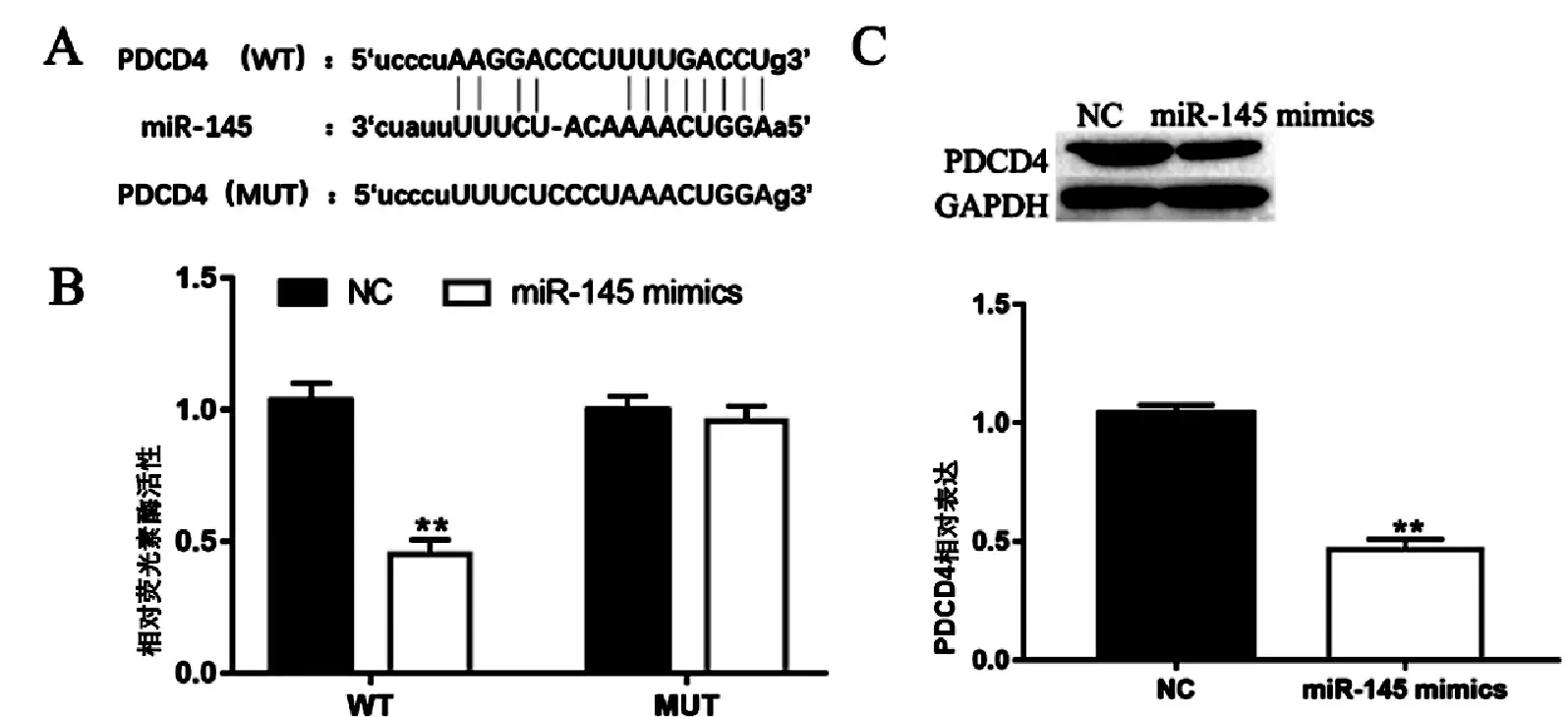
图4 mi-R145靶向下调PDCD4的表达水平Fig.4 miR-145 targets down-regulation of PDCD4
2.5 miR-145靶向下调PDCD4抑制H2O2诱导NE-4C细胞凋亡和炎性反应
Westernbolt结果表明,与NC组相比,敲降PDCD4显著下调NE-4C细胞中PDCD4的表达水平(P<0.01),图5A;而同时敲降miR-145和PDCD4中PDCD4的表达水平与对照组无统计学意义。RT-qPCR结果表明,与NC组相比,在转染sh-PDCD4的NE-4C细胞中采用H2O2处理后,IL-1β、IL-6及TNF-α 的表达水平显著下调(P<0.05或P<0.01),图5B,同时转染miR-145 inhibitor和sh-PDCD4与NC组无显著差异。流式细胞仪检测结果表明,与NC组相比,转染sh-PDCD4能显著抑制H2O2诱导的NE-4C细胞凋亡(P<0.05),图5C,在回复实验中同时转染miR-145 inhibitor和sh-PDCD4中细胞凋亡水平与NC组差异无统计学意义。以上实验结果表明,过表达miR145靶向下调PDCD4抑制H2O2诱导NE-4C细胞凋亡和炎性反应。
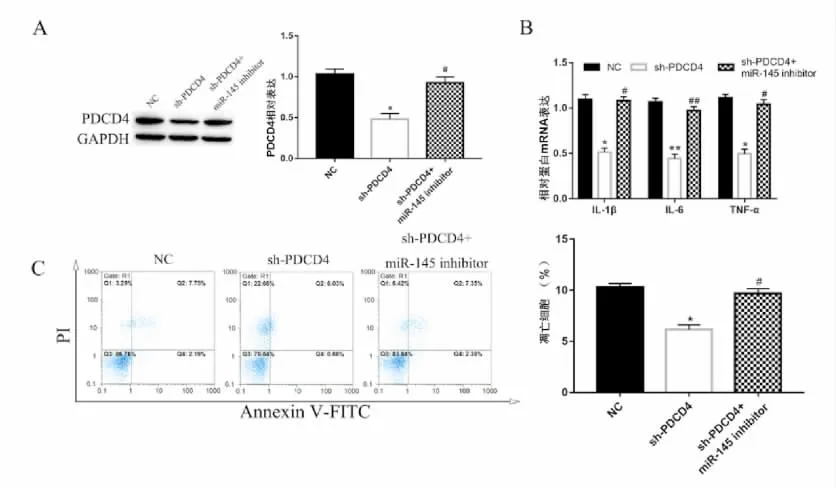
图5 miR145靶向下调PDCD4抑制H2O2 诱导NE-4C细胞凋亡和炎性反应Fig.5 Own-regulation of PDCD4 by miR145 inhibits H2O2-induced apoptosis and inflammatory response in NE-4C cells
3 讨论
缺血性脑卒中是导致我国居民发生脑部并发症及死亡的主要原因,大约有30%的脑卒中患者永久丧失劳动力[7-8]。近年来研究证实,脑部供血动脉狭窄或闭塞,造成脑供血不足导致神经干细胞等发生非正常凋亡以及分泌炎性因子(如IL-1家族、IL-6、TNF-α 等)进一步导致脑组织发生炎症和坏死[9],进而造成缺血性脑卒中进一步发展[10]。本研究采用H2O2处理小鼠神经干细胞NE-4C构建脑卒中细胞模型,发现炎性因子IL-6、IL-1β和TNF-α 水平显著增加,NE-4C细胞凋亡水平也显著上升。
近年来,研究证实,许多非编码内源性小RNA(miRNA)在缺血性脑卒中后表达发生变化[11],并在转录或转录后水平参与调控缺血性脑卒中的发展进程,此外,也有研究证实miRNA在神经干细胞凋亡和炎性反应中起着至关重要的作用,如下调miR-19a抑制神经干细胞凋亡缓解缺血性脑卒中的进展[12];高表达miR-195能抑制神经干细胞炎性相关因子IL-1β、IL-6、TNF-α 等的分泌进而保护缺血性脑卒中引起的脑损伤[13]。miR-145位于5号染色体5q32-33,是一类肿瘤转移抑制因子,同时有研究发现,miR-145在缺血性脑卒中过程中低表达,并发挥重要调控作用,如上调miR-145通过调控MAPK途径在缺血性脑卒中保护神经干细胞[14]。本研究发现,miR-145在H2O2处理的NE-4C细胞中表达水平显著下调,过表达miR-145能显著下调H2O2引起的炎性相关因子IL-1β、IL-6、TNF-α 的表达,并抑制NE-4C细胞的凋亡。
PDCD4是一类细胞死亡因子,其主要作用可通过MA-3片断与靶基因的mRNA编码区结合阻断翻译过程,进而影响细胞增殖、凋亡等生物学行为[15],同时,研究发现PDCD4能抑制抗炎因子IL-10的翻译,导致IL-10表达降低,促进IL-6等炎性因子分泌从而介导炎症发生[16-17],在肿瘤、肥胖、心血管疾病发生发展中参与重要调控[18-20]。在缺血性脑卒中发展中,PDCD4上调并促进了神经干细胞NE-4C的凋亡。本研究通过生物信息学发现PDCD4是miR-145潜在靶基因,miR-145可通过靶向PDCD4,进而抑制H2O2引起的NE-4C细胞炎性相关因子IL-1β、IL-6、TNF-α 的表达和细胞凋亡。
综上所述,本研究通过NE-4C细胞发现并证实miR-145靶向下调PDCD4可缓解缺血性脑卒中引起的神经干细胞NE-4C凋亡和炎性反应。
