糖蛋白印迹二维光子晶体水凝胶传感器的构建
2020-05-08李艳霞陈毅挺娄本勇
李艳霞,黄 露,陈毅挺,娄本勇,缪 玲
(1.闽江学院 海洋学院 化学工程系,福建 福州 350108;2.闽江学院 药物制剂研究与 测试中心,福建 福州 350108)
糖蛋白( Glycoprotein)由寡糖链与肽链中的一定氨基酸残基以糖苷键共价连接而成,是生理功能的主要承担者。糖蛋白与多种疾病的发生密切相关,并常用作临床诊断的生物标志物和治疗靶点。然而,在复杂的生物样品中,糖蛋白的研究易受到其它蛋白的严重干扰。因此,在进行分析之前,糖蛋白的识别和分离就显得尤为重要。目前,质谱已被证明是糖蛋白分析的强大工具,但其无法直接识别目标糖蛋白,需要进行繁琐的样品预处理,对于生物样品来说,这一处理过程极易破坏蛋白质的结构与性质。因此,发展一种非破坏性、便捷、高敏感的糖蛋白分析方法具有重要意义。刀豆蛋白A(Concanavalin A,简称Con A),是一种植物血球凝集素,属于糖蛋白,含一个糖结合部位,可高特异性和可逆地识别并可与含有糖基修饰的细胞或糖缀合物结合[1],已成为生物学、化学、免疫学、生物化学以及医学等领域中有用的研究工具。
光子晶体是一种经典的光学材料,是一类在光学尺度上具有周期性介电结构的由人工设计和制造的晶体。光子晶体几何形状上的周期性使之具有光子能带结构,但由于光子晶体中各个间隙位置的差异,导致其产生的反射光的颜色存在明显的差别,该特点使光子晶体成为理想的光学传感检测材料[2-3]。
分子印迹技术是一种用于制备具有特殊识别功能的分子印迹聚合物的方式,是集材料化学、光学、高分子化学和生物学于一身的新兴技术[4]。分子印迹凝胶光子晶体是分子印迹技术与凝胶光子晶体技术的有机结合,由于光子晶体周期性的介电结构可引起电磁波的布拉格衍射,当电磁波落在可见光测量波长范围内时,水凝胶光子晶体即可产生肉眼可见的五彩斑斓的结构色[5];同时,分子印迹水凝胶可对外界的环境刺激产生响应而发生快速且可逆的溶胀收缩,进而引起光子晶体结构色的变化[6]。因此,结合分子印迹水凝胶的特异性识别能力和光子晶体的即时检测功能,可实现目标物的定性与定量分析。迄今,基于分子印迹水凝胶光子晶体技术已经实现了L-色氨酸[7]、红霉素[8]、磺胺二甲嘧啶[9]、葡萄糖[10]、三聚氰胺[11]、2,4,6-三氯酚[12]、灭多威[13]、乙基膦酸[14]等多种物质的检测。此类检测方法需满足以下要求:①目标检测物的分子可以被特异性吸附;②在吸附目标分子之后,光子晶体所发出的光信号会产生相应的变化,即可以对被检测的物质产生响应。
本文选择Con A作为糖蛋白印迹模板分子,以4-乙烯基苯硼酸为单体引入硼酸基团,并利用硼酸基团与糖蛋白中的邻二羟基形成可逆共价键,制得能够特异性识别Con A的糖蛋白印迹膜。以聚苯乙烯微球自组装的光子晶体为载体,在光子晶体界面上制备Con A印迹的丙烯酰胺水凝胶。模板蛋白经洗脱,形成Con A分子印迹二维光子晶体水凝胶传感器(MIPs)。当单色光垂直入射时,二维光子晶体的反面会出现德拜环,通过测量德拜环直径变化,可以直观地反映出印迹水凝胶对目标物的吸附效果,从而实现目标物检测。整个过程快速、简便,不需任何复杂的仪器设备,且可拓展到其它糖蛋白印迹。
1 实验部分
1.1 仪器与试剂
载玻片(25.4 mm×76.2 mm×1 mm)、绿色激光笔(532 nm,1 000 mW)(西安市诺青激光有限公司);SU8000扫描电子显微镜(日本日立公司);Nicoler iS50傅立叶转换红外光谱仪(美国尼高力公司);TG-DSC分析仪(德国耐驰公司)。
甲基丙烯酸-2-羟乙酯、过硫酸钾、丙烯酰胺、甲叉双丙烯酰胺、过硫酸铵、乙酸、正丙醇(分析纯),苯乙烯(化学纯),均购于国药集团化学试剂有限公司;4-乙烯基苯硼酸(纯度96%)购于阿拉丁试剂有限公司;胎牛血清(FBS,优级纯)、刀豆蛋白A(Con A,纯度>95%)、卵清白蛋白(OVA,含量>95%)、胰蛋白酶(Try,含量>95%)购于北京鼎国生物技术有限责任公司;牛血红蛋白(BHb,含量>95%)、溶菌酶(Lyz,含量>95%)购于源叶生物科技有限公司。实验用水为Millipore超纯水(18.2 MΩ·cm)。
1.2 聚苯乙烯微球的制备
采用无皂乳液聚合法制备粒径为800 nm的单分散聚苯乙烯(PS)微球[15]:首先,向500 mL的三口圆底烧瓶中依次加入77.3 mL苯乙烯、1.865 mL 甲基丙烯酸-2-羟乙酯(HEMED)、0.18 g氯化钠和205 mL超纯水,在不断搅拌的条件下,充氮除氧1 h,加热至70 ℃;将0.11 g过硫酸钾溶解在5 mL超纯水中后加入到该三口圆底烧瓶中,回流24 h,得到乳白色溶液,反应结束,冷却至室温。用玻璃棉过滤,离心,取上清液,以超纯水洗3~4次,再加入超纯水纯化PS微球,超声30 min,以分散单个颗粒,保存备用。
1.3 二维光子晶体的自组装
将制得的PS微球用去离子水稀释成质量分数为20%的聚苯乙烯乳液,并与正丙醇以体积比2∶1混合,超声20 min使其分散均匀。采取针尖注射法[16-17]在去离子水的表面制得一大片颜色鲜艳的单层聚苯乙烯光子晶体(PC),将制得的PC转移至载玻片上,垂直放置,于空气中风干,通过垂直沉降获取具有一定规整排列的聚苯乙烯二维光子晶体。
1.4 Con A分子印迹二维光子晶体水凝胶的制备
A液:称取12 g丙烯酰胺和0.4 g甲叉双丙烯酰胺,加水溶解,定容至50 mL,并储存在4 ℃冰箱中备用。
混合液的制备:取干净的烧杯,向其中依次加入1 mL A液,0.006 g 4-乙烯基苯硼酸和10 mg Con A,充分混匀、溶解,再依次加入1 mL水,20 μL 10%的过硫酸铵和1 μL N,N,N′,N′-四甲基乙二胺(TEMED),搅拌混匀。

图1 Con A分子印迹二维光子晶体水凝胶(MIPs)制备过程Fig.1 Schematic representation of the stepwise modification of MIPs
取一块含有聚苯乙烯二维光子晶体的载玻片,移取200 μL上述混合液滴加在光子晶体表面,均匀铺开,盖上载玻片,在无气泡条件下形成一种“三明治”结构,自聚合1 h,移去上层载玻片,将下层载有光子晶体水凝胶层的载玻片,浸泡在10%的乙酸溶液中洗脱1 h,倒出洗脱液,依次用洗脱液、水淋洗3遍,再将其浸泡在0.01 mol/L磷酸盐缓冲液(pH 7.0)中,使水凝胶达到溶胀平衡状态,即得到Con A印迹二维光子晶体水凝胶。
非分子印迹光子晶体水凝胶作为对照组,制备方法与上述步骤相同,但是混合液中不加Con A印迹分子。印迹分子水凝胶和非印迹分子水凝胶分别表示为MIPs和NIPs。MIPs吸附1.0 mg/mL Con A,标记为MIPs-Con A。制备过程示意图如图1所示。
2 结果与讨论
2.1 分子印迹光子晶体水凝胶的表征
采用扫描电镜(SEM)对PC和MIPs的形貌进行表征。图2A为采用针尖注射法制备得到PC的SEM图。可以看出,利用无皂乳液聚合方法制备的二维光子晶体粒径约733 nm,为单层、有序的六方紧密堆积结构;PS小球呈圆形,微球粒径均一,单分散性良好。实物照片表明该光子晶体色彩鲜艳豁亮,用肉眼即可观测到表面由布拉格衍射引起的衍射色彩。图2B为MIPs的SEM图,由图可见,形成水凝胶后的PS微球仍然规则地镶嵌在水凝胶的表面,这种现象为后续德拜环的测量奠定了基础。

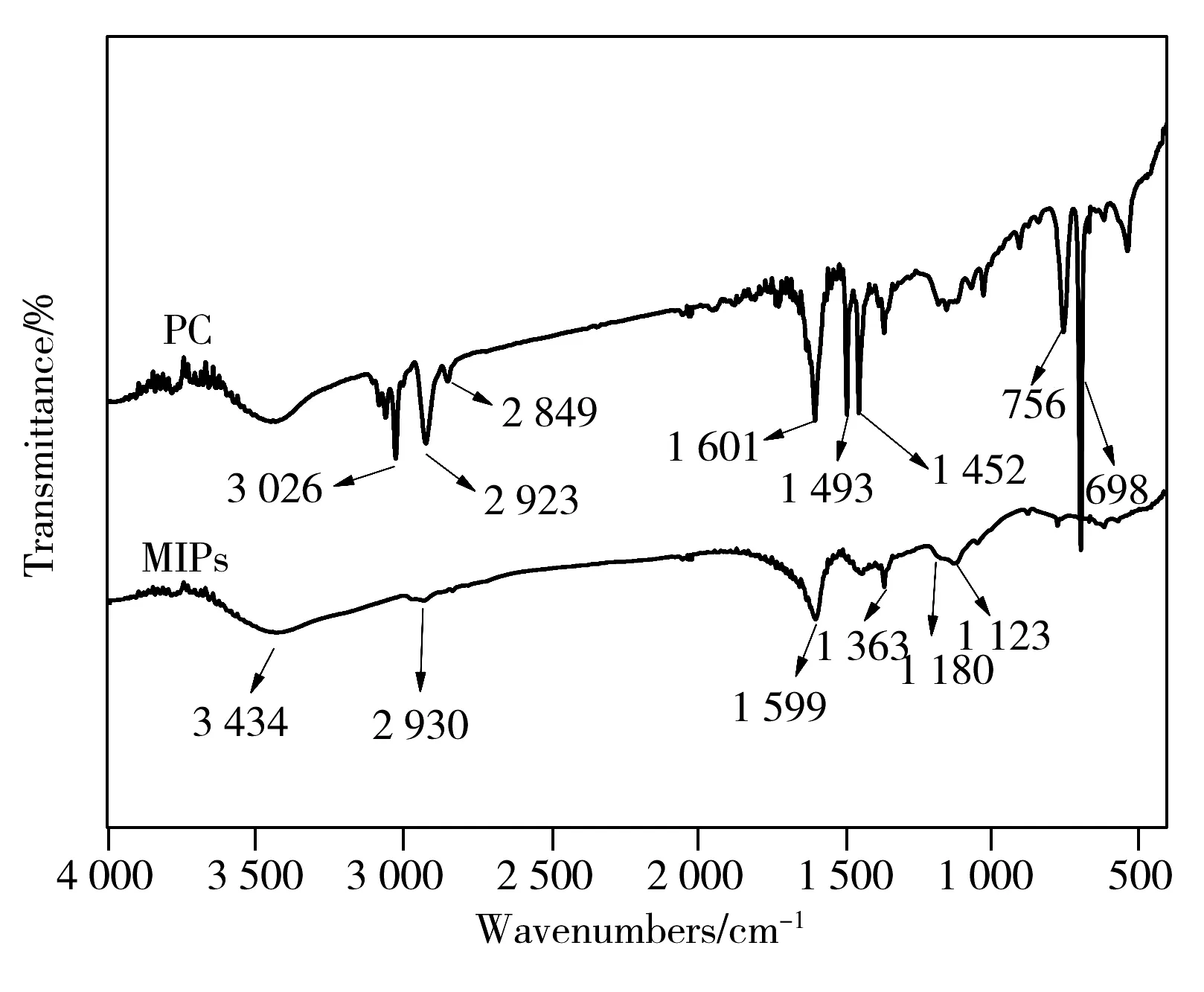
图3 PC与MIPs的红外光图Fig.3 IR micrographs of PC and MIPs

图4 德拜环测量示意图(A)和激光照射MIPs后 产生的德拜环黑暗条件下的照片(B)Fig.4 Illustration of Debye diffraction ring measurement

2.2 MIPs的响应行为
通过测量二维光子晶体水凝胶对激光衍射产生的德拜环直径的变化,探究 MIPs对 Con A的响应行为。德拜环直径测量如图4A所示,采用波长为532 nm的绿色激光笔垂直照射水凝胶,从而在二维光子晶体反面产生德拜衍射花环,该德拜环可用来表征二维光子晶体的晶格参数,进而反应紧密堆积的二维胶体晶体凝胶异质结构体积的改变。德拜衍射角α由单色入射光的波长λ和光子晶体球间距d共同决定。
(1)
采用绿色激光(λ=532 nm)光源,固定底部水平面与样品之间的距离h,激光笔的位置也要固定。用最小刻度为1 mm的直尺测量德拜环直径D,并根据下式求得衍射角α:
α=arctan(D/2h)
(2)
将衍射角α代入式(1),即可求得胶体晶体阵列的球间距d。
2.3 不同材料德拜环直径差异
光子晶体表面修饰的材料不同,将使光子晶体中各个间隙位置产生变化,进而导致德拜环的差异。本文分别测定了PC、MIPs+Con A、MIPs和NIPs的德拜环直径。结果如图5A所示,PC德拜环直径最小,说明PC中PS微球未受到其他物质影响,排列最紧密;当表面覆盖一层水凝胶(NIPs)时,德拜环直径略有增大,含有印迹空穴的MIPs可进一步增大德拜环直径,而MIPs 饱和吸附 Con A后德拜环直径最大。由此,可以得出,引入新的物质会引起光子晶体德拜环的增大。
2.4 MIPs的吸附等温线
印迹分子的浓度会对水凝胶内的印迹孔腔数量产生影响,从而影响MIPs的响应行为。取洗脱后的MIPs和NIPs,分别滴加10 μL不同质量浓度的Con A溶液,吸附1 h, 洗去未被吸附的蛋白,测其德拜环的变化。图5B可见,对于MIPs,当Con A质量浓度从0 mg/mL增大到0.5 mg/mL时,德拜环直径逐渐增大;此后,随着Con A质量浓度增大,德拜环直径略有增加,但变化不大,说明吸附趋于饱和。而NIPs滴加Con A后未产生德拜环的显著变化。说明MIPs由于分子孔穴的印迹效应,对Con A表现出了较高的吸附性能。这一动态响应过程可用于目标物的富集和即时检测。
2.5 MIPs的吸附与洗脱效果
以MIPs和NIPs分别吸附1.0 mg/mL的Con A,德拜环直径随时间的变化情况如图5C所示。由图可知,随着吸附时间的增加,两者德拜环直径的变化量都逐渐增大,当吸附60 min后,德拜环直径趋于稳定,说明达到饱和吸附。但相同条件下,尤其是饱和吸附条件下,MIPs德拜环的直径变化量远大于NIPs,说明MIPs可以对Con A进行特异性吸附。
取上述分别饱和吸附Con A溶液的MIPs和NIPs,测其德拜环直径后置于10%乙酸溶液中洗脱,测量德拜环直径随洗脱时间的变化情况。由图5D可知,随着洗脱时间的增加,MIPs和NIPs的德拜环直径逐渐减小,60 min后无明显变化,说明60 min 可以达到最佳的洗脱效果。




图5 德拜环在不同条件下的变化情况Fig.5 Changes of Debye ring under different conditions diameter of Debye ring produced by different materials(A),curve of Debye ring changed with Con A concentration(B), adsorption time(C) and elution time(D)

表1 交联度配方Table 1 Formula of crosslinking degree
2.6 交联度对MIPs响应的影响
交联度指溶液中交联剂占单体和交联体总量的百分数,是影响水凝胶强度、结构和溶胀率的一大因素[7],可通过德拜环的直径变化来体现。本文在MIPs制备过程中,通过固定Con A(0.012 5 g)、乙烯基苯硼酸(0.007 5 g)、10%APS(0.025 mL)的用量,改变交联剂(A液)的用量,考察了不同交联度下MIPs对目标分子识别的敏感性。不同交联度配方(表1)下德拜环直径随交联度的变化曲线如图6A所示。
由图6A可知,当交联度为10%时,德拜环的直径变化最显著,其最大的变化量为0.94 cm。这是因为当交联度过小时,水凝胶交联点较少,难以锁定目标分析物,且印迹空腔容易溶胀变形,从而导致水凝胶的响应性能降低;随着交联度的逐渐增大,水凝胶结构中存在的交联点增多,制得的水凝胶的结构更稳定,其刚性也逐渐增强,力学强度较高,收缩溶胀能力降低,故响应性能也降低;而当交联度过高时,会使溶液的水溶性变差,溶胀度较低,水凝胶缺乏弹性,从而影响MIPs对目标物的识别能力。
2.7 MIPs的重复性
将同一片MIPs洗脱后测其德拜环,随后在其上滴加10 μL质量浓度1.0 mg/mL 的Con A溶液,测德拜环直径的变化,然后再用10%的乙酸溶液将Con A完全洗脱,结果如图6B所示。经过4次吸附-洗脱过程,MIPs仍然保持良好的重复性。
2.8 MIPs的特异识别性
为验证MIPs的特异识别性,选择与Con A结构相似的牛血红蛋白(BHb)、卵清白蛋白(OVA)、胰蛋白酶(Try)和溶菌酶(Lyz)进行对比实验。由图6C可以看出,MIPs在质量浓度均为1.0 mg/mL的BHb、OVA、Try和Lyz溶液中的德拜环直径变化依次为0.60、0.53、0.30、0.21 cm,明显小于MIPs在Con A(1.0 mg/mL)中的变化量(1.3 cm)。由此可见,MIPs对Con A有特异识别性。这种特异识别性主要是因为水凝胶印迹空穴与目标蛋白之间空间匹配,以及印迹空腔中富含的氨基和硼酸基团提供了多识别位点。
2.9 实际样品检测
本文进一步考察了Con A印迹二维光子晶体水凝胶在模拟生物样品中的传感性能。于胎牛血清原液(FBS)和稀释20倍的FBS(1/20)中添加一定量的Con A,使其终浓度为1.0 mg/mL,测试基底血清样品对目标分析物的干扰情况,结果如图6D所示。MIPs在FBS(1/20)、Con A、FBS(1/20)+Con A、FBS和 FBS+Con A中德拜环的变化量依次为0.23、0.94、0.86、0.21、0.78 cm。这一结果表明,FBS溶液中MIPs对Con A仍然具有较高的灵敏性和选择识别性,高浓度的干扰物质对目标分析物影响不大,所制备的MIPs表现出较强的抗干扰能力,有望用于FBS中Con A的快速检测。

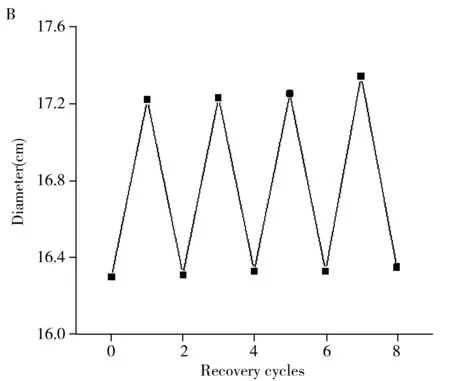


图6 不同交联度制备的MIPs吸附Con A后德拜环直径的变化(A),MIPs的重复使用性(B), MIPs和NIPs的选择性(C)及实际样品分析(D)Fig.6 Debye ring diameter changes of adsorbed Con A by MIPs prepared with different crosslinking degrees(A),reusability of MIPs(B),selectivity of MIPs and NIPs(C) and actual sample analysis(D)
3 结 论
本文通过无皂乳液聚合的方法合成了粒径733 nm的PS微球,采用垂直沉积法制备出色彩鲜艳的2D光子晶体,以糖蛋白Con A作为模板分子,于光子晶体表面制得一薄层印迹聚合物膜,通过引入苯硼酸基团,增加了目标糖蛋白的特异识别性能,实现了对Con A的特异性识别。所制备的MIPs具有可重复性和高选择性,可快速响应目标分子,适用于目标物的富集和即时检测。同时,水凝胶制备方法快捷方便,测量方式便利直观,不需特殊设备,具有很强的普适性,该制备方法可拓展到其它糖类分子。
