骨质疏松病理微环境对骨髓间充质干细胞生物学特性的影响
2020-05-06胡松华王乾兴郑学玲
胡松华,王乾兴,路 建,郑学玲,李 姣
(遵义医科大学 细胞生物学教研室,贵州 遵义 563099)
骨质疏松是一种以骨量低下、骨的微结构损坏,导致骨的脆性增加、骨折易发的骨病[1]。促进新骨形成被认为是从根本上防治该病的有效策略。新骨形成来源于骨髓间充质干细胞(Mesenchymal stem cells,MSCs),而MSCs所参与的骨重建需在骨髓微环境内进行,骨髓微环境为其基础[2]。即使骨髓微环境在病理状态下,其对干细胞的增殖分化这两大特性仍产生一定的调节影响[3]。骨质疏松患者的骨髓微环境被改变[4-5],极有可能影响了 MSCs 的正常生物学特性,导致其难以分化为成骨细胞,新骨形成受到抑制。前期研究中我们建立小鼠骨质疏松病理模型,并在体外分离培养了模型组及对照组骨髓 MSCs。研究发现,模型组 MSCs 增殖能力及多向分化潜能均与对照组有明显差异,表现为增殖能力下降,成骨细胞分化能力下降,但向脂肪分化能力增加[6]。这些研究结果提示长期处于病理微环境下的 MSCs 干性受到影响,难以发挥正常功能以对骨组织进行修复,可能是骨质疏松发病的关键原因。为进一步明确病理骨髓微环境对 MSCs生物学特性的影响,本研究分离了模型组及对照组小鼠骨髓液,并用于处理体外培养的正常 MSCs,通过细胞增殖、凋亡、迁移、多向分化等实验来检测 MSCs生物学特性的改变。
1 材料与方法
1.1 实验动物及材料 清洁级雄性 C57BL6/J 小鼠( 8周龄16 只、4周龄8只),体质量 20~25g,购自上海斯莱克实验动物有限公司[许可证号 SYXK(沪)2018-0062]。DMEM低糖培养基、胰蛋白酶、胎牛血清(FBS)均购自 Hyclone 公司;β-磷酸甘油、抗坏血酸、胰岛素、Dex、3-异丁基-1-甲基黄嘌呤、油红 O、茜素红均购自 Sigma公司;CKK-8 检测试剂盒及 TUNEL 染色试剂盒购自碧云天公司;抗 Osx(ab209484,兔源)、Runx2(ab23981,兔源)、C/EBPα (ab15048,兔源)抗体购自Abcam 公司;抗 PPARγ (2435,兔源) 抗体、HRP 标记抗兔 IgG 二抗(7074)购自 Cell Signal Technology 公司。
1.2 方法
1.2.1 动物模型建立 C57BL/6J小鼠(雄性、8周龄)正常饲养 1 周后随机分为两组,每组 8 只。骨质疏松模型组(OP 组):按 50 mg/kg 体质量皮下注射 Dex;对照组(NC 组):注射同等剂量生理盐水。OP 组及 NC 组小鼠每天注射 1 次,持续 5 周。小鼠处死后剥离右侧股骨及胫骨,除去结缔组织,以4%多聚甲醛固定12 h后,于12.5% EDTA溶液中脱钙3周,每3天更换1次脱钙液。脱钙结束后的骨组织标本经石蜡包埋、切片、苏木素-伊红(H&E)染色、拍照,并以ImageJ软件对骨小梁平均厚度(Tb.Th)、骨小梁面积(Tb.A)及骨小梁数目(Tb.N)进行统计分析,OP组骨小梁相关指标显著下降则说明骨质疏松模型成功建立。
1.2.2 骨质疏松骨髓液收集 OP组及NC组小鼠左侧后肢骨用于收集骨髓液。无菌环境下取左侧股骨及胫骨,剥离结缔组织,以无菌PBS漂洗3次。剪去骨骺两端后用无菌注射器取5 mL DMEM 低糖培养基冲出骨髓,以离心管收集后,1 000 rpm离心10 min除去骨髓细胞,收集上清再经10 000 rpm离心30 min除去细胞碎片等杂质,收集上清骨髓液,与正常培养基1∶1混合用于处理细胞。
1.2.3 MSCs体外培养及分化 另取正常C57BL/6J小鼠(8只,雄性,4周龄)处死后于75%乙醇中消毒10 min ,无菌环境下取左侧后肢骨,剪去骨骺两端后用 5 mL 无菌注射器取 DMEM 低糖培养基冲出骨髓细胞,裂解红细胞后收集细胞并接种于含有 10% FBS 的 DMEM 培养基正常培养。贴壁细胞传代3次后用于实验。
1.2.4 细胞增殖检测 采用 CCK-8 法检测细胞增殖情况。传代3次后的 MSCs 按5×103个/孔接种96孔板,并设置5个复孔。接种12 h细胞贴壁后更换为含有骨髓液的培养基,并计时为 0,继续培养6、12、24、48、60 h。每孔加入 CCK-8试剂,培养箱中反应2 h后,以Tecan Infinite F200 多功能酶标仪检测吸光度值(D450),并绘制增殖曲线。
1.2.5 细胞凋亡检测 取第 4 代 MSCs 以 1×104个/mL 的密度制作细胞爬片,贴壁培养12 h后更换为含有骨髓液的培养基,计时为0,继续培养12、24、48、72 h。细胞经 4%多聚甲醛固定,进行 TUNEL 染色(参照说明书进行)。以Hoechst 33258处理样本10 min对细胞核进行染色,PBS洗3次后封片,在荧光显微镜下随机选取3个视野计算凋亡细胞数。
1.2.6 细胞划痕实验 MSCs接种6孔板,贴壁12 h后更换含有骨髓液的培养基,并培养至100%汇合。以无菌牙签在细胞层上划线,PBS洗3次继续在含骨髓液的培养基中培养12 h。显微镜下观察培养前及培养后划痕的宽度及愈合情况。
1.2.7 Transwell实验 MSCs接种于24孔Transwell培养板(孔径8 nm)的上层小室,过夜培养至细胞贴壁后,更换含有骨髓液的培养基,继续培养12 h。上层小室内的细胞以棉棒擦除,迁移至膜另一侧的细胞经结晶紫染色后显微镜下观察。随机选取 3 个视野统计迁移细胞数。
1.2.8 细胞分化诱导 成骨细胞分化诱导:细胞以 1×104个/mL的密度接种6孔板,贴壁培养12 h后更换培养液为成骨诱导液(DMEM 高糖培养基含10%FBS、50 μmol/L 抗坏血酸、10 mmol/L β-磷酸甘油和 0.1 μmol/L 地塞米松),同时添加OP及NC组骨髓液,连续培养21 d,每3天更换1次含骨髓液的成骨诱导液。脂肪细胞分化诱导:细胞以 1×105个/mL 的密度接种 6 孔板,贴壁培养12 h后更换培养液成脂诱导液(DMEM 高糖培养基含10 μg/mL 胰岛素,10% FBS,0.5 mmol/L 3-异丁基-1-甲基黄嘌呤,10 μmol/L地塞米松),同时添加OP组及NC组骨髓液,连续培养8 d,每3天更换一次含有骨髓液的诱导液。
1.2.9 实时荧光定量PCR(Realtime PCR) 采用Trizol法提取细胞总 RNA。取 1 μg RNA 反转录为 cDNA,并以双蒸水稀释 10 倍后作为 Realtime PCR 的模板。扩增引物序列见表1。扩增反应在 Roche LightCycler480 上进行,反应程序为:94℃ 5 min,94℃ 10 s,60℃ 20 s,40个循环加溶解曲线分析 。扩增产物以β-actin作为内参标准化,以2-△△ Ct法计算基因表达量增加倍数。
表1 Realtime PCR引物序列

基因名称引物序列扩增片段长度Col1a1Forward: 5′- GAAGTCAGCTGCATACAC-3′Reverse: 5′-AGGAAGTCCAGGCTGTCC-3′312 bpOsxForward: 5′-TGGGAACAAGAGTGAGCTGG-3′Reverse: 5′-GTGAGCTTCTTCCTGGGTAGG-3′141 bpaP2Forward: 5′-AAATCACCGCAGACGACA-3′Reverse: 5′-CACATTCCACCACCAGCT-3′138 bpGlut4Forward: 5′-CTTGGCTCCCTTCAGTTTG-3′Reverse: 5′-TGCCTTGTGGGATGGAAT-3′130 bpβ-actinForward: 5′-CCCTGTATGCCTCTGGTCReverse: 5′-GTCTTTACGGATGTCAACG455 bp
1.2.10 Western blot 细胞以RIPA裂解液(含10% PMSF)冰上裂解30 min后,收集裂解液,并以12 000 rpm 离心10 min 收集上清总蛋白。总蛋白浓度以 BCA 法测 定 。 各 样 本 取 50 μg 蛋 白 进 行 十 二 烷 基 硫 酸 钠 - 聚 丙 烯 酰 胺 凝 胶 电 泳(SDS-PAGE)。蛋白转印至 PVDF 膜后,5%牛血清白蛋白(BSA)室温封闭1 h后,分别加入一抗:Runx2、Osterix、C/EBPα、PPARγ以及内参β-actin(1∶10 000稀释),4℃孵育过夜。次日洗膜3次后加入二抗(1∶10 000 稀释)室温孵育2 h,洗膜3次后采用辣根过氧化物酶标记的增强性化学发光法显色,X 胶片感光。
1.2.11 茜素红染色 细胞经成骨诱导21 d后,经70%乙醇固定1 h,双蒸水洗3次后加入40 mM茜素红染色液染色15 min,双蒸水洗5次后显微观察。
1.2.12 油红O染色 细胞脂肪诱导8 d后,吸弃培养液,以3.7%的中性甲醛固定10 min后,加入0.5%油红O染色1 h,多余染色液经70%乙醇漂洗后显微镜观察。
1.3 统计学处理 统计学分析以SPSS 17.0进行,采用配对样本Student’st检验比较组间差异。检验水准(α)为 0.05。图像定量分析采用ImageJ 1.8.0软件进行。
2 结果
2.1 骨质疏松病理骨髓液抑制MSCs增殖 前期研究发现骨质疏松模型组骨髓MSCs的增殖能力及成骨分化能力和正常MSCs相比明显下降,推测病理骨髓微环境改变了MSCs的生物学特性[6]。为进一步明确病理微环境对MSCs的影响,本研究利用糖皮质激素处理建立小鼠骨质疏松病理模型。骨组织学检测结果显示,与对照组(NC组)相比,模型组(OP组)小鼠有明显骨丢失表型(见图1)。骨计量学参数统计发现OP组小鼠骨小梁面积百分比(Tb.A)、骨小梁平均厚度(Tb.Th)以及骨小梁数目均显著低于对照(见表2),说明模型建立成功。分别收集OP组及NC组骨髓液,用于处理体外正常培养的MSCs。结果显示,OP组骨髓液处理下MSCs增殖能力明显下降,且差异具有统计学意义(见图2)。
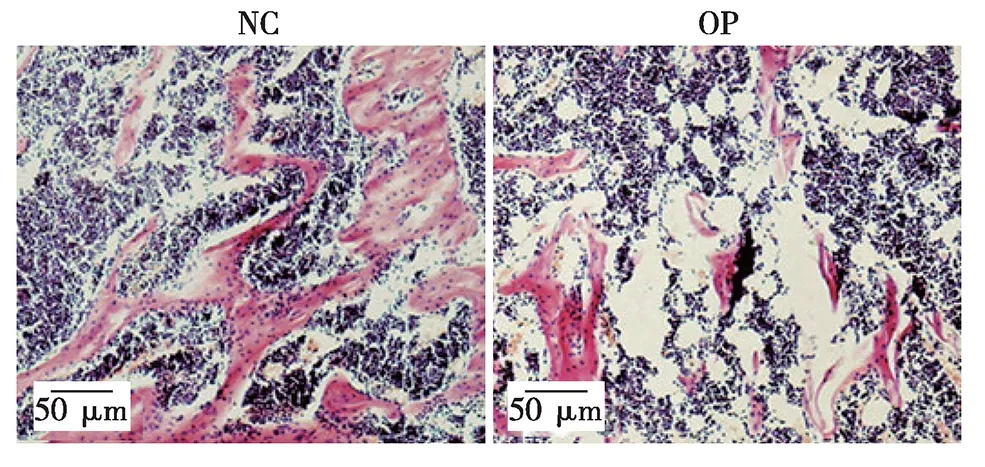
图1 NC组及OP组小鼠骨组织学形态
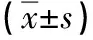

组别Tb.Th (mm)Tb.A (%)Tb.N (mm-1)NC0.053±0.00437.63±4.675.73±0.42OP0.026±0.003∗14.85±2.19∗3.87±0.22∗
* :P<0.05 vs NC 组,n=8。
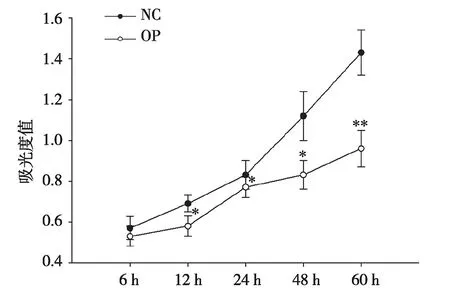
* :P<0.05 vs NC组,**:P<0.01vs NC组,n=3。图2 OP组及NC组骨髓液对MSCs增殖能力的影响
2.2 骨质疏松病理骨髓液促进MSCs凋亡 通过TUNEL染色检测OP组及NC组骨髓液处理MSCs后的凋亡情况。结果显示,OP组骨髓液处理MSCs 24 h后显著增加细胞凋亡,且凋亡细胞数量随处理时间的增加而增加,与NC组MSCs凋亡数量有差异,且差异具有统计学意义(见图 3)。
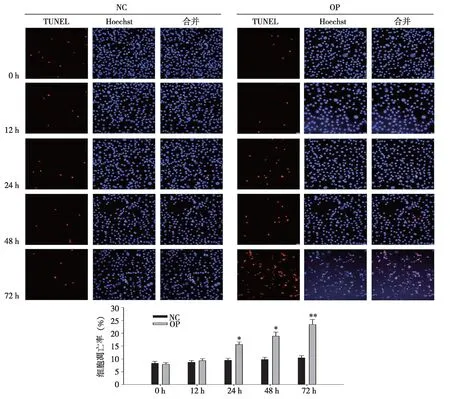
* :P<0.05 vs NC组,**:P<0.01vs NC组,n=3。图3 OP组及NC组骨髓液对MSCs凋亡的影响
2.3 骨质疏松病理骨髓液抑制MSCs 迁移 通过划痕实验及Transwell实验检测在不同微环境下MSCs的体外迁移能力是否发生改变。结果显示,OP组骨髓液所带来的病理微环境下,MSCs迁移能力明显下降(见图 4A),迁移细胞数显著减少(见图4B),且差异具有统计学意义(见图4C)。
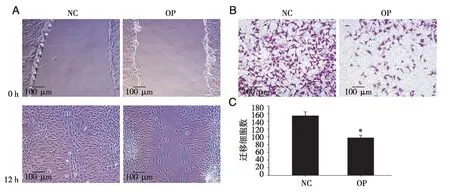
A:划痕实验检测MSCs迁移能力;B:transwell 实验检测细胞迁移能力;C:transwell 迁移细胞数统计;*:P<0.05 vs NC组,n=3。图4 OP组及NC组骨髓液对MSCs迁移的影响
2.4 骨质疏松病理骨髓液抑制MSCs成骨分化 在OP组及NC组骨髓液处理下,对MSCs进行为期21 d的成骨分化诱导。Realtime PCR结果显示NC组骨髓液处理下MSCs分化过程中高表达成骨分化基因OSX及Cola1,但OP组骨髓液处理下Osx及Colla1的表达量明显低于NC组,在分化7 d和14 d时最为显著(见图5A)。分化21 d后茜素红染色发现OP组骨髓液处理下矿化小结形成显著少于NC组(见图5B)。这些结果说明OP组骨髓液抑制了MSCs的成骨分化。

A:成骨分化诱导不同时间点相关基因表达量检测;B:成骨分化诱导21 d后茜素红染色;*:P<0.05 vs NC组,n=3。图5 OP组及NC组骨髓液对MSCs成骨分化的影响
2.5 骨质疏松病理骨髓液促进MSCs成脂分化 在OP组及对NC组骨髓液处理下,对MSCs进行为期8 d的成脂分化诱导。Realtime PCR结果显示OP组骨髓液处理下的MSCs高表达脂肪分化相关基因aP2及Glut4,其表达量显著高于NC组(见图6A)。油红O染色显示脂滴形成增加(见图6B)。这些结果说明OP组骨髓液促进MSCs分化为脂肪细胞。

A:脂肪诱导过程中相关基因表达水平检测;B:脂肪诱导8天后油红O染色;*:P<0.05 vs NC组,**:P<0.01 vs NC组,n=3。图6 OP组及NC组骨髓液对MSCs脂肪分化的影响
2.6 骨质疏松病理骨髓液影响MSCs分化相关转录因子的表达 采用Western blot实验检测OP组及NC组骨髓液处理下MSCs分化过程中成骨及脂肪分化相关转录因子的表达情况。结果显示,成骨诱导分化7 d后,NC组骨髓液处理下的MSCs高表达相关转录因子Runx2及Osx;而OP组骨髓液处理下二者表达量明显低于NC组(见图7A)。相反,OP组骨髓液处理下能促进脂肪细胞分化过程中转录因子C/EBPα及PPARγ的表达(见图7A)。表达差异均具有统计学意义(见图7B)。

A:Western blot 检测相关因子蛋白水平;B:Western blot 定量分析;*:P<0.05 vs NC组,**:P<0.01 vs NC组,n=3。图7 对MSCs成骨分化及脂肪分化过程中 OP 组及 NC 组骨髓液对相关转录因子表达的影响
3 讨论
目前,骨质疏松症发病率逐年升高。临床上对该病的主要治疗方法集中为通过药物抑制破骨细胞介导的骨吸收[7]。抑制骨吸收虽然能阻止骨组织被进一步破坏,但却无法促进新骨形成以修复已经受损的骨组织。因此促进新骨形成才是从根本上治疗此类疾病的关键[8]。骨形成依赖于骨髓中的MSCs。但临床及动物实验研究发现,骨质疏松者骨髓 MSCs 难以分化为成骨细胞,反而易分化为脂肪细胞[9-12],说明 MSCs 分化潜能被改变。我们的前期研究中全面分析了骨质疏松病理状态下 MSC 的生物学特性,发现与正常 MSCs 相比,骨质疏松 MSCs 增殖能力及向成骨细胞分化能力下降[6]。这些结果提示长期处于骨质疏松病理骨髓微环境下的 MSCs 受到病理微环境的影响,生物学特性被改变,难以分化为成骨细胞来补充被吸收的骨组织。因此,本研究通过收集骨质疏松小鼠骨髓液,用于体外模拟病理骨髓微环境,进一步探讨病理微环境下 MSCs 生物学特性的改变及其分子机制。
干细胞基本生物学特性包括自我更新、增殖能力及分化为至少一种体细胞的能力。本研究中发现处于病理骨髓微环境下的 MSCs 增殖能力明显下降。这一发现与我们前期研究结果一致[6],提示病理骨髓微环境抑制 MSCs 增殖,使得 MSCs无法自我更新。此外,我们还发现病理微环境下细胞凋亡增加。由此可推测,病理微环境下的 MSCs 难以自我更新,同时易凋亡,导致其本身数量逐渐减少。骨髓中干细胞耗竭使得被吸收的骨组织难以修复,可能是导致骨丢失的关键原因之一。值得注意的是,前期研究中我们从骨质疏松模型小鼠中分离的 MSCs 在体外培养时并未发现凋亡水平增加[6],提示离开病理微环境后 MSCs 不再凋亡,进一步证明病理骨髓微环境对 MSCs 凋亡有重要的影响。病理骨髓微环境以慢性炎症及氧化应激为特点[4,10],炎症因子 TNF-α、IL-1 以及氧自由基含量增加,这些因子都能诱导细胞凋亡[13]。而 MSCs 脱离病理微环境后,在体外正常培养时凋亡不再发生,但增殖能力仍未能得到恢复,其中分子机理需要进一步的研究。
MSCs 在体内修复骨组织的第一步是感受到骨吸收时释放到骨髓腔中的趋化因子,并跟随趋化因子的浓度梯度向骨吸收表面迁移,然后再在骨表面分化为成骨细胞,以此形成骨吸收与骨形成的精确偶联[14]。因而 MSCs 的迁移能力也是影响体内骨形成一个关键因素。本研究发现病理骨髓液抑制 MSCs 迁移,提示在体内病理骨髓微环境中,MSCs 难以向骨形成表面迁移,可能同样是导致骨形成下降的关键因素之一。
MSCs 具有多向分化潜能,能分化为成骨细胞、脂肪细胞、肌细胞及软骨细胞。其中成骨细胞与脂肪细胞分化存在一种竞争性的平衡关系[6]。骨质疏松患者骨髓腔中出现大量的脂肪组织,提示在病理微环境下 MSCs 分化平衡被破坏,易成脂而难成骨。本研究在骨质疏松骨髓液处理下对 MSCs 进行为期 21d 的成骨分化诱导,结果发现与对照相比 MSCs 难以分化为成骨细胞,相关基因表达下降,且形成的矿化小结明显减少。相反,病理微环境下 MSCs 更容易分化为脂肪细胞。前期研究中发现骨质疏松小鼠 MSCs 的成骨成脂分化平衡被破坏[5],本研究确证了其分化潜能改变是受到病理骨髓微环境的影响。MSCs 的分化命运是由几个关键转录因子来决定的。这些转录因子一旦表达后,就能驱动分化相关基因的表达,从而启动细胞分化。为进一步探索病理微环境影响对 MSCs 分化潜能的机制,我们检测了成骨分化及脂肪分化中关键转录因子的表达改变情况。结果发现病理骨髓液能抑制成骨细胞分化的关键转录因子 Runx2 及 Osx 的表达,而高表达脂肪细胞分化的关键转录因子 C/EBPα及 PPARγ。这些结果说明病理微环境能影响MSCs 分化过程中相关转录因子的表达水平,及有可能是导致 MSCs 分化潜能改变的关键原因。
综上所述,骨质疏松时骨髓微环境发生病理改变,而骨髓微环境作为 MSCs 增殖分化等功能发挥作用的外部条件[15],其病理微环境改变将对体内残存正常 MSCs的分化功能产生病理影响,主要表现为骨质疏松病理骨髓微环境抑制 MSCs 增殖和迁移,促进其凋亡,同时改变了 MSCs 的分化潜能。以上影响均导致骨质疏松时正常 MSCs 难以分化为成骨细胞来修复受损骨组织,导致骨重建遭到破坏。这些结果提示,通过药物改善病理骨髓微环境,激活自身 MSCs 活性可能是防治骨质疏松的有效方法之一。
