泛素连接酶E6AP敲减及过表达稳转细胞株的构建与鉴定
2020-04-30彭康莉赵博
彭康莉,赵博
(上海交通大学药学院,上海 200240)
人乳头瘤病毒E6相关蛋白(E6-associated protein,E6AP)是一种泛素E3连接酶,由基因UBE3A编码,可参与细胞中底物的泛素化[1-2]。UBE3A基因位于人类染色体15q11.2-q13.3,在神经元中,母亲遗传的UBE3A基因拷贝具有功能,来自父亲的基因拷贝则处于失活或者沉默状态,此现象被称为基因组印记[3]。UBE3A基因拷贝数变异会导致E6AP过表达,引发孤独症谱系障碍(autism spectrum disorders,ASDs)[4],其特征表现为交流能力受损,重复行为增多;UBE3A基因缺失或突变则会引发天使综合征(Angelman syndrome,AS)[3],伴随严重精神发育迟缓、言语障碍、癫痫发作等症状。由此可见,UBE3A基因表达量的调控对于神经发育具有重要的作用。
在真核细胞中,在泛素活化酶(ubiquitin-activating enzyme,E1)、泛素结合酶(ubiquitin-conjugating enzyme,E2)、泛素连接酶(ubiquitin-ligase enzyme,E3)的级联作用下,泛素传递至底物对其进行泛素化修饰[5]。泛素化作为一种蛋白质翻译后修饰可介导底物蛋白经蛋白酶体降解的过程,同时也参与了细胞周期、DNA代谢、信号传导等细胞生理过程的调控[6]。在泛素化修饰中,泛素连接酶E3决定了底物识别的特异性,然而如何找到并鉴定细胞中600多种E3对应的下游底物是目前底物泛素化研究的难点。E3与底物的复杂交叉反应使得难以通过RNA干扰等技术来找到特定E3对应的底物。
E6AP是一种HECT(homologous to the E6AP carboxyl terminus)E3,泛素先传递至HECT E3上,再通过HECT E3传递至底物[7]。E6AP最初被鉴定为100 kDa的蛋白,在人乳头瘤病毒16型(HPV)的 E6癌蛋白的作用下,发挥E3活性,参与底物p53的泛素化修饰过程[7-8]。E6AP除了与E6作用发挥泛素连接酶活性外,自身也可作为泛素连接酶泛素化底物。通过酵母双杂交系统的方法,E6AP的泛素化底物Src家族酪氨酸激酶(B-cell lymphocyte kinase,Blk)[9]、人源化DNA修复蛋白(DNA repair protein,Rad23)[10]相继被发现。
鉴于E6AP在神经系统发育过程中的重要性,越来越多的研究试图阐明E6AP的作用机制。Greenberg组报道经验驱动的神经元活动会诱导UBE3A基因转录,随后其编码的E6AP蛋白通过调控活动调节的细胞骨架相关蛋白(activity-regulated cytoskeleton-associated protein,Arc)的降解来调节兴奋性突触发育[11]。该组报道E6AP通过蛋白酶体促进Arc的降解,同时也通过质谱证实E6AP对Arc的泛素化调节。该组通过研究发现E6AP是一种神经元活性调节蛋白,在神经元无法正常表达E6AP的情况下,会上调Arc的表达,神经元中积累过多的Arc则会导致突触中AMPA受体(AMPARs)过度内在化以及突触功能受损。AMPA受体运输受损可能是导致天使综合征患者认知功能障碍的病因。
由于突触功能障碍也是阿尔兹海默症的主要特征,最近有研究报道在阿尔兹海默症模型小鼠Tg2576中,E6AP表达量降低,导致Arc积累,从而使得AMPAR亚基GluR1在膜表面表达量降低,最终导致突触功能改变。而通过恢复神经元中E6AP 的表达则可改善上述现象[12],由此可见E6AP对Arc的泛素化调节可作为治疗神经系统疾病的新途径。
通过哺乳动物氨基酸的稳定同位素标记法,一种蛋白磷酸酶2 A(protein phosphatase 2 A,PP2A)的激活剂PTPA经报道也是E6AP的底物[13]。随着越来越多的底物被发现,E6AP对底物的泛素化修饰如何影响底物的下游功能是后续研究的难点。
本文成功构建E6AP敲减及过表达稳转细胞株,以已知底物Arc为阳性对照,发现E6AP敲减组可降低对Arc的泛素化修饰,与之对应的E6AP过表达组则会增强对Arc的泛素化修饰。后续我们将以构建好的两种细胞模型为基础,进一步研究一些与疾病相关的底物的泛素化,并从中发现细胞中未知的E6AP底物,为底物相关疾病的治疗方法提供新的思路。
1 材料与方法
1.1 材料
人胚肾细胞HEK-293购自中国科学院细胞库;胎牛血清、0.25% 胰蛋白酶购自Gibico公司;DMEM培养基、opti-MEM培养基购自Hyclone公司;大肠杆菌XL-1 Blue感受态细胞菌种购自天根生化科技(北京)有限公司;4种靶向E6AP的shRNA慢病毒GIPZ质粒购自GE Dharmacon(Lafayette,CO);pRK-myc-Arc质粒由本室保存;pLVX-IRES-mCherry 质粒由本室保存;KOD-Plus-Neo Kit、RNA反转录试剂盒均购自东洋纺(上海)生物科技有限公司;Gel/PCR纯化提取试剂盒、质粒小提试剂盒均购自Favorgen公司;Trizol裂解试剂、Fast Digest限制性内切酶、10x Fast Digest Buffer、T4 DNA Ligase、10×T4 DNA Ligase Buffer均购自Thermo Fisher公司;转染试剂PEI 购自Polysciences公司;MG132购自Millipore公司;protein A/G beads、抗体anti-E6AP、anti-myc、anti-Ub、anti-actin均购自Santa Cruz公司;引物合成、质粒测序均由金唯智(上海)有限公司完成。
1.2 方法
1.2.1 细胞培养
从液氮中取出冻存的细胞置于37 ℃ 水浴锅中融化,完全融化的细胞悬液倒入含有新鲜完全培养基的试管中,离心后弃掉上清,用培养基重悬细胞沉淀后接种至培养皿进行培养;定期观察细胞长势,并适时给细胞换液或传代。
1.2.2 过表达载体pLVX-E6AP-IRES-mCherry质粒构建
1.2.2.1 从HEK-293细胞中提取RNA
以12孔板为例,吸出培养基后,每孔加入500 μL Trizol试剂,置于摇床上5 min;待细胞裂解完全后,转移裂解液至1.5 mL EP管中,每管加入100 μL氯仿,混匀后静置3 min;离心(4 ℃,13 000 g)15 min,吸取上层液体于新的EP管中,每管加入250 μL异丙醇,混匀后静置7 min;离心(4 ℃,13 000 g)10 min,小心移去上清液,加入500 μL 75%乙醇悬浮管底白色沉淀;离心(4 ℃,7 500 g)5 min,小心吸去上清液,EP管倒置10 min;待EP管中无液体残留后,加入适量DEPC水至EP管中溶解RNA。
1.2.2.2 RNA反转录及PCR扩增
根据RNA浓度计算出1 μg RNA对应的RNA体积,加入DEPC水使得总体积为7 μL/管;RNA样品置于PCR仪中在 65 ℃ 中反应5 min,取出后放置于冰上,加入RNA 反转录试剂盒中0.5 μL Primer Mix、0.5 μL Enzyme Mix以及2 μL缓冲液于RNA样品中,使得总体积为10 μL/管;重新置于PCR仪中,37 ℃ 反应60 min,95 ℃ 5 min使得酶失活,反应结束后冷却至4 ℃ 得到cDNA样品。
以cDNA为模板,加入E6AP上下游底物,按照KOD酶说明设置PCR反应体系,样品混匀后置于PCR仪中,按照以下程序进行PCR扩增反应:94 ℃ 预变性2 min,98 ℃ 变性10 s,60 ℃ 退火30 s,68 ℃ 延伸1 min,反应35个循环,最后68 ℃ 延伸7 min,得到的PCR产物可于4 ℃ 保存。
1.2.2.3 pLVX-IRES-mCherry载体酶切及与E6AP目的基因连接
用限制性内切酶BamHI、SpeI对pLVX-IRES-mCherry载体及E6AP PCR产物进行酶切处理,经琼脂糖凝胶电泳分离后,回收得到载体及目的基因片段,加入T4 DNA连接酶,16 ℃ 连接过夜。
连接产物取2 μL加入至 50 μL XL-1 Blue感受态细胞中,经电转化后,加入1 mL SOC于37 ℃ 复苏1 h。涂布于Amp的LB平板上,平板倒置于37 ℃ 培养箱过夜。次日从平板上挑取4~6个单克隆,提取质粒后经测序鉴定重组质粒是否构建成功。
1.2.3 质粒转染HEK-293 细胞
待HEK-293细胞融合度达到70%~90% 后,准备2个管,分别加入opti-MEM培养基;再将适量质粒加入其中1个管,按照质粒质量3倍体积量加入PEI转染试剂至另1个管中,室温静置5 min后,将两管混合,室温孵育20 min;吸出原有细胞培养液,换成opti-MEM培养基,再缓慢滴入质粒与转染试剂混合液;置于培养箱中培养6~8 h后,换成完全培养基;继续培养至48~72 h收细胞做后续western验证实验。若质粒上带有EGFP或mCherry标签,可通过检测荧光的强弱来观察质粒转染效率。
1.2.4 E6AP敲减及过表达稳转细胞株构建
1.2.4.1 嘌呤霉素杀灭曲线确定最适抗生素浓度
按每孔2~5×104的细胞密度铺板24孔板,培养24 h后观察细胞生长状态;若密度在30%~50%,可准备筛选培养基—嘌呤霉素浓度分别为0、0.5、1、1.5、2、3、4、5 μg/mL的新鲜完全培养基,吸去原培养基,加入筛选培养基进行细胞培养;2~3 d更换新鲜筛选培养基,连续观察4~6 d,能够杀死细胞的最低筛选浓度即为最适浓度。
1.2.4.2 E6AP 敲减及过表达稳转细胞株筛选
按每孔1×106的细胞密度铺板6孔板,观察细胞长势;若密度在50%~70%,则可转染购自Dharmacon的4种不同shE6AP质粒以及pLVX-E6AP-IRES-mCherry过表达质粒;转染48 h后,胰酶消化转染后的细胞,用最适浓度嘌呤霉素筛选培养基悬浮细胞沉淀,按照合适比例稀释悬液,重新接种至10 cm细胞皿进行培养。
每日观察细胞状态,待出现贴壁细胞后,约2~3 d更换新鲜筛选培养基;维持筛选浓度培养10~14 d,挑取显微镜下不同单克隆细胞于24孔板中继续培养;待24孔板细胞长满后,转移至6孔板。6孔板细胞长满后,可收集部分细胞做后续western实验验证筛选是否成功;若E6AP表达明显降低或增强,则可扩大培养,并及时冻存。
1.2.5 免疫共沉淀验证E6AP泛素化底物Arc
shE6AP、shE6AP+E6AP、HEK-293、E6AP 过表达四种细胞转染pRK-myc-Arc 48 h后经10 μmol/L MG132处理4 h;冰PBS洗2次,加入预冷的RIPA(含蛋白酶抑制剂)进行裂解;置于4 ℃ 15 min,细胞裂解液转移至1.5 mL 管,离心(4 ℃,13 000 g)30 min后将上清转移至新的EP管;对细胞裂解液定量,取总蛋白3 mg,加入6 μg anti-myc抗体于4 ℃ 孵育4 h,再加入30 μL protein A/G beads孵育过夜;次日结合了beads的细胞裂解液离心(4 ℃,13 000 g)5 min,吸去上清;beads用1 mL PBS洗涤4次,结束后用30 μL PBS重悬beads,再加入上样缓冲液,煮沸10 min;取上清上样,经4%~15% SDS-PAGE胶分离后,转膜封闭,膜用anti-Ub抗体孵育过夜。
1.2.6 Western印迹分析及定量
SDS-PAGE电泳结束后,半干法转膜,可看到蛋白Marker显示在PVDF膜上,将膜置于5% 脱脂牛奶中室温封闭1 h;用5% 脱脂牛奶以1∶1 000比例稀释孵育膜的抗体,置于4 ℃ 摇床上孵育过夜;次日用含0.05% Tween-20及0.05% Triton X-100的TBST缓冲液洗膜,每次10 min,共3次;用一抗对应的辣根过氧化物酶(HRP)标记的鼠/兔二抗1∶10 000(稀释)室温孵育1 h;用TBST缓冲液洗膜3次后,加入显影液,静置1 min,去尽残液,置于X-光片夹中,于暗室压片显影。
利用惠普扫描仪采集图片,用ImageJ软件对目的蛋白及内参蛋白条带进行灰度分析得到灰度值,将二者的灰度值相除,进行归一化处理。
2 结果
2.1 pLVX-E6AP-IRES-mCherry质粒构建
以人胚肾293细胞cDNA为模板进行PCR扩增得到的全长E6AP片段大小符合预期值(图1A)。构建好的质粒通过双酶切验证,可看到载体与目的基因条带分开,条带大小与预期一致(图1B),测序结果显示质粒构建成功。
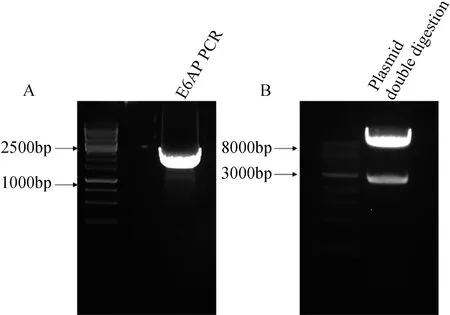
图1 E6AP PCR片段及E6AP过表达质粒双酶切鉴定
2.2 瞬时转染shE6AP质粒至HEK-293细胞
将4种shE6AP1、shE6AP2、shE6AP3、shE6AP4 质粒瞬时转染至HEK-293细胞,由于载体上带有EGFP荧光标签,于荧光显微镜下可观察到85% 以上的细胞表达绿色荧光蛋白(图2A、2B),转染效率较高。
待转染48 h后,收集细胞做western验证,与对照组相比,4种shE6AP均未明显降低E6AP表达(图2C)。
2.3 shE6AP稳定转染细胞株的筛选
由于瞬时转染shE6AP质粒未能明显降低E6AP表达,我们猜测可能是因为E6AP半衰期较长,表达较稳定,难以在短时间内检测到表达量的变化。由于载体上带有嘌呤霉素筛选标记,故而可通过药物筛选得到能稳定降低E6AP表达的细胞株。嘌呤霉素杀灭曲线显示最适浓度为2 μg/mL,后续实验以此浓度筛选稳转细胞株。
由于瞬时转染后的细胞裂解液western结果显示4种shE6AP无明显差别,故分别以这4种shE6AP筛选4种不同稳转细胞株。
药物筛选维持一个月后,通过比较不同组细胞株中E6AP表达情况,可发现shE6AP2稳转细胞株对E6AP表达的抑制作用最强(图2D、2E),故以此稳转细胞株进行后续研究。

注:*P<0.05,**P<0.01,***P<0.001图2 shE6AP 质粒瞬时转染及稳转细胞株表达情况分析
2.4 瞬时转染E6AP过表达质粒至HEK-293细胞
将构建成功的pLVX-E6AP-IRES-mCherry质粒瞬时转染至HEK-293细胞,由于载体上带有mCherry荧光标签,于荧光显微镜下可观察到85% 以上的细胞呈现较强红色荧光(图3A、3B),转染效率较高。转染48 h后,收集细胞蛋白。
Western结果显示瞬时转染过表达质粒组与对照组相比,E6AP的表达量明显增加(图3C)。
2.5 E6AP过表达稳定转染细胞株的筛选
瞬时转染结果显示构建的E6AP过表达质粒能显著增强E6AP表达,但瞬时转染持续时间短,目的基因会随着细胞分裂而逐渐丢失,而稳转细胞株则能保证目的基因持续稳定表达,易于研究基因功能。
由于E6AP过表达载体上带有嘌呤霉素筛选标记,故而可通过嘌呤霉素筛选培养基培养细胞,直至得到能稳定过表达E6AP的细胞株。
药物筛选维持一个月后,我们挑取6个细胞株通过western实验比较不同细胞株中E6AP表达情况,结果显示3个细胞株与对照组相比均能显著增强E6AP表达(图3D、3E),其余3个细胞株与对照组相比E6AP表达量差别不大,我们猜测可能是由于E6AP过表达基因未能成功整合至细胞自身的基因组上,故而未能增强E6AP表达。将筛选成功的3个细胞株扩大培养后,进行后续研究。

注:*P<0.05,**P<0.01,***P<0,001图3 E6AP过表达质粒瞬转及稳转细胞株表达情况分析
2.6 E6AP敲减及过表达稳转细胞株对底物Arc的泛素化影响(图4)
由于E6AP是一种泛素E3连接酶,在细胞中敲减或者过表达E6AP,其下游底物泛素化可能会发生相应变化。
为验证猜想,我们以E6AP已知底物Arc为阳性对照,比较shE6AP、shE6AP+E6AP、HEK-293以及E6AP过表达4组细胞对Arc泛素化修饰的区别。由于HEK-293细胞本底不表达Arc,故转染pRK-myc-Arc至4组细胞。转染48 h后,4组细胞裂解液经anti-myc抗体捕获后孵育anti-Ub抗体以检测泛素化修饰水平强弱。
结果显示,与HEK-293组相比,shE6AP组泛素化smear条带最弱(图4B),说明shE6AP组可降低对Arc的泛素化修饰。与之对应的E6AP过表达组泛素化smear条带最强(图4B),说明E6AP过表达可增强对Arc的泛素化修饰,而shE6AP细胞转染E6AP后,则可恢复对Arc的泛素化修饰功能(图4B),其泛素化smear条带与HEK-293组相比差别不大。
这些结果表明E6AP表达量上调或下调,会相应影响下游底物泛素化。

A—shE6AP、shE6AP+E6AP、HEK-293、E6AP过表达4种细胞裂解液E6AP、actin表达情况;B—4种细胞裂解液经anti-myc抗体捕获后孵育anti-Ub抗体检测泛素化修饰水平强弱图4 E6AP敲减及过表达稳转株对Arc的泛素化影响
3 讨论
尽管UBE3A基因被发现距今25年,但对其在细胞中行使的生物学功能以及参与的细胞过程仍知之甚少。据报道UBE3A基因编码的E6AP蛋白活性失调会引发宫颈癌、天使综合征、孤独症谱系障碍等病症。宫颈癌主要是由小的双链DNA病毒HPV感染黏膜引起[14],导致病毒早期基因E6持续表达癌蛋白E6,E6蛋白与E6AP形成复合物,发挥泛素E3连接酶活性,对p53进行多聚泛素化修饰,随即降解p53,而p53作为一种重要的肿瘤因子经泛素化降解失活后则会诱发癌变[15]。E6AP除了与E6作用发挥泛素连接酶活性外,自身也可作为泛素连接酶泛素化底物,前述提到的Blk[9]、Rad23[10]、Arc[11]、PP2A[13]均为E6AP非依赖于E6而直接作用的底物。
天使综合征(Angleman Syndrome,AS)是一种罕见的神经发育障碍病症,患者有言语障碍、抽搐、癫痫发作等症状[16],经报道AS的病因是UBE3A基因表达受损,由于UBE3A基因在神经元中存在基因组印记现象,母本等位基因是UBE3A基因表达E6AP蛋白的唯一来源。在AS小鼠模型中,通过使来自父本的Ube3a基因在神经元中维持非沉默状态,可部分恢复小鼠Ube3a基因功能,促进E6AP的表达,改善由AS引发的认知缺陷[17]。
孤独症谱系障碍(Autism Spectrum Disorders,ASD)是一种异质性神经发育障碍,其特征是社交互动受损和重复性行为[18]。关于ASD的病因仍存在争议,但研究表明UBE3A基因复制或三重复制会导致E6AP表达增强,同时也伴随孤独症特征水平升高[19]。有研究报道,随着小鼠核中Ube3a基因表达E6AP增加,小鼠社交能力所需的谷氨酸能突触形成区Cerebellin-1(Cbln1)的表达会随之降低。E6AP可能通过其转录共调节功能抑制Cbln1的表达,而不是通过泛素化降解机制[20],这表明E6AP可能是通过非泛素化修饰途径影响ASD。
在E6AP对相关疾病的调控中,目前的研究大多数都集中于寻找疾病模型中E6AP对应的下游靶点,探究E6AP对底物的泛素化修饰或者转录调节功能,为阐明疾病可能的发病机制提供理论依据。
虽然通过酵母双杂交系统等方法,越来越多的E6AP下游底物被发现,但E6AP对这些底物的泛素化修饰如何影响其功能却未有很多报道。在研究较多的AS及ASD病症中,仍未发现与这些病症紧密相关并且可受E6AP调控的底物。本文从调控HEK-293细胞中E6AP表达量入手,一方面通过可特异性结合E6AP mRNA的shRNA抑制E6AP表达,另一方面则通过构建E6AP过表达质粒增强其表达。为实现基因的稳定表达,本文通过嘌呤霉素筛选得到能稳定敲减以及过表达E6AP的细胞株。在此基础上,以已知底物Arc为阳性对照,本文通过免疫共沉淀实验验证在E6AP敲减及过表达的情况下,可相应影响HEK-293细胞中Arc的泛素化修饰水平,不仅再次鉴定Arc是E6AP的底物,更是证明本文成功构建的两种稳转细胞株可用于E6AP下游底物功能研究。后续我们将以构建好的两种细胞模型为基础,进一步研究一些与疾病相关的底物的泛素化,并从中发现细胞中未知的E6AP底物,从泛素化降解的角度提供治疗底物相关疾病的新方法,以期阐明E6AP在细胞生命活动中发挥的作用。
