油松谷胱苷肽转移酶Tau1单体结构稳定性研究
2020-04-21王晓霞杨海灵毛建丰王晓茹
王晓霞,杨海灵,毛建丰,王晓茹
(北京林业大学生物科学与技术学院,北京 100083)
谷胱苷肽转移酶(Glutathione S-transferases,GSTs; EC 2.5.1.18)是一类具有多种功能的蛋白质超家族。最早发现GSTs能够催化还原型谷胱苷肽( GSH)的巯基与异源生物和内生生物来源的各种不同结构化合物的亲电子基团结合形成R-SG复合物,增加这些化合物的疏水性,使其易于排出细胞膜,分解之后排出体外,从而达到解毒的作用[1];其后发现GST还具有连接、信号转导等多种生理功能[2],并将具有GSH依赖的转移酶、过氧化物酶、异构酶和氧化还原酶以及转运功能的蛋白定义为GST蛋白超家族成员[3]。基于基因的结构、蛋白序列的相似性、关键氨基酸位点的保守性、底物专一性以及免疫交叉反应等特征可将GST超家族成员分为多个亚家族[4]。植物 GST可分为10 类:Tau、Phi、Lambda、DHAR、Theta、Zeta、EF1Bγ、TCHQD、Iota和 Hemerythrin[5-7],其中,Tau类GST不仅是植物特有的亚类,也是成员最多的亚类,参与保护细胞免受各种生物和非生物胁迫[8-11],以及光信号下细胞伸长和开花的调控[12]。
Tau GST都是以二聚体形式发挥其功能的,单个亚基大约23~30 kDa[13]。每一个亚基都包含独立的催化部位,包括一个GSH特异结合位点(G位点),位于蛋白N端及C端结构域形成的V型区域表面,和一个结合疏水底物的位点(H位点),主要位于蛋白C端,G位点与H位点由5~10个氨基酸残基的linker区连接。G和H位点在结合和催化底物反应时会发生构象变化,具有一定程度的可变性[14]。因此,为了保持GST蛋白催化活性,需要稳定G位点和H位点的空间结构。
本课题组前期的研究显示,裸子植物油松(Pinus tabulaeformis)中一个 Tau类 GST基因(PtGSTU1)在油松不同组织部位均表达,其编码的蛋白对典型的 GST底物 1-氯-2,4-二硝基苯( CDNB) 和 7-氯 -4-硝 基 苯 并 -2-氧 杂 -1,3-二 唑(NBD-Cl)具有高活性和较高的亲和力,其蛋白的Ser13、Lys40、Ile54、Glu66和Ser67为谷胱苷肽结合(G-位点)残基,对底物特异性和GSH的亲和力具有重要作用,同时这些位点的替换能够影响蛋白的稳定性[15-16]。本研究中,笔者进一步探讨PtGSTU1的单体稳定性,根据蛋白三维结构模拟预测出在单体结构稳定性中具有关键作用的氨基酸位点,利用定点突变对这些位点进行氨基酸分子替换,通过酶学功能检测,解析这些位点对蛋白稳定性的影响。
1 材料和方法
1.1 结构模拟
本研究选取了一个油松Tau类谷胱苷肽转移酶为研究对象,利用PtGSTU1[16]的蛋白序列(GenBank No. AAT69969)进行结构模拟。利用PtGSTU1蛋白序列在 Protein Data Bank(https://www.rcsb.org/)数据库中搜索结构模板,使用默认参数利用SwissModel[17]进行结构模拟。
1.2 构建PtGSTU1突变体
以含有PtGSTU1编码序列的重组载体为模板,通过PCR进行定点突变。对于Arg 18突变体,利用诱变正向引物(R18X -F)和反向引物(PtGSTU1-R)进行PCR扩增。PCR反应混合物含有10 pmol的每种引物,1 U的pfx Taq DNA聚合酶(Invitrogen Life Technologies,USA),0.3 mmol·L-1的各种 dNTP(Amersham Pharmacia Biotech,USA),1 mmol·L-1MgSO4和 1~3 ng 的模板 DNA,反应体系为50 μL。优化的PCR条件为:94℃下变性2 min,94℃ 15 s,55℃退火30 s和68℃延伸60 s,反应30个循环,最终延伸2 min。对于103位突变体,进行两轮PCR,第一轮PCR分别用正向引物(PtGSTU1-F)和诱变反向引物(D103A-R)、反向引物(PtGSTU1-R)和诱变正向引物(D103AF)分别进行扩增,获得2个片段。用GFX PCR DNA and Gel Band Purification Kit(Amersham Pharmacia Biotech,USA)纯化第一轮反应产物。第一轮PCR产物在目的突变位点产生短片段重叠区段。第二轮PCR使用正向(PtGSTU1-F)和反向(PtGSTU1-R)引物,以第一轮2个重叠的PCR产物为模板进行拼接。PCR反应条件与上述相同,所有引物见表1。对两个突变位点的PCR最终产物使用GFX PCR DNA and Gel Band Purification Kit(Amersham Pharmacia Biotech)从1%琼脂糖凝胶中回收PCR产物中的DNA片段。纯化的DNA片段和表达载体pET30a(Novagen,Madison,WI)分别用相应的限制性内切酶消化后进行重组。所得质粒用于转化大肠杆菌BL21。重组载体利 用 BigDye( Applied Biosystems, Foster City,CA)进行测序验证。

表 1 引物序列Table 1 Primer sequences
1.3 重组PtGSTU1和突变体的表达和纯化
将含有重组pET30a质粒的大肠杆菌BL21过夜培养,然后以1:100稀释,震荡培养直至光密度(A600)达到0.5;加入0.1 mmol·L-1IPTG诱导蛋白表达,并分别在37、25、20℃下继续培养8 h;4℃以6 500 g离心10 min收集菌体,重悬于结合缓冲液(20 mmol·L-1磷酸钠,0.5 mol·L-1NaCl,20 mmol·L-1咪唑,pH值7.0)中,低温超声破碎;然后将匀浆在4℃下以10 000 g离心10 min。通过SDS-PAGE分析所得沉淀和上清液。
确定成功表达可溶蛋白后,剩余的上清液上样到已用结合缓冲液预平衡的Ni Sepharose High Performance柱(Amersham Pharmacia Biotech)上。用洗脱缓冲液(20 mmol·L-1磷酸钠,0.5 mol·L-1NaCl,500 mmol·L-1咪唑,pH 值 7.0)洗脱与 Ni Sepharose High Performance柱结合的目的蛋白质。使用PD-10柱(Amersham Pharmacia Biotech)对蛋白溶液进行脱盐,脱盐缓冲液为10 mmol·L-1Tris-HCl缓冲液(pH值7.0)。
1.4 酶学活性及热稳定性测定
根据 Habig等[1]描述的测定方法,测定GST对CDNB(1-chloro-2,4-dinitrobenzene)、ECA(ethacrynic acid)和4-NPA(4-nitrophenyl acetate)底物的催化活性。利用Ricci等[18]所述方法,测定对 NBD-Cl( 7-chloro-4-nitrobenzo-2-oxa-1,3-diazole)的催化活性。所有测定均在25℃下进行。根据Lowry等[19]的方法计算蛋白质浓度。使用梯度浓度(0.1 至 1 mmol·L-1)的 GSH(glutathione)和 1 mmol·L-1的CDNB测定对 GSH的米氏常数(Km)和酶被底物饱和时的反应速度(Vmax)。使用梯度浓度(0.1至 1 mmol·L-1)的 CDNB和1 mmol·L-1的 GSH测定对 CDNB的米氏常数(Km)和酶被底物饱和时的反应速度(Vmax)。将数据绘制为双倒数Lineweaver-Burk图以确定Km和Vmax值。
从25~65℃,以5℃间隔的温度梯度温育样品15 min后测定对CDNB的底物活性。分别对野生型(Wild type)和突变体 D103A(0.45 mg·mL-1蛋白溶于 10 mmol·L-1Tris-HCl,pH 值 7.0)绘制热稳定性曲线。
2 结果与分析
2.1 PtGSTU1单体结构分析
用PtGSTU1蛋白序列搜索蛋白质结构数据库,获得最优模板为一个节节麦Tau类GST晶体(TaGSTU4,PDB id为1 gwc)。以TaGSTU4晶体结构为模板进行同源建模,获得模拟的PtGSTU1蛋白三维结构(图1A)。结果发现,PtGSTU1单体具有典型的GST三维结构,具有N端和C端两个结构域,其中,N端及C端结构域形成的V字型区域表面主要为第一底物GSH的特异结合位点(G位点),C端活性口袋包含结合疏水底物的位点(H位点),G位点与H位点由一段短肽连接。
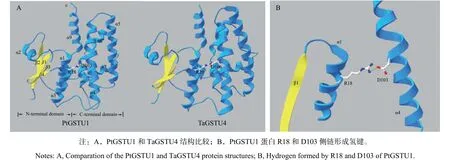
图 1 PtGSTU1蛋白结构Fig. 1 Structure of PtGSTU1
蛋白结构模型显示,N端结构域一个精氨酸(R)位点能够与C端结构域一个天冬氨酸(D)形成氢键(图1B)。将PtGSTU1与不同植物、不同类型GST蛋白进行序列比对(图2),发现PtGSTU1蛋白N端结构域的βαβαββα结构在Tau类GST中非常保守,而C末端的结构可变性较大。第18位的精氨酸在所有GST中均保守,而第103位的天冬氨酸仅在Tau类GST中保守。

图 2 植物GST蛋白序列比对Fig. 2 Alignment of plant GST proteins
2.2 PtGSTU1及其突变体蛋白的表达
为了探讨PtGSTU1蛋白R18和D103位之间氢键对蛋白结构稳定性的影响,笔者对这2个位点分别单独进行了定点突变。将18位精氨酸分别突变为异亮氨酸(I)、丙氨酸(A)、色氨酸(W)、赖氨酸(K)、谷氨酸(E)和组氨酸(H),构建了R18I、R18A、R18W、R18K、R18E和R18H六个突变体蛋白,并将103位天冬氨酸突变为丙氨酸(A)构建D103A突变体。这些用于替换的氨基酸残基侧链具有不同的极性和空间位阻。
对野生型PtGSTU1和所有突变体进行蛋白的表达检测(图3),分别在37、25、20℃进行蛋白的诱导表达,对收集的菌体进行破碎,破碎后分离细胞沉淀物和上清,进行SDS-PAGE检测。检测结果显示:野生型和突变体蛋白分子量在32 kDa左右,与预期一致。在37℃下,6个R18突变体均为包涵体,而野生型和D103A在上清中表达。在25℃和20℃下,R18A在上清检测到微弱的表达,其他5个R18突变体均为包涵体,野生型和D103A在上清中表达。
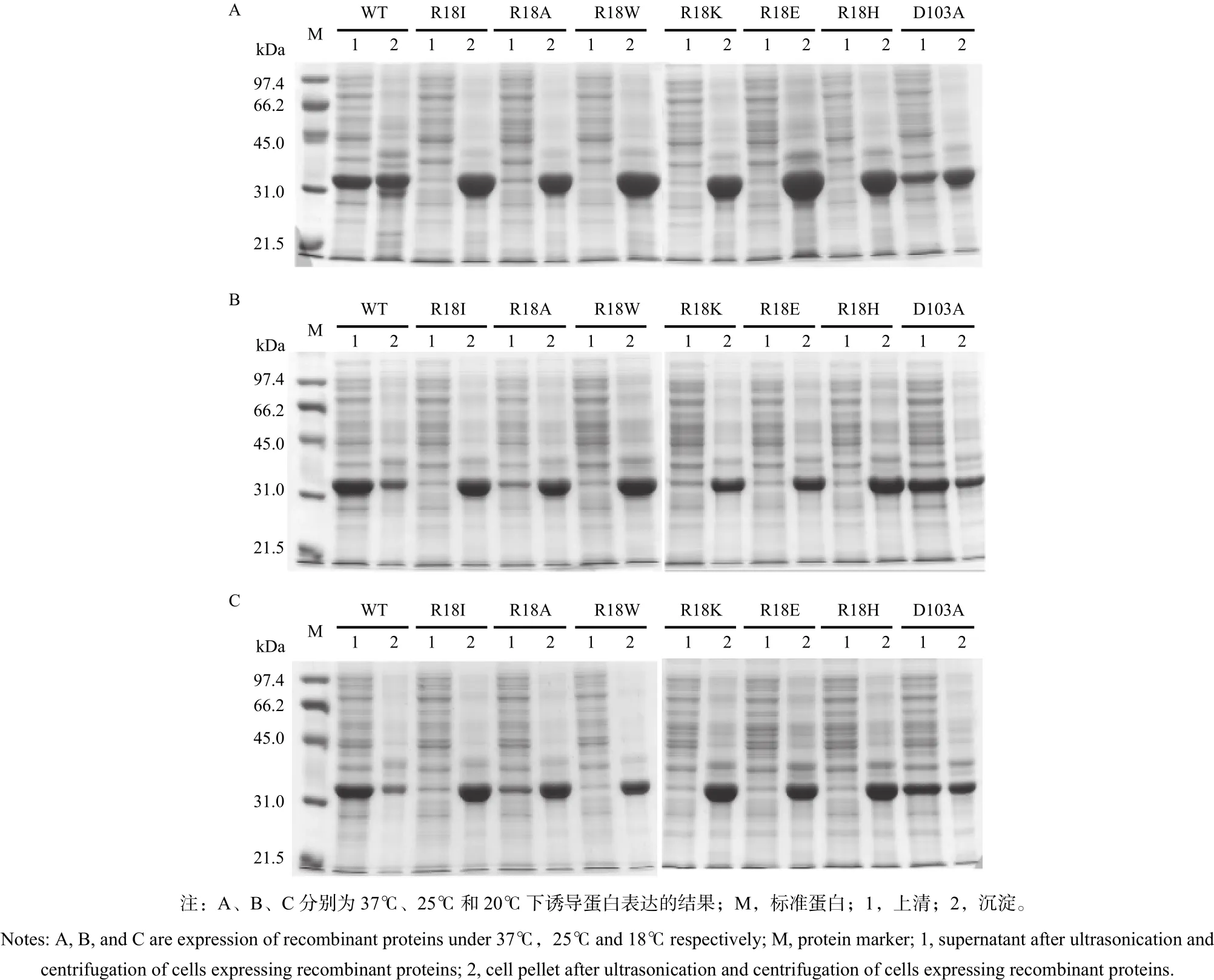
图 3 PtGSTU1及其突变体蛋白表达Fig. 3 Expression of the wild type and mutants of PtGSTU1
在细胞沉淀中的蛋白多为由膜包裹的高密度、不溶性蛋白质颗粒,因此,6个R18突变体无法获得高纯度的具有正确折叠的可溶蛋白。为了检测D103突变体的酶学功能变化,笔者分别对野生型和D103A突变体蛋白进行纯化,利用Ni离子亲和柱纯化上清中表达的蛋白,以野生型蛋白为参照,纯化后,重组蛋白均显示单一条带,在SDSPAGE上具有相同的迁移率(图4)。
2.3 PtGSTU1及其突变体酶学功能测定
PtGSTU1蛋白R18位6个突变体的表达检测显示:仅R18A有微量蛋白能够在上清中表达,但由于表达量过低,纯化后无法获得高浓度可溶蛋白进行酶学功能的检测。为了检测突变体是否还具有GST催化活性,笔者以含有pET30a载体的Bl21诱导表达后的上清液为阴性对照,测定R18A重组蛋白表达上清对CDNB的催化活性,结果显示:R18A具有微弱的催化活性(OD340= 0.02)。
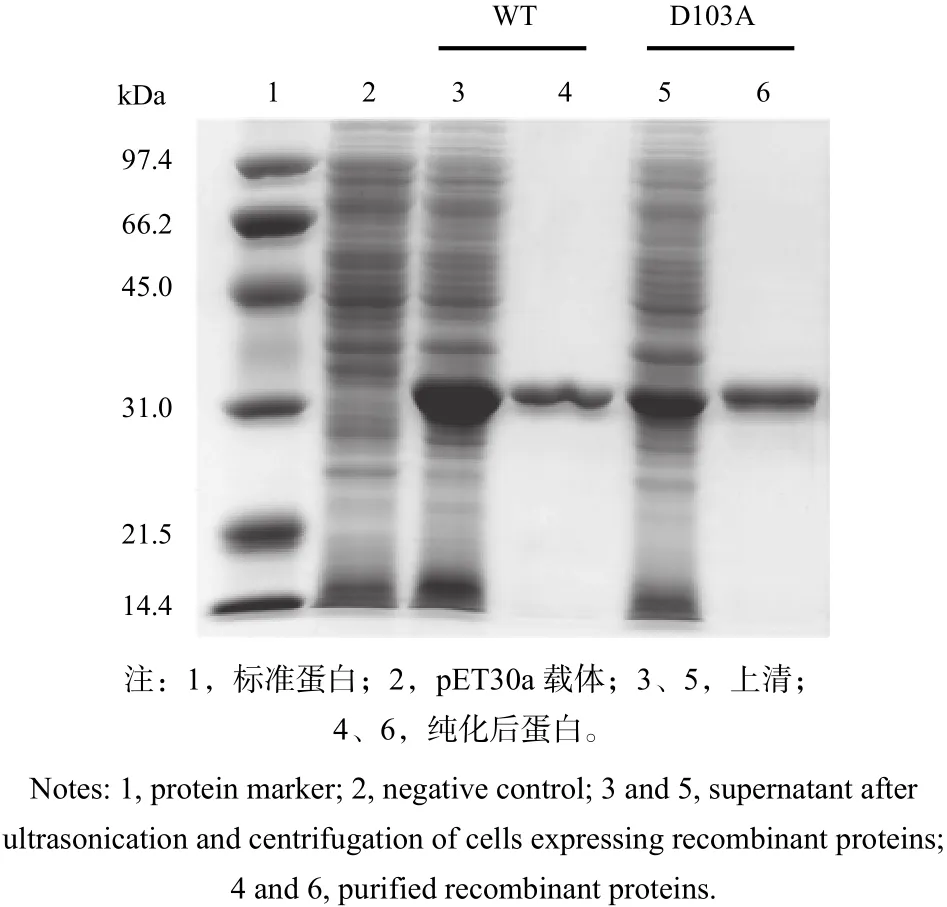
图 4 PtGSTU1及D103A突变体蛋白纯化Fig. 4 Expression of the wild type and mutant D103A of PtGSTU1
对纯化后的D103A重组蛋白进行酶学活性检测发现:103位天冬氨酸突变为丙氨酸后,其对4种底物的活性明显降低,对CDNB的催化活性仅为(1.70 ± 0.26) μmol·min-1·mg-1,与野生型相比降低了12.2倍;对NBD-Cl的催化活性为(0.45 ±0.08) μmol·min-1·mg-1, 与 野 生 型 相 比 降 低 了10.7倍,ECA降低1.1倍,对4-NPA几乎检测不到催化活性(表2)。
CDNB是GST经典底物,广泛用于GST活性的检测,且PtGSTU1-D103A对CDNB的催化活性最高。我们使用CDNB和GSH作为底物测定PtGSTU1-D103A的动力学常数。发现PtGSTU1-D103A对两个底物的米氏常数(Km)均有明显增加,分别为 1.06 ± 0.25 mmol·L-1和 0.87± 0.17 mmol·L-1。这意味着与野生型相比,PtGSTU1-D103A对底物的亲和力明显降低。底物饱和时,PtGSTU1-D103A催化GSH和CDNB的反应速率(Vmax)降低了至少9倍。相应的,对底物的催化效率(kcat/Km)也明显降低(表3)。
2.4 PtGSTU1及其突变体热力学稳定性分析
为了进一步验证R18和D103这2个氨基酸位点间氢键对Tau类GST蛋白单体结构的影响,笔者分别对野生型和PtGSTU1-D103A蛋白的热力学稳定性进行检测。野生型蛋白在25~50℃之间保留了90%以上的催化活性,这表明其在50℃以下是稳定的;而PtGSTU1-D103A突变体蛋白随温度升高,催化活性快速降低,在30℃时仅剩约40%的催化活性,预示着其蛋白热稳定性较低(图5)。
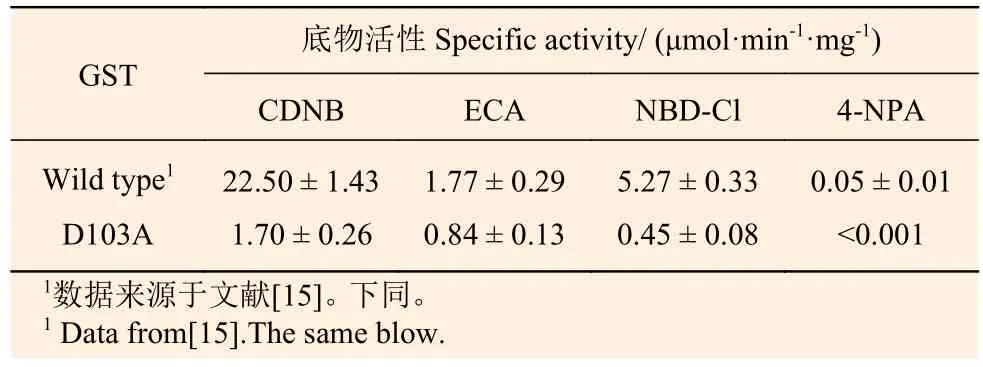
表 2 PtGSTU1野生型和D103A突变体蛋白底物活性Table 2 Specific activities of the wild type and D103A mutant of PtGSTU1 towards different substrates. The values shown are means ± S.D., calculated from three replicates
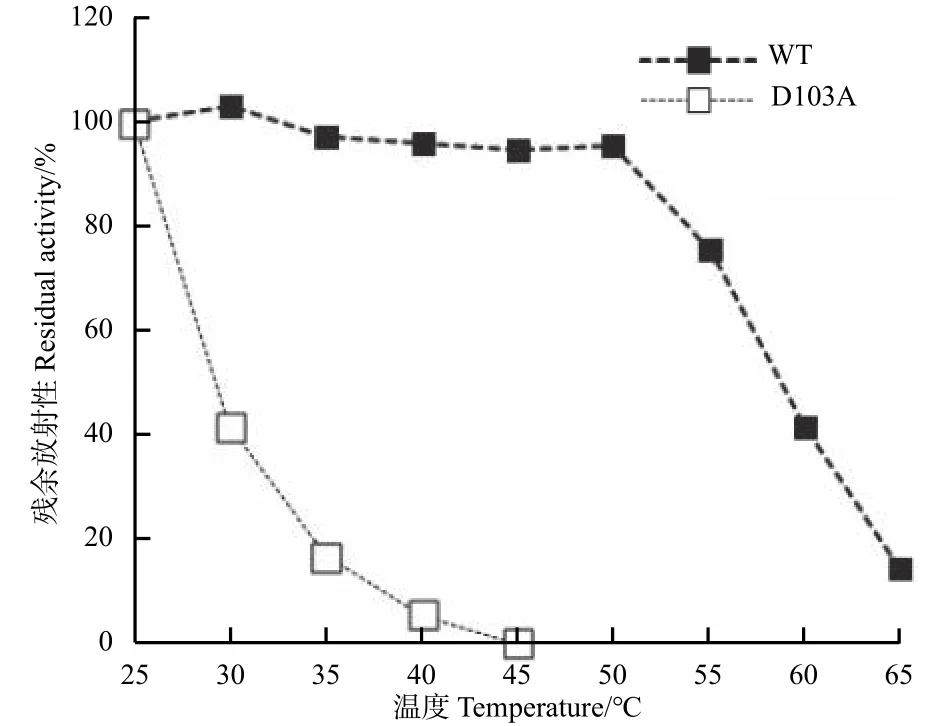
图 5 PtGSTU1及D103A突变体蛋白的热力学稳定性Fig. 5 Thermal stability of the recombinant wild type and mutant D103A of PtGSTU1
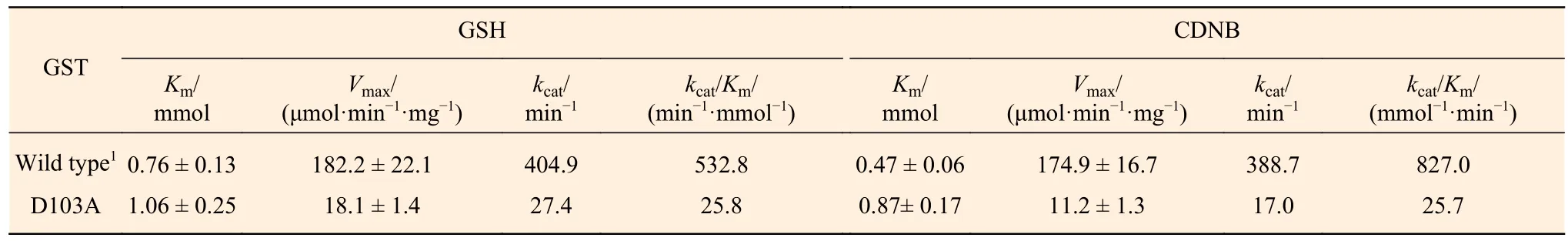
表 3 PtGSTU1野生型和D103A突变体蛋白动力学。Table 3 Steady-state kinetic constants of the wild type and D103A mutant of PtGSTU1. Data are means ± S.D, calculated from three replicates.
3 讨论
基于与节节麦TaGSTU4蛋白晶体结构的比较,笔者推测PtGSTU1的18位精氨酸和103位天冬氨酸能够形成氢键,这个氢键稳定了蛋白N端和C端的空间结构,使蛋白能够形成正常的折叠。PtGSTU1的催化口袋位于N端和C端的空间结构之间[16],第18位精氨酸位于α1螺旋上,这一位点在植物不同类型GST序列中均保守。PtGSTU1蛋白G-site活性位点13位的丝氨酸对GST蛋白活性至关重要[15-16],位于α1螺旋末端,α1螺旋空间结构的改变将直接影响G位点与第一底物GSH的结合。
精氨酸为碱性氨基酸,其带正电,具有-(CH2)3-NH-CNH-NH2的长侧链,能在空间上最大限度接近位于C端α4螺旋上的103位天冬氨酸,与天冬氨酸侧链上的-COOH形成N-H…O型氢键。将18位的精氨酸突变为赖氨酸时(R18K),虽然其侧链具有4个碳原子长链,能够接近C端结构域,但由于极性降低(R,pKa=12.0;K,pKa=10.5),影响了氢键形成。R18H突变体的18位精氨酸侧链被组氨酸咪唑基取代,不仅极性降低(H,pKa=6.08),且侧链长度变短。此外,当突变为异亮氨酸(I)和丙氨酸(A)时,侧链上的氨基被甲基取代,同时影响了该位点的电负性和空间结构。突变为谷氨酸(E)时,侧链为-CH2-CH2-COOH,该位点由碱性氨基酸变为带负电的酸性氨基酸,破坏氢键形成。当突变为色氨酸(W)时,β-吲哚基增加了-N-H与103位天冬氨酸形成氢键的位阻。对突变体蛋白的表达分析显示,无论将18位精氨酸突变为碱性还是酸性氨基酸,均会影响蛋白的正确折叠,因此,所有R18突变体蛋白均表达为包涵体,尽管R18A在上清中检测到微弱表达,其活性也远低于野生型。这预示着在植物GST中,18位精氨酸可能是稳定单体结构的关键氨基酸之一。
与在植物中极为保守的18位精氨酸相比,103位天冬氨酸仅在Tau类GST中保守。将天冬氨酸-CH2-COOH侧链替换为-CH3时,虽然失去了强极性的氧原子,但依然能够形成正确的蛋白折叠;但其底物活性相较于野生型明显降低,对底物的亲和力降低了将近1倍,催化效率降低近10倍,预示着这一位点的突变可能影响了活性位点的空间结构。同时,热力学稳定性检测也验证了,D103A突变体的稳定性明显低于野生型。说明,尽管103位天冬氨酸能够参与形成氢键,但它的突变并不会使蛋白完全失活,而是明显降低其的催化能力和稳定性。这不仅印证了GST蛋白C端结构域的多变性,同时预示着C端结构域中可能存在其他氨基酸位点能够与18位精氨酸形成氢键,从而稳定蛋白单体折叠结构。
4 结论
本研究通过对油松PtGSTU1野生型和突变体的酶学功能检测发现, N 末端 18 位精氨酸(Arg18)和 C 末端 103 位天冬氨酸(Asp103)形成的氢键对稳定蛋白单体结构具有重要作用。由于植物中GST蛋白N端结构域具有保守性,C端结构域具有多变性,Arg18的突变对单体稳定性的影响大于Asp103 ,表明C端结构域中可能存在其他氨基酸位点能够与18位精氨酸形成氢键,从而稳定蛋白空间结构。
