神经性贝类毒素免疫亲和柱的制备与应用
2020-04-13白景妙吴海燕
董 昕 白景妙 吴海燕
(1. 品测〔上海〕检测科技有限公司,上海 201108;2. 山东美正生物科技有限公司,山东 青岛 266000;3. 中国水产科学研究院黄海水产研究所,山东 青岛 266000)
贝类毒素亦称赤潮生物毒素,是由有害赤潮生物产生的天然活性物质。赤潮是在特定的环境下,海水中原生生物、浮游生物或细菌爆发性增殖造成水体变色的生态现象。在5 000多种海洋微藻中,可以形成赤潮的微藻至少有180种,其中有毒的藻类占据近1/2,已被证实含有毒素或者能够分泌毒素的有30~40种[1]。因研究人员最早从贝类体内发现赤潮毒素,故称此类毒素为贝类毒素。赤潮毒素随着滤食性鱼、虾、贝类的滤食活动被富集在体内,造成海产品毒化。毒化的海产品通过食物链的传递最终导致人体中毒。
神经性贝类毒素(Neurotoxic Shellfish Poisoning,NSP)是由短裸甲藻、剧毒冈比甲藻等藻类在细胞裂解、死亡时会释放出一组效力较大的神经毒素。高浓度的神经毒素很容易造成鱼类的大批量死亡,相反牡蛎、蛤类和贻贝对该毒素不敏感,外表上完全呈现出健康状态[2]。神经性贝类毒素是一类脂溶性环状聚醚类毒素,可造成误食者神经系统和胃肠道不适,引发恶心、呕吐、腹泻、痉挛、支气管收缩、麻痹、抽搐和昏迷等症状。其中短裸甲藻毒素(Brevetoxin,BTX)是主要的一类毒素成分,主要由裸甲藻、海洋卡盾藻和赤潮异弯藻产生,其基本结构分为A型(BTX-A,即PbTx-A)和B型(BTX-B,即PbTx-B),包含数十种衍生物,以BTX-2(即PbTX-2)最为常见[3-4]。
目前美国、澳大利亚和新西兰等国家规定小鼠生物法安全标准为20 MUs/100 g,相当于800 μg PbTX-2/kg贝肉组织[5],而中国尚无针对此类毒素的限量标准,一般针对此类毒素的限量值是参考欧美限量。
国际上普遍采用小鼠生物法、免疫分析法、细胞毒性检测法及理化分析方法等手段来检测贝类并作出预警预报[6-10]。小鼠生物法是检测贝类毒素发展最早、应用最广泛的分析方法,但存在灵敏度差、步骤繁琐、无法确定毒素组分、重复性差(不同批次、不同品系小鼠)、易导致假阳性结果等问题。酶联免疫法虽检测时间短、成本低,但易受交叉反应的影响而出现假阳性或者假阴性的问题。液相色谱法需要复杂的前处理,且缺乏准确的定性能力。液相色谱—质谱联用技术结合了液相色谱优越的分离能力与质谱高灵敏度的定性定量功能,应用越来越广泛。但市场上存在的一些固相萃取柱产品,回收率低、样品基质干扰仍较严重,大大降低了方法的应用率[11-13]。免疫亲和柱(immunoaffinity column,IAC)是一种基于抗原抗体反应的新型层析柱,可选择性吸附样品提取液中的目标化合物,在特异性富集毒素的同时净化样品基质,净化效果好。作为新型高效的前处理净化技术,免疫亲和柱净化技术正在不断改进发展,在生物毒素检测领域应用越来越广泛[14-16]。
试验拟以PbTX-2为研究对象,研制NSP免疫亲和柱的装柱,并建立NSP的免疫亲和柱净化—液相色谱—串联质谱分析方法,以期经免疫亲和柱净化的样品提取液可直接用于LC-MS/MS分析,达到快速检测和提高检测方法灵敏度、准确性的目的。
1 材料与方法
1.1 材料与试剂
贻贝、蛤蜊、牡蛎、扇贝样品:市售;
PbTX-2标准品:纯度99.5%,美国LKT LABS公司;
甲酸、甲酸铵:色谱纯,美国Sigma公司;
甲醇、乙腈:色谱纯,德国Merck公司;
十二水合磷酸氢二钠、氯化钠、盐酸、碳酸氢钠、二水合磷酸二氢钠:分析纯,国药集团化学试剂有限公司;
BCA蛋白质定量检测试剂盒:赛默飞世尔科技(中国)有限公司;
琼脂糖凝胶:上海通用电器有限公司;
0.22 μm有机微孔滤膜:上海安普科学仪器有限公司;
试验用水为超纯水。
1.2 仪器与设备
液相色谱—四极杆/离子阱复合质谱:AB 5500 QTrap型,美国SCIEX公司;
纯水仪:MILLI-Q型,美国Millipore公司;
分析天平:ME204型,瑞士梅特勒—托利多公司;
旋窝振荡器:Talboys型,美国Talboys公司;
高速离心机:Himac CR 22G II型,日立Hitachi公司;
气控操作架:HM09004-1型,北京美正生物科技有限公司。
1.3 NSP免疫亲和柱的制备
1.3.1 PbTX-2单克隆抗体制备 采用动物体内诱生单克隆抗体法合成PbTX-2全抗原对小鼠进行免疫,取小鼠脾细胞和骨髓瘤细胞Sp2/0进行融合,筛选出特异性强、灵敏度高、能分泌抗PbTX-2的单克隆抗体细胞株,通过液体石蜡注射到小鼠腹腔内致命,然后将分泌抗PbTX-2的细胞接种到小鼠体内,制备抗PbTX-2的单克隆抗体腹水。使用Protein G柱进行抗体纯化[17]。
1.3.2 PbTX-2抗体蛋白浓度测定 将PbTX-2抗体溶液用BCA蛋白质定量检测试剂盒进行蛋白浓度测定。测得该PbTX-2抗体溶液蛋白浓度为2 mg/mL。
1.3.3 NSP免疫亲和柱的制备 将纯化后的PbTX-2抗体加入处理好的Sepharose CL 4B凝胶中[18],具体步骤:
(1) 凝胶制备:将2 g溴化氢活化的Sepharose CL 4B 干粉加入到25 mL 1 mmol/L的HCl溶液中溶胀,将胶转入砂芯漏斗中,然后用200 mL 1 mmol/L的HCl清洗,再用200 mL反应缓冲液(0.1 mol/L碳酸氢钠)清洗充分。
(2) 偶联:清洗完后抽干,将胶加入10 mL含有0.5 mg/mL PbTX-2的抗体偶联缓冲液溶液中,室温温和搅拌2 h或过夜反应,反应完成后静置,收集上清,BCA法测定上清液中未偶联蛋白含量,按式(1)计算偶联率,经测定制备的NSP抗体与凝胶的偶联率为100%。
(1)
式中:
p——偶联率,%;
m1——偶联前抗体总量,mg;
m2——未偶联抗体总量,mg。
(3) 洗涤:用反应缓冲液洗涤反应后的胶,将胶加入15 mL Tris-HCl (0.1 mol/L,pH 8.0)缓冲液中,室温下温和搅拌2 h。用600 mL 0.1 mol/L醋酸缓冲液(pH 4.5)和Tris-HCl先后交替进行洗涤4~6次。
(4) 装柱:洗涤后的凝胶用250 mL PBS充分平衡后装柱,取3 mL空柱管压好底部筛板,然后将胶平均装到10支3 mL柱管中,堵好上下堵头,做好标识,储存于2~8 ℃。每根柱凝胶体积为0.5 mL,相当于每根柱含有0.3 mg NSP抗体。
1.3.4 NSP免疫亲和柱的柱容量验证 为了评价自制NSP免疫亲和柱的效果,通过不同上样量的回收试验,测试自制柱的柱容量。分别移取1 mL浓度为200,400,1 000,1 600 ng/mL的PbTX-2标准溶液与20 mL PBS溶液混合均匀,全部添加到制备的免疫亲和柱上,以1 mL/min的流速流出,然后用6 mL 20%甲醇水溶液淋洗免疫亲和柱,流速2~3滴/s,流干柱内残留液,并弃去以上全部流出液。最后用3 mL甲醇洗脱,流速1滴/s,收集洗脱液,室温中氮吹至小于1 mL,用甲醇补至1 mL。混匀后用0.22 μm有机微孔滤膜过滤后进行检测。计算柱容量,具体数据见表1。
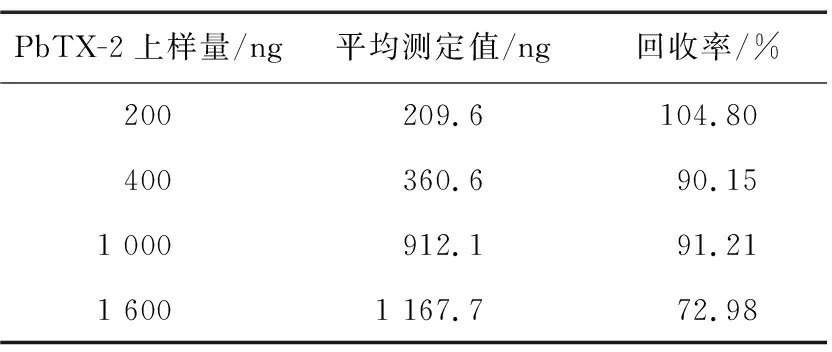
表1 PbTX-2上样量与回收率
由表1可知,自制免疫亲和柱的上样量在1 000 ng以下回收率均达到90%以上,而上样量在1 000 ng以上时,回收率下降。因此自制免疫亲和柱的最大柱容量为1 000 ng。
1.4 NSP免疫亲和柱的应用
1.4.1 NSP标准溶液的配制 称取一定量的PbTX-2粉末,用纯甲醇稀释至1 mg/mL,-18 ℃避光保存,有效期1年。根据PbTX-2在LC-MS/MS上响应值和线性相关性,将母液稀释浓度为5,10,20,50,100,200,500 ng/mL的标准工作溶液。
1.4.2 样品前处理 准确称取已充分均质样品2.00 g于50 mL具塞试管中,加入8 mL 80%甲醇水溶液,涡旋震荡2 min,超声提取10 min,8 000 r/min离心5 min,将上清液转移至20 mL刻度玻璃管中。然后加入8 mL 80%甲醇水溶液重复提取一次,合并两次提取液,用80%甲醇水溶液定容至20 mL。移取5 mL提取液,加入20 mL PBS溶液稀释(稀释2倍),全部过免疫亲和柱净化。
取出免疫亲和柱去掉上方塞子,安装上转接头,将转接头另一端与针筒连接固定后使用。将柱子直接与气控操作架上的针筒连接固定,处理后的溶液上样,上样结束后用6 mL 20%甲醇水溶液淋洗免疫亲和柱,流速2~3滴/s,流干柱内残留液,并弃去以上全部流出液。最后用3 mL甲醇洗脱,流速1滴/s,洗脱液定容至4 mL,混匀后用0.22 μm有机微孔滤膜过滤后进行检测。
1.4.3 NSP仪器检测条件
(1) 色谱条件:色谱柱为Kinetex,XB-C18柱(100 mm×2.1 mm,2.6 μm);进样体积5 μL;柱温40 ℃;流速0.3 mL/min;流动相A为去离子水(含50 mmol/L甲酸和2 mmol/L甲酸铵);流动相B为95%乙腈水溶液(含50 mmol/L甲酸和2 mmol/L甲酸铵);洗脱条件0.0 min(80% A)→5.0 min(10% A)→10.0 min(10% A)→10.1 min(80% A)→12.0 min(80% A)。
(2) 质谱条件:检测类型为电喷雾离子源,正离子扫描模式(Electrospray ionization,ESI+);检测方式为多反应监测模式(Multiple Reaction Monitor,MRM);毛细管电压5 500 V;离子源温度550 ℃;气帘气压力206 kPa;雾化气压力345 kPa;辅助加热气压力345 kPa;碰撞气CAD中等流量;定量离子对895.4>877.4,碰撞能量26 eV;定性离子对895.4>859.6,碰撞能量30 eV。
2 结果与分析
2.1 免疫亲和柱的制备
2.1.1 凝胶溶胀溶液体积的选择 将2 g溴化氢活化的Sepharose CL 4B干粉分别加入15,20,25,30 mL 1 mmol/L的HCl溶液中溶胀。试验结果显示溶胀液体积在25 mL以下干粉溶胀不完全,因此选择25 mL溶胀液对Sepharose CL 4B干粉进行溶胀。
2.1.2 偶联反应方式 选用室温温和搅拌0.5,1.0,2.0,3.0,4.0 h使其充分偶联,经测定室温搅拌2~4 h的偶联率均为100%,而搅拌1 h以下的偶联率低于80%,所以选择室温偶联时间为2 h。
2.2 免疫亲和柱的应用优化
2.2.1 稀释缓冲液的确定 抗体对有机溶剂的敏感性是免疫亲和柱净化和富集过程中的一个重要因素,影响免疫反应的活性。抗体对甲醇溶液有一定程度的耐受能力,若上样液中甲醇浓度过高会破坏抗原抗体的结合。因此选择适合的缓冲液稀释是获得高回收率的关键。PBS磷酸盐缓冲溶液具有盐平衡、可调整的适宜pH缓冲作用,所以选择PBS样品稀释缓冲液。
以添加量为200 ng的扇贝样品提取液为基准,用PBS进行不同倍数稀释,通过比较不同稀释倍数下样品回收率,确定最佳稀释比例。具体数据见图1。

图1 PBS不同稀释比例对回收率的影响
由图1可得,NSP免疫亲和柱对甲醇的耐受能力在20%左右,随着上样液中甲醇浓度的增加,破坏了抗原抗体的特异性结合,使部分毒素结合不牢固而流失,造成样品回收率降低。当样品液∶PBS体积比为1∶4时样品回收率达到90%以上。因此选择稀释比例为1∶4。
2.2.2 淋洗液的确定 考虑到PbTx-2的溶解性,为验证淋洗过程中淋洗液(20%甲醇水溶液)是否会造成损失,收集全部6 mL(2 倍柱体积)淋洗液进行LC-MS/MS测试,结果发现淋洗过程中无损失,当淋洗液中甲醇浓度<20%时,不能使PbTx-2溶解,而当淋洗液中甲醇浓度>20%时,破坏了抗原抗体的特异性结合,PbTx-2的回收率明显降低,故最终选择6 mL 20%甲醇水溶液淋洗免疫亲和柱。
2.2.3 洗脱液的确定 对PBS溶液进行加标(加标量200 ng),不添加样品基质以排除基质干扰,以水、50%甲醇水溶液、甲醇、2%氨水甲醇溶液作为洗脱液,做3组平行试验,同时采用不同洗脱体积进行洗脱收集,以回收率为指标筛选出最佳洗脱液和洗脱体积,结果见表2。
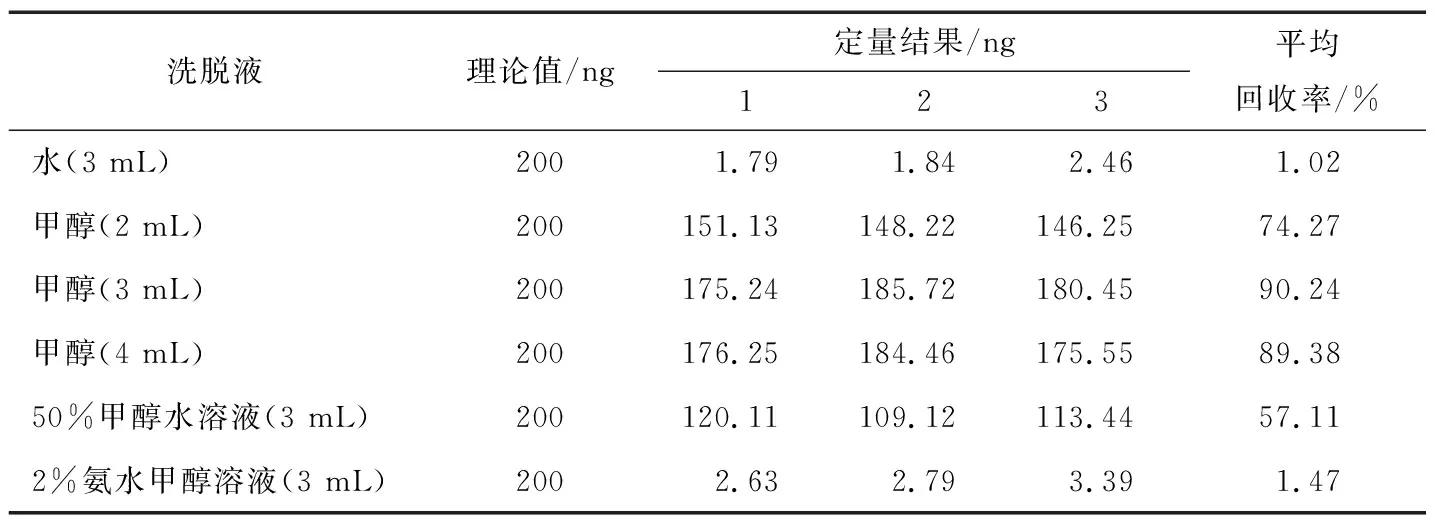
表2 洗脱液对回收率的影响
由表2可知,用水、50%甲醇水溶液、2%氨水甲醇溶液洗脱时,PbTX-2的回收率分别为1.02%,57.11%,1.47%,回收率均偏低;分别用2,3,4 mL甲醇洗脱,回收率分别为74.27%,90.24%,89.38%。试验表明:洗脱液体积≥3 mL时,PbTX-2能被洗脱出来。洗脱液体积过多时会造成试剂浪费,故最终选择3 mL甲醇作为洗脱溶剂。
2.2.4 样品提取试剂的确定 PbTx-2具热稳定性,易溶解于甲醇、乙醚等有机试剂,参考GB 5009.198—2016方法中对贝类样品的提取试剂,同时考虑到DSP免疫亲和柱的前处理过程[12],试验比较了20%甲醇水溶液、50%甲醇水溶液和80%甲醇水溶液的提取效率。提取加标量为200 ng的扇贝作为试验对象,每种提取试剂做3次平行试验,结果见表3。由表3可知,80%甲醇水溶液提取效率明显优于20%甲醇水溶液和50%甲醇水溶液。因此,选择80%甲醇水溶液作为提取试剂。

表3 提取试剂对回收率的影响
2.2.5 方法检出限、回收率及精密度结果 PbTx-2在液相色谱串联质谱仪上最佳响应浓度范围为5,10,20,50,100,200,500 ng/mL,曲线方程y=10 236.300 37x-127 631,相关系数0.997 92。在曲线最低点浓度处(5 ng/mL)仪器的信噪比S/N=3,根据取样量2 g、稀释倍数为4,最终定容体积4 mL,计算得方法检出限为40 μg/kg。图2为20 ng/mL 的PbTx-2标准溶液在液相色谱串联质谱仪最佳状态下得到的总离子流图。由图2可得, PbTX-2的总离子流图峰形与响应良好且噪声干扰小,能够满足检测所需。
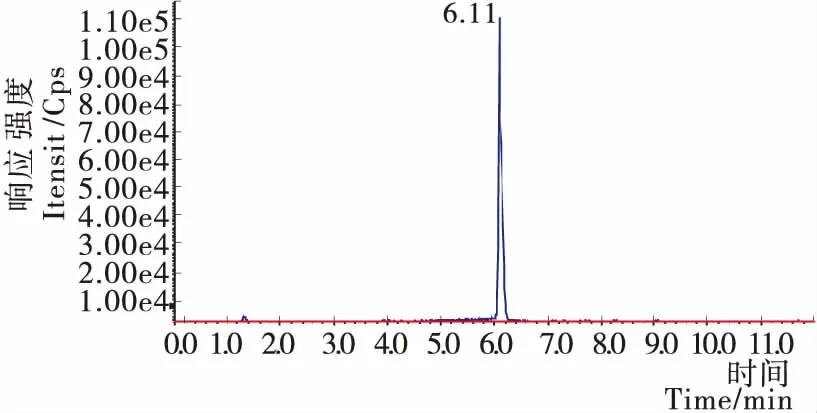
图2 标准溶液的总离子流图20 ng/mL PbTX-2
选择阴性的扇贝和蛤蜊样品为空白基质,分别在3个浓度(检出限、5倍检出限、参考限量限)添加,每个浓度做6个平行样品,按上述优化方法进行试验,计算得各添加水平对应的回收率和精密度,结果见表4。由表4可以看出,PbTx-2的平均回收率为82.95%~112.95%,相对标准偏差为1.27%~2.94%。方法的回收率与精密度可满足PBTx-2的实验室检测要求。
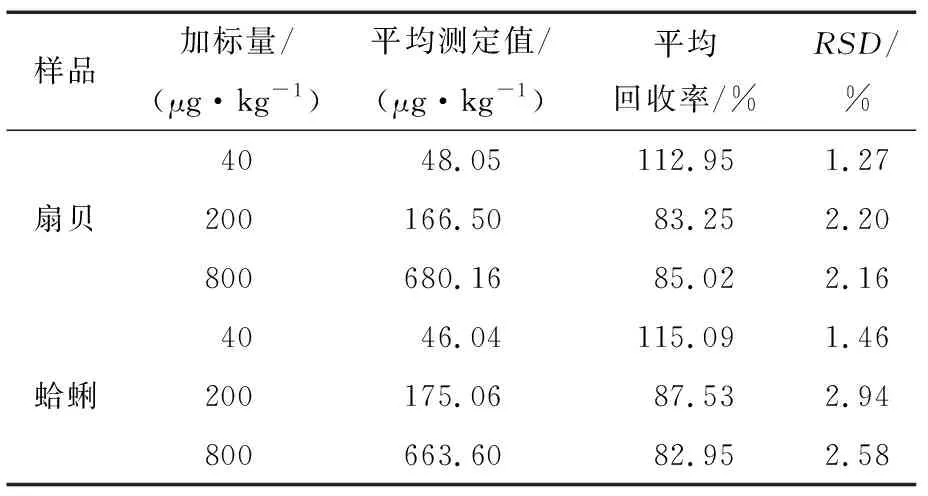
表4 回收率和精密度结果
2.2.6 方法的实际应用 应用试验法对各水产品市场采购蛤蜊、扇贝、贻贝、牡蛎4个品种40份样品进行检测,所检测样品中贝类毒素的含量均小于方法检出限。有研究[1]表明,神经性贝类毒素常见发生区域为美国沿岸、墨西哥湾沿岸和新西兰沿岸。赤潮虽在中国沿海有分布,但尚未有检测出该毒素样品的报道。
3 结论
试验建立了NSP免疫亲和柱的制备和NSP毒素的液相色谱串联质谱检测法,通过研究NSP检测方法中免疫亲和柱的制备、样品的提取和净化、色谱质谱条件,达到了检测方法的检出限低、稳定性好、抗干扰能力强、定性定量结果准确的效果;弥补了现行国标(GB 5009.261—2016)方法的检测周期长、操作过程相对复杂和无法定量等方面的不足。采用试验方法检测了4种中国常见水产品,与相关文献[1]检测结果基本相同。
