TOME环化反应热力学分析及反应动力学研究
2020-04-06刘宏晓孙伟振赵玲
刘宏晓,孙伟振,赵玲,2
(1 华东理工大学化学工程联合国家重点实验室,上海200237; 2 新疆大学化学化工学院,新疆乌鲁木齐830046)
引 言
吡罗克酮乙醇胺盐是一种新型的去屑止痒剂,同时具有良好的溶解性和热稳定性以及低毒性和低刺激性,市场应用前景广阔[1]。4-甲基-6-(2,4,4-三甲基戊基)-2-吡喃酮(MTP)是吡罗克酮乙醇胺盐合成过程的中间体,它的吡喃酮环结构可以与羟胺反应生成具有吡啶酮环结构的吡罗克酮,后者再与乙醇胺在溶剂中成盐析出得到吡罗克酮乙醇胺盐[2-3]。其中,MTP 的合成反应是制备吡罗克酮乙醇胺盐的关键反应步骤。MTP 的合成以3,7,9,9-四甲基-5-酮-2-癸烯酸甲酯(TOME)为原料,目前国内外对该反应的研究较少。Horace等[4-5]先将TOME水解得到相应的酸,再以浓硫酸为催化剂,在醋酸溶剂中诱导其环化得到MTP。Pittet等[6]采用高温加热反应物TOME 的方式使其发生环化反应,只需一步反应即可得到产物。
热力学分析是判断反应系统进行的可能性和进行程度的重要依据,并且可以为操作条件确定、反应装置设计和催化剂选择提供重要的借鉴和指导作用[7-10]。并且,反应动力学对反应过程的优化、放大以及工业反应器的设计都具有重要意义[11-15]。然而,目前缺少关于该反应体系热力学分析的公开报道,有关反应物TOME 和产物MTP 的热力学数据也相当匮乏。同时,也鲜有关于该过程的反应动力学方面的研究报道。
本文利用基于物质分子结构的基团贡献法,对TOME 环化反应体系进行了热力学数据估算,计算了温度对焓变、熵变、Gibbs 自由能和反应平衡常数的影响。在此基础上采用间歇实验装置,研究了反应温度463~493 K 范围内TOME 进行直接环化反应的反应动力学规律。本文相关研究结果可以为TOME环化制备MTP反应的优化和工业应用提供参考依据。
1 反应体系热力学计算
TOME环化反应方程式如式(1)所示。
该反应体系中,副产物甲醇(methanol)的基础热力学数据可以直接从物性手册[16-19]中获得。而反应物TOME和目标产物MTP的热力学数据未见公开报道。本文采用基团贡献法进行热力学数据的估算。
1.1 理想气体标准摩尔生成焓、标准摩尔熵和摩尔等压热容
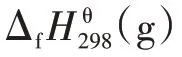
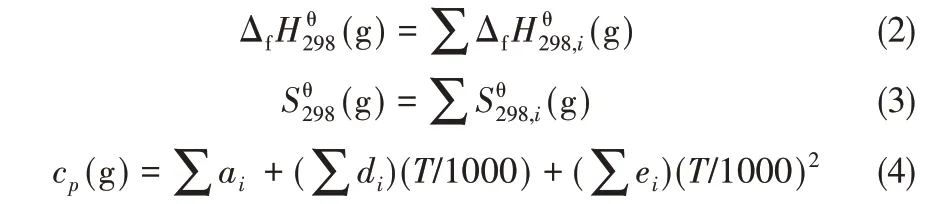
采用Yoneda 基团贡献法得到的各组分热力学基团贡献值如表1 所示。表1 中的A 代表被取代的碳原子型号,B 代表与A 相连的最高型号碳原子。表1中的数字所代表的碳原子类型如表2所示。
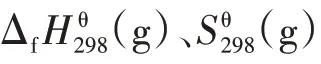
1.2 不同温度下汽化潜热的计算
由于本反应体系为液相反应,所以通过Yoneda基团贡献法得到各组分气体标准摩尔生成焓、标准摩尔熵和值压摩尔热容之后,还需要知道不同温度下各组分的汽化潜热ΔvHT,才能计算各组分的液态标准摩尔生成焓和标准摩尔熵。不同温度下的汽化潜热选择Watson 经验公式[26]计算。计算式如式(5)所示。
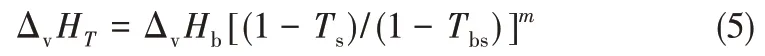
式中,ΔvHb为常压沸点下的蒸发焓;Ts为对比温度,Ts=T/Tc;Tbs=Tb/Tc;m取0.38[27]。ΔvHb采用Ma 等[28]提出的基团贡献法计算,临界温度Tc采用Joback 基团贡献法[29]计算,常压沸点Tb采用Stein 等[30]改进的Joback基团贡献法计算。计算式如式(6)~式(8)所示。各基团的贡献值见表4,各组分的ΔvHb、Tb、Tc和ΔvHT的计算结果见表5。
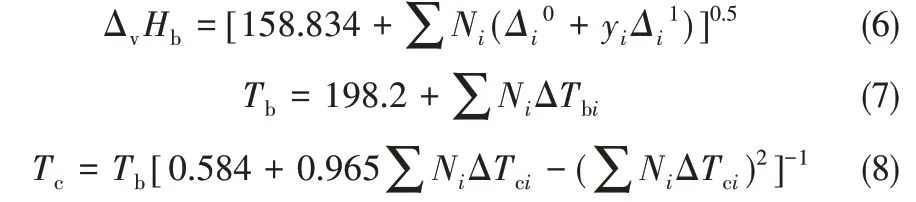
将上述通过基团贡献法计算得到的甲醇的各项热力学数据与文献值进行对比,对比结果见表6。可以看出,采用基团贡献法得到的计算值与文献值的最小相对偏差为0.03%,最大相对偏差为3.78%,说明采用上述方法得到的基础热力学数据是可靠的,可以用于下文的热力学计算及分析。

表1 各组分的热力学基团贡献值(Yoneda法)[24-25]Table 1 Thermodynamic data of group contribution of each component(Yoneda method)[24-25]
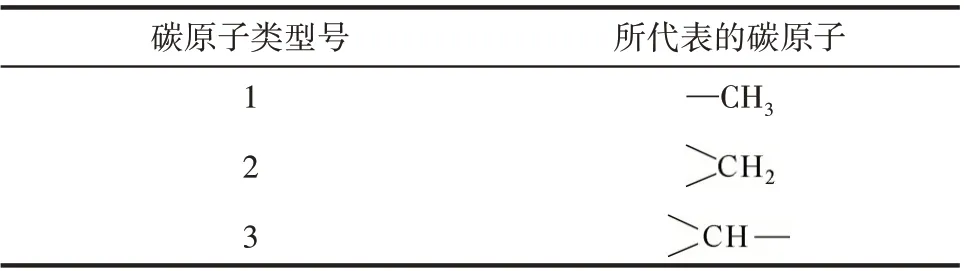
表2 不同碳原子的类型号(Yoneda法)Table 2 Type number of different carbon atoms(Yoneda method)
1.3 液态标准摩尔生成焓和标准摩尔熵
在计算得到了气态标准摩尔生成焓和标准摩尔熵以及不同温度下汽化潜热后,通过热力学基本公式计算液态标准摩尔生成焓和标准摩尔熵,所用公式如式(9)和式(10)所示。

式中,cp采用表3中关于温度T的多项式。
1.4 不同温度下的标准反应焓变、反应熵变、Gibbs自由能变和平衡常数
通过以上计算得到了各物质的ΔfHθT和SθT,再利用热力学基本公式便可以求得该反应在不同温度下的标准反应焓变、反应熵变、反应Gibbs 自由能变和反应平衡常数。所用热力学基本公式如式(11)~式(14)所示。
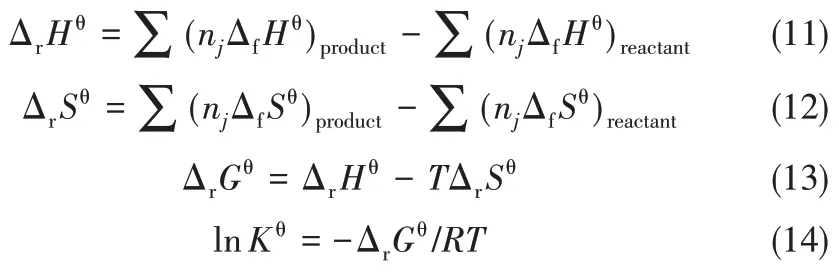
2 实验部分
2.1 实验试剂
3,7,9,9-四甲基-5-酮-2-癸烯酸甲酯(TOME),分析纯,百灵威科技有限公司;4-甲基-6-(2,4,4-三甲基戊基)-2-吡喃酮(MTP),分析纯,百灵威科技有限公司;HPLC 分析用试剂:乙腈,色谱纯,阿拉丁试剂有限公司;超纯水,自制。
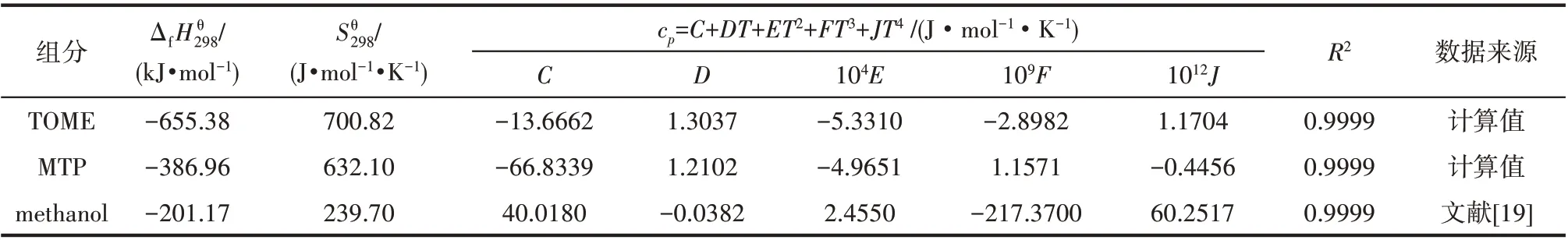
表3 各组分的热力学数据Table 3 Thermodynamic data for each component
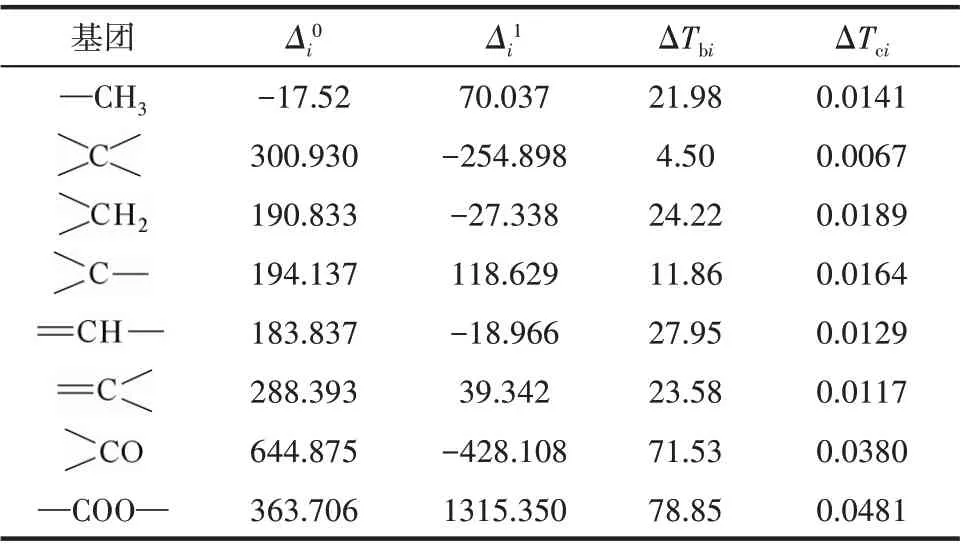
表4 Δi0、Δi1、ΔTbi和ΔTci的基团贡献值Table 4 Group contributions of Δi0,Δi1,ΔTbi and ΔTci
2.2 实验仪器与实验过程
实验所用仪器如图1 所示。首先,向三口烧瓶内加入一定量的反应物TOME,开启机械搅拌,开启油浴加热,冷凝器通冷却水。实验过程中产生的副产物甲醇经过冷凝后采出,加速反应正向进行。当烧瓶内反应体系达到反应温度后开始计时,并每隔一定时间用一次性吸管取2~3 ml 样品进行液相色谱分析。
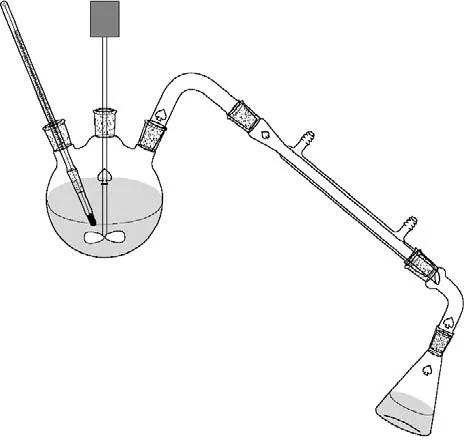
图1 环化反应装置Fig.1 Experimental setup of cyclization reaction
2.3 分析方法
TOME 环化反应实验的分析采用液相色谱,外标法定量。所用仪器为Waters 公司的HPLC 系统,由自动进样器(Waters 2707)、两元梯度泵(Waters 1525)、紫外检测器(Waters 2487)以及恒温箱组成。采用的色谱条件为:色谱柱为C18反相柱(φ4.6 mm×250 mm),流动相乙腈∶水体积比为70∶30,流速为1 ml·min-1,柱温为35℃,进样量为10 μl,检测波长为305 nm。
3 结果分析与讨论
3.1 温度对热力学参数的影响
通过对反应体系热力学数据的计算,可以得到不同温度下环化反应的标准反应焓变、熵变、Gibbs自由能变和平衡常数,结果汇总如表7 所示。可以看出,在所计算温度343~503 K 范围内,反应的标准焓变均大于零,说明该反应为吸热反应,从热力学角度可知,升高温度有利于反应向正方向进行。随着反应温度的升高,标准反应焓变呈减小趋势,说明随着反应温度的升高,反应的吸热量减小。在343~393 K 范围内大于零,说明在此温度范围内反应为非自发过程;在高于403 K 范围内反应的标准Gibbs 自由能变小于零,说明温度高于403 K,反应为自发过程。随着反应温度的升高,反应Gibbs 自由能呈减小趋势,说明升温有利于反应正向进行。反应的平衡常数随温度的升高呈增大趋势,说明反应的平衡转化率随温度的升高而增大。
为了进一步验证热力学分析的可靠性,将一定量的TOME 置于封闭反应体系中进行环化反应,反应时间设定12 h,之后迅速取样,并将样品置于冰水混合物中迅速冷却终止反应,分析样品中各物质的浓度,从而计算一定温度下该反应达到平衡时的实验平衡常数。实验平衡常数的计算公式如式(15)所示。
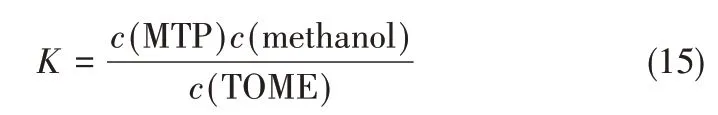
实验平衡常数与热力学计算得到的理论平衡常数见表8。可以看出,理论平衡常数与实验平衡常数比较接近,进一步证明上述采用的基团贡献法进行的热力学分析是可靠的。
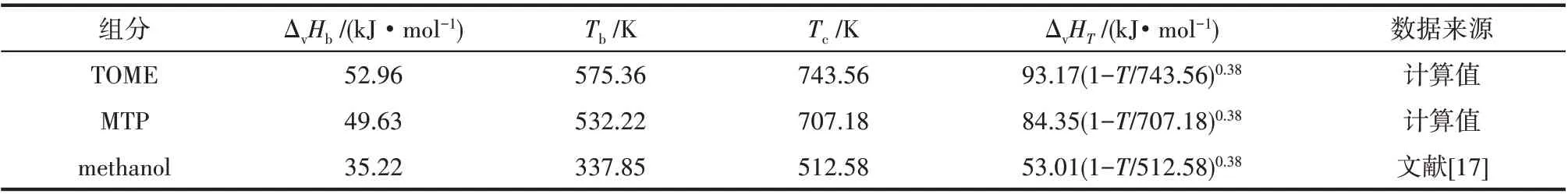
表5 各组分的ΔvHb、Tb、Tc和ΔvHT值Table 5 ΔvHb,Tb,Tc and ΔvHT of each component

表6 甲醇热力学数据的计算值与文献值对比Table 6 Comparison of calculation data and document data of methanol
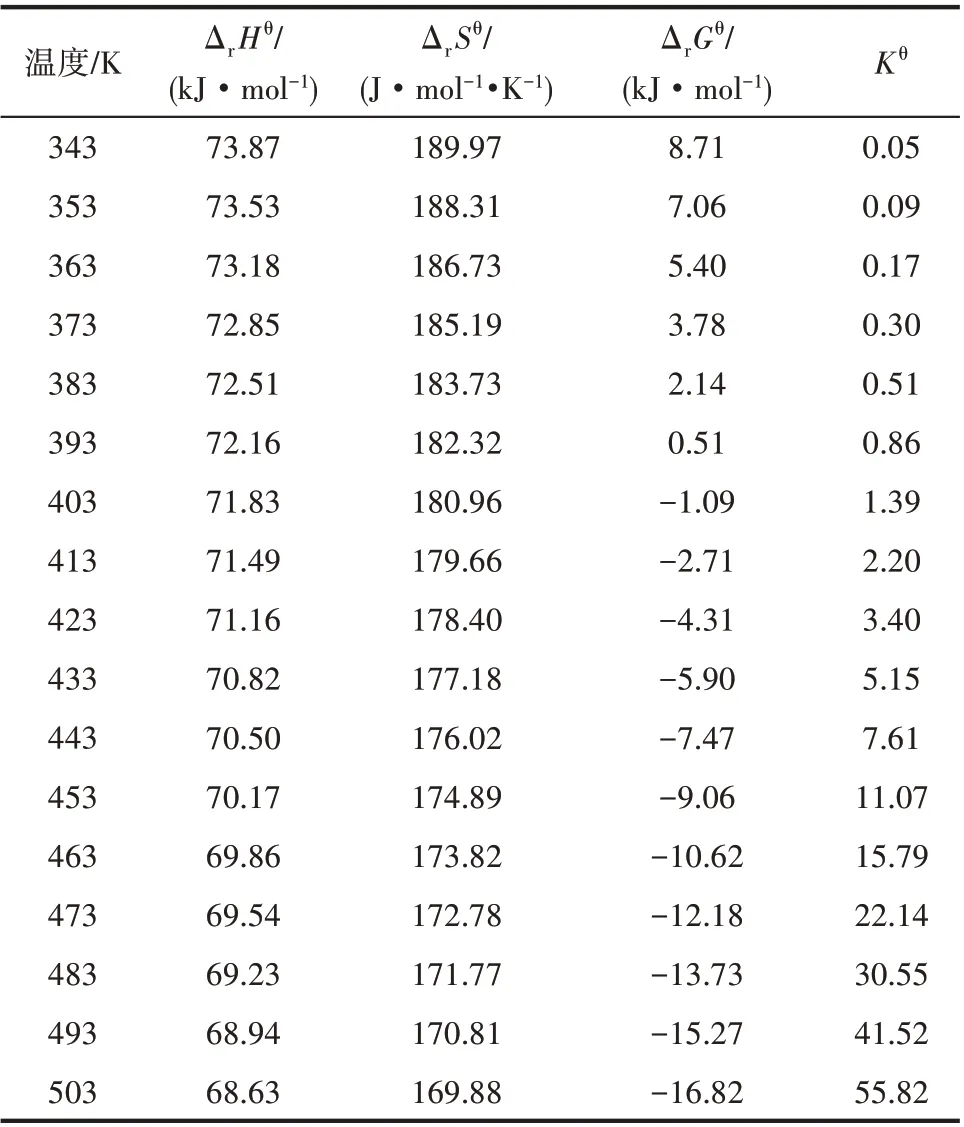
表7 不同温度下反应的ΔrHθ、ΔrSθ、ΔrGθ和KθTable 7 ΔrHθ,ΔrSθ,ΔrGθ and Kθ of reaction at different temperature
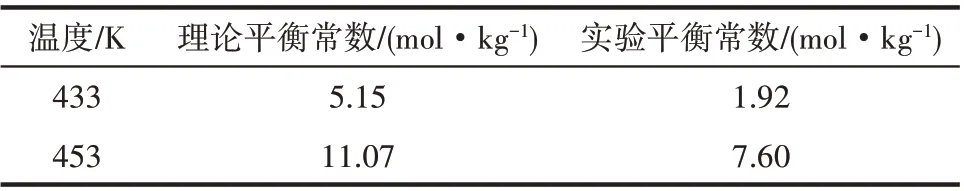
表8 平衡常数的理论计算值与实验值Table 8 Theoretical and experimental values of equilibrium constants
3.2 不同温度和时间下的反应物转化率
通过热力学分析可知高温对反应有利,因此采用间歇实验研究了常压、463~493 K 温度范围内TOME 的转化率随反应时间的变化,反应过程中通过移除副产物甲醇来促进反应正向进行,实验结果如图2 所示。从图2 可以看出,随着反应温度的升高,TOME 环化反应的速率显著加快,463 K 温度下环化反应进行270 min,反应物转化率约80%;493 K温度下反应进行50 min时反应物转化率约94%。
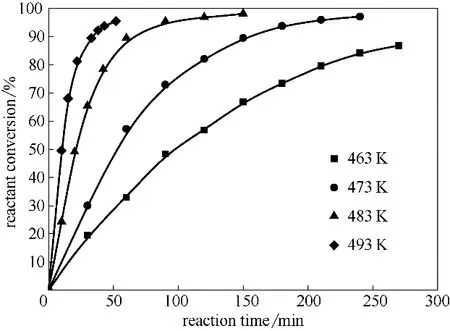
图2 温度和反应时间对反应物转化率的影响Fig.2 Effect of temperature and reaction time on reactant conversion
3.3 动力学参数拟合
假设在所研究的反应条件下反应为一级反应,则反应物转化率x与反应时间t存在以下关系:-ln(1-x)与t呈线性关系,斜率为反应速率常数k。以反应时间t为横坐标,-ln(1-x)为纵坐标作图,如图3 所示。可以看出-ln(1-x)与t呈良好的线性关系。拟合得到的不同温度下的反应速率常数如表9所示。
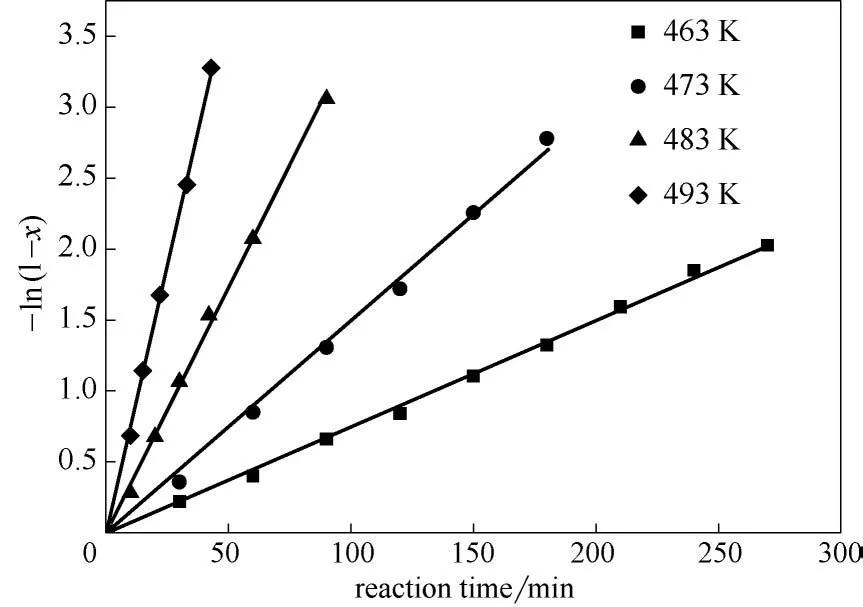
图3 不同温度下反应速率常数的拟合Fig.3 Evaluation of reaction rate constants at different temperatures
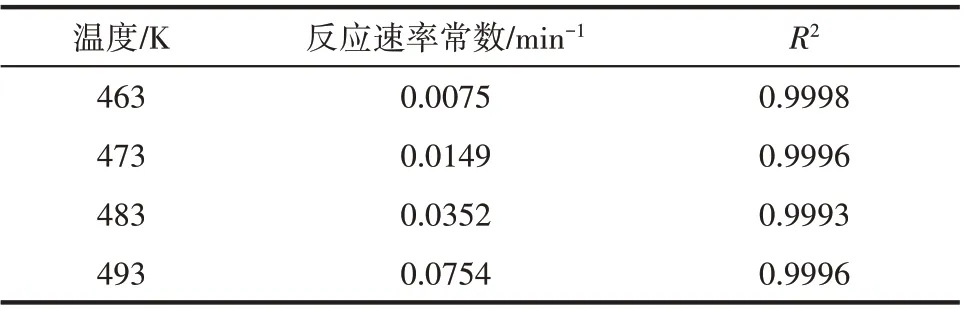
表9 不同温度下的反应速率常数Table 9 Reaction rate constants at different temperatures
用Arrhenius 方程关联表9 中的数据,以1/T为横坐标,lnk为纵坐标作图,如图4 所示。通过拟合得到线性方程,可以获得反应的活化能为143.72 kJ·mol-1,指前因子为1.19×1014min-1。
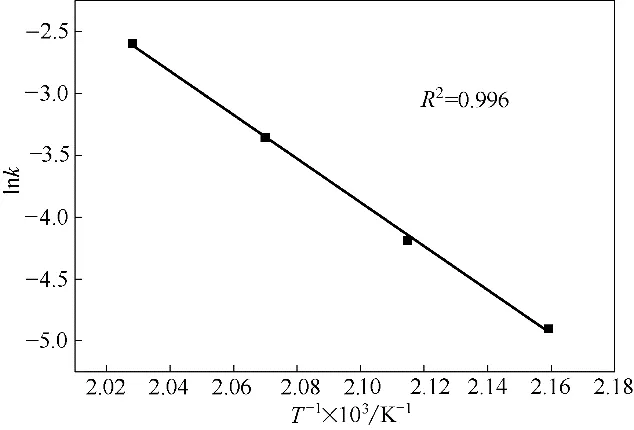
图4 Arrhenius方程拟合结果Fig.4 Fitting plot of Arrhenius equation
4 结 论
(1)通过基团贡献法计算了TOME 环化反应体系中各物质的基础热力学数据,获得了不同温度下的标准反应焓变、标准反应Gibbs 自由能变以及反应平衡常数。343~503 K 温度范围内该反应为吸热反应,Gibbs 自由能计算结果表明在403 K 以上的温度范围内反应为自发过程。
(2)随着温度升高,反应Gibbs 自由能变减小,反应平衡常数增大,说明升高反应温度有利于反应正向进行。
(3)通过实验研究了常压、463~493 K 温度范围内TOME环化反应的反应动力学。升温能够明显加快反应速率,在实验研究范围内,该反应为一级反应,反应的活化能为143.72 kJ•mol-1。
符 号 说 明
a,d,e——Yoneda 法中恒压摩尔热容的计算式参数,J•mol-1•K-1
C,D,E,F,J——恒压摩尔热容多项式中的参数
c——浓度,mol•kg-1
cp——恒压摩尔热容,J•mol-1•K-1
ΔG——Gibbs自由能变,kJ•mol-1
g——气态
ΔH——焓变,kJ•mol-1
K——反应平衡常数
k——反应速率常数,min-1
l——液态
Ni——基团数
nj——反应中各物质的化学计量系数
R——摩尔气体常数
R2——相关系数
ΔS——熵变,J•mol-1•K-1
T——温度,K
t——时间,min
x——反应物转化率
yi——分子中i类官能团数与官能团总数之比
Δi——常压沸点下蒸发焓的基团贡献值
上角标
θ——标准态
下角标
b——常压沸点
c——临界点
f——生成态
i——基团
j——反应中各物质
r——反应态
s——对比态
v——蒸发态
