固态电解质锂镧锆氧(LLZO)的研究进展
2020-04-04姜鹏峰石元盛李康万韩百川颜立全
姜鹏峰,石元盛,李康万,韩百川,颜立全,孙 洋,卢 侠
(1中山大学,广东 广州 510006;2北京化工大学,北京 100029)
锂离子电池(LIBs)已广泛应用于各类便携式电子设备中。新能源汽车的兴起更是促进了LIB技术的显著进步。考虑到目前新能源汽车的里程焦虑及未来我国巨大的储能需求,发展下一代高能量密度,高安全性的电池具有重大意义。目前,有机系液态电解质体系在商用中取得了巨大的成功,但在更高能量密度、可靠性和安全性的应用方面,现有的LIBs还是显示出了一些局限性:使用有机电解液,特别是含有环状碳酸酯、链状碳酸酯、羧酸酯类电解液具有高度易燃性[1];电解液具有较强的腐蚀性且容易分解生成CO、H2S、LEL等气相产物[2];传统的有机电解液与高电压(≥5 V)正极及大容量金属锂负极不相匹配[3]。在过去的几十年里,如何解决锂电池存在的漏液及自燃问题也一直是广受关注的焦点。解决上述问题选择之一是使用无机固态电解质。固态电解质不仅能够替代电解液,而且为新型Li-O2、Li-S电池的开发提供了可能性[4]。使用固态电解质的电池体系安全性高、无漏液现象,且固态电解质也可作为电池隔膜使用,简化了电池的整体设计。固态电解质可能比有机电解液普遍具有更宽的电化学窗口,有利于进一步拓宽电池的电压范围,提升能量密度。固态电解质还可以支持电池在高低温(例如200ºC到-50ºC范围内)下工作。使用固态电解质总体提高了电池的安全性能和使用寿命。
无机固态电解质由晶体锂离子导体和非晶体锂离子导体两类组成。晶体锂离子导体又分为:锂超离子导体(LISICON)结构(如Li1+xZn1-xGeO4)[5]及其硫代(thio-LISICON)结构(如Li4-xGe1-xPxS4)[6]、钠超离子导体(NASICON)结构[Li1+xMxTi2-x(PO4)3,M3+:Al3+、Y3+、In3+…][7]、石榴石结构[Li7La3Zr2O12(LLZO)][8]、钙钛矿结构[Li3xLa2/3-x□1/3-2xTiO3(LLTO),□=空位][9]和反钙钛矿结构(Li3OX,X=Cl、Br)[10]、锂的氢化物 [如 Li2(NH)、Li(BH4)][11]、锂的卤素化合物(Li2MCl4,M:Mg、Mn、Fe、Cd)[12]、硫银锗结构(Li6PS5X,X:Cl、Br、I)[13]。而非晶体锂离子导体包括:锂的硫化物玻璃陶瓷(Li2S-P2S5[14]和Li2S-SiS2[15])、锂的氮化物(Li3N[16]和LiPON[17])等。这些固态材料作为电解质用于全固态锂离子电池的构筑有其各自的优点和缺点[18-21]。在诸多固态电解质中,石榴石型固态电解质自从被发现以来便被广泛研究。石榴石型固态电解质具有以下优越的物理和化学性质[19,22-25]:室温下具有高离子电导;对金属锂具有良好的化学稳定性;宽的电化学稳定窗口。这些突出的优点无疑使得LLZO成为理想的用于构筑全固态电池的固态电解质之一。与其他锂含量较低的石榴石相比,通过采取适当的掺杂策略和优化烧结工艺,LLZO可以实现更高的电导率(室温下约1 mS/cm)。研究人员也一直在探索可实现商业化的LLZO用于构筑固态电池的工艺设计路线。对于实际的固体器件来说,使用固态电解质构筑电池所面临的主要挑战包括与金属负极(Li、Na、K)匹配、界面间良好物理接触及界面稳定性,而解决这些问题的关键在于透彻地理解固态电解质材料的基本特性。
本文总结了近年来富锂石榴石的研究成果,对LLZO的结构、Li离子输运机制及构筑石榴石型固态电池工艺技术等方面进行了梳理。
1 石榴石型固态电解质的结构
石榴石结构的化学通式为:A3B2(XO4)3(A=Ca、Mg、Fe、Mn;B=Al、Fe、Cr、Ti、Zr、V),其中,A、B、X分别有8、6、4个氧配位[26]。当X为Li+时,其具有Li+导通能力。Li(X)原子处于框架结构的空隙中。石榴石晶体结构为面心立方(FCC),空间群为Ia-3d。通常,按每结构单元含有的Li+的数量将含锂的石榴石型固态电解质分为Li3、Li5、Li6以及Li7体系。1969年,Kasper等[27]制备了Li3体系石榴石型电解质,在该结构中,Li锂离子全部位于间隙空间最小的四面体位(24d)中,八面体位置没有Li占据。由于Li—O键较强,Li-Li间距远,Li离子被束缚在四面体中难以迁移,所以Li3体系电解质离子电导率较低。2003年,Weppner等[28]首次对Li5体系石榴石型快离子导体进行报道,其室温离子电导率为10-6S/cm数量级。相对于Li3来说,Li5体系多出2个Li,5个Li将重新排列,导致晶体结构中80%的四面体被占据,40%的八面体被占据。位于八面体的Li是可移动的,并且同时引入了四面体的空位,为Li的移动提供了更多潜在的跳跃位点。Li位置的多样性和部分占据的位置使得Li5体系比Li3体系具有更高的离子电导率。但是因为Li2(16f)位置Li离子的浓度不高,所以电导率仅有很小的提升。通过二价碱土离子取代La3+,可以进一步提高Li+浓度,得到通式为Li6La2M2O12的Li6体系。掺杂替代La(A位,24c)获得的Li6BaLa2Ta2O12的室温电导率可达4×10-5~5×10-5S·cm-1,活化能为0.4 eV[28-29]。然而碱土金属离子半径一般小于La,导致掺入La位后晶胞尺寸缩小,Li—O键长变短,Li离子不易迁移,电导率与Li5体系相比提升不大。
提高电导率的关键在于制造四面体空隙24d位置的锂空位。从Li3到Li5、Li6体系,增加单胞中的Li+的数目可以让四面体空隙位置的Li+减少,八面体空隙位置的Li+增加,进而提高电导率。2007年Murugan等[8]首次采用固相合成法,在1230ºC下烧结制备出了纯立方相石榴石型结构[a=12.9682(6)Å;空间群Ia-3d]的Li7La3Zr2O12(LLZO)。随后,Kaeriyama等[30]于1180ºC烧结同样合成出纯立方相LLZO。LLZO存在立方相(c-LLZO)和四方相(t-LLZO)两种晶体结构,两种晶体结构示意图及Li1、Li2配位多面体如图1(a)、(b)和(d)所示。两种结构最显著的差别就是Li的占位,在立方相中Li部分占据间隙位,而在四方相中Li占满间隙位。t-LLZO的离子电导率比c-LLZO低了两个数量级,约在10-6S/cm数量级。t-LLZO与c-LLZO存在空间群差异及离子电导率差异,具体见表1。

表1 四方、立方LLZO的基本性质Table 1 Structural fundamentals of t/c LLZO
基于诸多纯相LLZO的研究发现[8,34-37],其晶格常数通常在a=12.95~12.97 Å范围之间。石榴石型LLZO的晶体结构由8配位的LaO8十二面体(24c)和6配位的ZrO6八面体(16a)构成。Li原子在两种位点内随机占位且部分占据框架结构的间隙,即四面体24d位点和八面体48g或是远离中心的96h位点。通常情况下,由于Li+共面时存在排斥力,48g位点取代了96h位点。相比于Li3体系与Li5体系的立方相结构,Li7体系中四面体位置的Li+占有率有所降低,而八面体位置的Li+占有率有所提高。
对比t-LLZO,如图1(f)所示,c-LLZO的Li1占据率接近1。对于c-LLZO,Li1位置作为连接点,其Li-Li的距离较小,而t-LLZO,Li-Li的距离大于2.5 Å。跃迁距离的缩短是c-LLZO具有高离子电导率的原因之一。t-LLZO中四面体空隙有两种位置,分别是8a和16e位;八面体空隙同样有两种位置,分别是16f和32g位,如图1(c)所示。其中Li1原子占据四面体8a位置,另一种四面体位置没有占据,Li2和Li3完全占据扭曲的八面体位16f与32g位。根据晶格内Li离子互斥模型[38],Li1仅仅占据1/3四面体空隙8a位,余下的占据2/3四面体16e位。Li2占据全部的八面体空隙16f和32g位。对比t-LLZO与c-LLZO的晶胞参数可知,t-LLZO中8a与16e位间距较远,因此允许在8a和32g位上容纳两个Li离子。而32g与16f位间距较近,使得毗邻32g位的16e位无法容纳Li离子。t-LLZO中3个锂位置均为全充满状态且锂离子间距较大,造成Li离子迁移困难,离子电导率较低。c-LLZO可容纳锂的位置同样有3种,分别是四面体空隙24d位、正八面体空隙48g位和偏八面体空隙96h位。由于Li离子间存在斥力,Li离子一般占据八面体中心48g位的两侧,即96h位。96h位距离很近,仅一半可被Li离子占据。c-LLZO中锂计量数小于7,表明Li离子在24d和96h位上处于随机无序占据状态[39]。Li离子在c-LLZO中的迁移容易很多,故而该材料表现出高电导率。环绕八面体的锂离子通道示意图如图1(e)、(f)所示。不同于t-LLZO[图1(e)],L1与L2位为相间排列。因为Li+间的排斥作用,锂离子以无序方式相隔占据L1、L2位。此外,基于第一性原理计算发现,四方相中Li离子是集体移动的,而立方相的LLZO中Li离子是非共时的单离子跃迁和诱导下的集体输运,相比前者,后者离子跃迁的能垒更低。
在较高的温度下,四方相可以向立方相转变。实验观察到的相变温度是变化的。室温下,c-LLZO是一种锂离子无序的亚稳定相。随着晶格中的Li离子增加到24d和96h位容纳的上限,电荷排斥力的存在会让Li离子稳定到四方相的格位上,物相也随之转变为四方相。Adams等[40]基于原位X射线衍射(In-situ XRD)结果报道了纯相LLZO在177ºC处发生四方相向立方相的相转变过程,而Geiger等[41]使用XRD表征这种相转变发生在100~150ºC之间。Kokal等[42]使用差示扫描量热法(DSC)证明,相变温度远高于700ºC。设法在室温下稳定立方相,以利用它的高离子导电性是目前科研人员关注的重点。大量的工作集中在掺杂元素的引入及使用各种合成方法以稳定立方相。这些合成方法通常需要在750~1230ºC范围内进行多次煅烧,总合成时间接近或超过24 h,具体的内容将在下一章详细展开。
诸多实验研究了烧结温度对LLZO晶体结构的影响[8,39-40,42-45]。研究结果表明LLZO在1150~1230ºC的温度范围内形成稳定的立方结构,而在1150ºC的烧结温度以下,倾向形成四方结构。2009年Awaka等[46]报道了在较低温度980ºC烧结后LLZO存在四方结构(空间群I41/acd)。Percival等[47]也报道了在750ºC以下烧结得到的石榴石型Li7La3Sn2O12具有四方结构。研究结果表明,在室温条件下,t-LLZO是稳定的结构,t-LLZO是一种微变形的立方石榴石型结构[46]。其c轴晶胞参数变小,而a、b两轴晶胞参数变大。如表1所示,文献报道的t-LLZO晶格参数为a=13.07~13.12 Å,c=12.67~12.72 Å[48-51]。在立方相向四方相转变(四方畸变)时,立方相24d位转化为完全占据的8a位和未占据的16e位,立方相96h位转化为两个16f和32g位。
t-LLZO较c-LLZO的室温离子电导率低两个数量级。Wolfenstine等[48]采用热压法制备了t-LLZO样品。其电导率在室温下为2.3×10-4S/cm,是报道的t-LLZO所具有的最高离子电导率。值得注意的是,热压得到的样品具有高达98%的相对密度,可能是热压t-LLZO样品具有高电导率的主要原因。综上所述,c-LLZO比t-LLZO具有更高的电导率。对于立方相结构,随着总的Li浓度的提高,烧结温度的升高,八面体位置的Li浓度增加,石榴石的体相离子电导率增大。
2 Li+在LLZO中的输运
尽管c-LLZO具有较高的离子电导率,但对比传统液态电解质还有一定差距。清晰地理解Li+在石榴石结构中的输运,有利于进一步提高该材料的离子电导率。得到锂离子的具体占位是分析锂离子在晶格中输运机制的第一步。Awaka等[52]通过对c-LLZO的单晶X射线衍射数据精修发现,四面体配位的Li1(24d)位更容易被占据。但由于Li+的XRD散射因子很弱,使用粉末X射线衍射的数据定位Li5,Li7石榴石中Li+的占位存在很大的争议。中子衍射可以很好的解决这个问题。2011年,Goodenough等[53]得到从室温到600ºC下立方相的Li7La3Zr2O12中子衍射数据(图2)。通过最大熵的分析方法可清楚的发现,位于24d与96h位的锂表现出明显的离域,而当温度高于400ºC,不同占位的Li离子由不连续核密度分布,逐渐互相连通构成24d→96h→48g→96h→24d的3D输运通道。此外随着温度升高,位于扭曲八面体中心的48g位的Li占据率逐渐上升。
核磁共振(NMR)可以探测固体中短程内的结构变化,很适合分析Li的配位环境[54]。24d与96h位的Li离子的化学环境存在略微的不同,高分辨率的6Li-NMR可将二者区分开来。进一步通过二维核磁共振法则可以探测到这两种位置的Li离子之间的交换过程。在Li3体系中(如Li3Nd3TeO12),6Li NMR测试结果只得到了一种锂的信号峰,该峰对应着四面体位置上Li的有序排列[55]。而对于Li5、Li6和Li7体系,Li NMR研究结果得出了第二种信号峰,该信号峰对应扭曲的八面体(48g/96h)位上的Li。对于富锂体系,四面体位置的Li离子没有参与传导,而偏八面体位置的Li具有较高的移动性。Wullen等[56]同样利用NMR对Li5体系(Li5La3Nb2O12)进行了研究。研究发现八面体位置的Li占有率增大,其离子电导率增大,这说明八面体位置的Li可能具有更高的移动性。上述现象可能是Li5体系具有较高离子电导率的主要原因。此外,在60~140ºC的温度范围内,四面体位置的Li所对应峰的宽度没有发生变化,表明四面体位置的Li的移动性较低。二维交换NMR测试结果表明,Li八面体位置之间存在快速的交换过程,但在四面体与八面体位置之间,没有Li交换过程,因此认为Li的跃迁只发生在相邻八面体之间,而不经过四面体位置。Wang等[57]使用梯度核磁共振技术清晰观察到了24d与96h之间的离子交换,并发现锂沿着24d→96h→48g→96h→24d路径进行输运,八面体与四面体占位的离子的扩散系数分别为10-9cm2/s和10-11cm2/s。测试结果如图3所示。
近年来,先进的实验技术和表征手段有效地帮助理解石榴石结构中锂离子的输运过程。但是在原子尺度上皮秒量级的离子跃迁,目前实验表征技术仍难给出清晰的答案。2012年Xu等[58]使用第一性原理细致计算了Li3、Li5、Li7石榴石体系的Li离子占据态与扩散过程。结果显示持续增加晶格中Li的浓度会削弱Li1(24d)位的稳定性。通过对c-LLZO结构优化发现,在基态能量下的构型中,超过一半的四面体Li1(24d)位是没有锂离子占据的,而八面体的Li2位占据率增大到90%。后续过渡态计算发现,石榴石结构中Li的输运路径有两种[图4(a)、(b)、(c)]。在路径A中,锂离子通过相邻的八面体位点之间的间隙迁移,绕过与之连接的四面体。在路径B中,锂离子通过八面体和四面体的共用三角形面进行跃迁。路径A中的锂离子迁移的活化能为0.8 eV,当材料Li+含量较低时(例如Li5La3Nb2O12),锂离子迁移路线倾向于路径A;路线B中的锂离子迁移的活化能为0.26 eV,在高锂填充物(例如Li7La3Ta2O12)中更倾向于路径B。上述工作指出优化Li/Li空位的比率,使以路径B扩散过程占据主导是非常重要的。但该工作没有考虑LLZO晶格中存在着大量Li/Li空位排列的动态过程。次年,Jalem等[59]使用第一性原理分子动力学模拟方法,发现LLZO中高体相电导率是由于协同扩散主导的,在24d位占据的Li是不稳定的,其可能诱导临近的Li发生再分布。He等[60]分析快离子导体(LGPS、LLZO、LATP)AIMD模拟结果发现[图4(d)、(e)、(f)],Li+动力学的 Van Hove关联函数显示在几个皮秒量级下大多数Li+是以高度协同的方式进行跃迁的。在LLZO中,四面体的锂离子跃迁到最近邻O的位置并占据这些O的位置,然后再跃迁到最近邻的四面体位置,最终展现为沿石榴石扩散通道下的多离子跃迁的过程。
除了上述讨论的微观扩散路径与机制,通常认为晶界对离子的输运有阻碍作用。晶界为多晶样品中不同取向的晶体之间的接触表面,它们在结构和组成上与体相晶体有很大的不同[61]。晶界已被证明在大多数情况下增加了离子跨越体相迁移的阻力,使它们在宏观样品中的传输过程变得不稳定[61]。正空间电荷(阴离子空位)可以使移动阳离子的晶界发生排斥作用且某些材料的晶界也可以通过形成不协调位点的通道来辅助平行于其表面的离子传导过程[62]。Yu等[63]的计算结果表明,Li离子在LLZO晶界区域的传输通常比在体相区域要慢。值得注意的是,此过程对晶界结构及温度十分敏感。锂离子在高温(>900 K)下,在LLZO晶界中的扩散仅比体相扩散稍慢一点。在室温下,锂离子在相对紧凑的晶界处离子电导率为体相的一半,而在相对松弛的晶界处则比体相的离子电导低两个数量级。Dobretsov等[64]的实验结果表明,LLZO样品晶界电阻明显大于体相电阻,这种电阻的增加很可能是由位于晶界上的未知成分所决定的,而不是LLZO本身。通过XRD及活化能的计算结果,存在于LLZO晶界上的杂质相可能为LiZrO2或LiAlO2相。一般来说,调控晶粒晶界的浓度可以改变固态电解质的离子电导率,这对提高LLZO的离子电导率具有一定的指导意义。
3 元素掺杂对LLZO晶体结构和离子电导率的影响
目前,掺杂离子半径与主离子相近的元素是促进c-LLZO在室温下稳定和提高离子电导率的策略选择。通过置换或者掺杂离子(即与主离子价态不同的掺杂剂)可以产生电荷补偿的空位或间隙。阳离子取代在维持氧化学平衡的同时通过降低Li含量或增加Li空位浓度来稳定立方相。稳定c-LLZO所需的锂空位的确切数量尚未确定,通常认为此数值处于每单位0.125~0.500 mol的锂空位之间[65-68]。具有较高Li空位浓度(0.4~0.5 mol)的LLZO在室温下的离子电导率同样较高。此外,共掺杂技术也得到了广泛的应用。共掺杂不仅可以稳定立方结构,而且可以有效促进Li的输运。此外,密度泛函理论(DFT)计算了LLZO中掺杂物可能的位置,并为寻找具有优异性能的LLZO基复合材料提供选择[69],已经进行的取代包括:Al、Fe、Ge和Ga来取代 Li; Sr,Y 和 Ce 取代 La;Nb、Ti、Ta、Sb、Mg、Sc、Zn、Ru、W、Te取代Zr等。表2列出了未掺杂和掺杂LLZO的烧结温度、烧结时间、晶格常数、相对密度和离子传导活化能的详细信息。
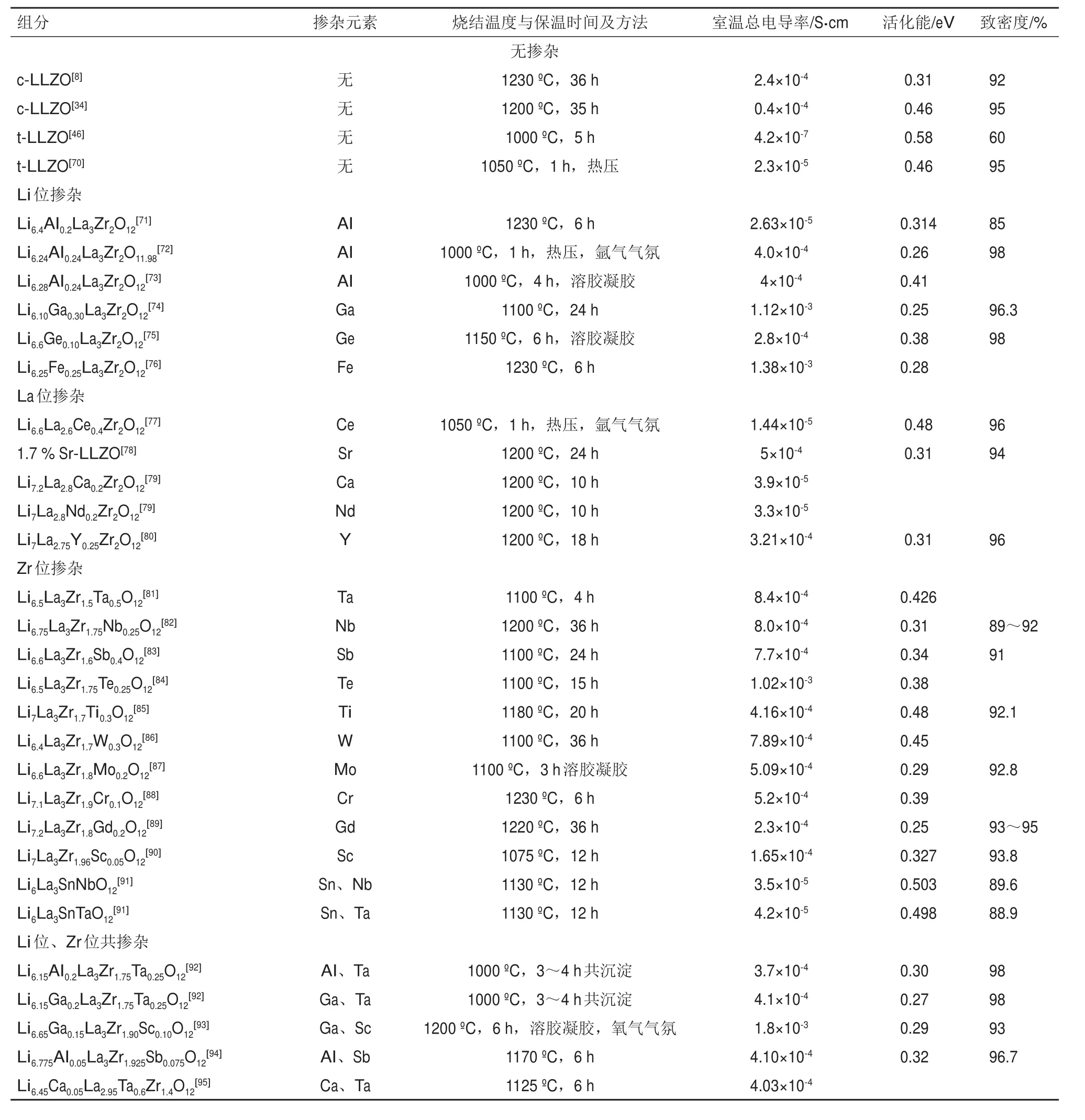
表2 LLZO的掺杂组分、烧结条件、总电导率、活化能及致密度Table 2 Doping compositions,sintering conditions,total conductivity,activation energy and density of LLZO
c-LLZO中可掺杂位置共有3种:分别是Li位、La位、Zr位。其中关于Li位和Zr位的掺杂研究最为广泛。总结发现,无论LLZO中锂含量是恒定的还是变化的,无论被取代的位置是什么,也无论相应的取代元素是什么,当晶格参数在12.91~12.98 Å范围内时,锂离子电导率最高。晶格参数超出此范围的取代则表现出较低的离子电导率。Kihira等[105]已经系统地研究了LLZO最佳晶格参数,在该研究中用Nb代替Zr,用各种离子尺寸的碱土金属(Mg、Ca、Sr和Ba)代替La,实验结果表明:不论是Li含量固定的组分还是因元素掺杂Li含量发生变化的组分,最佳晶格常数均在12.94~12.96 Å之间。在石榴石系列的所有其他成分中观察到的趋势同样表明,具有高离子电导率的LLZO的最佳晶格参数也都处于此范围内。Zeier指出[106],对于石榴石型晶体结构来说,最佳的晶格常数范围是12.90~12.95 Å。扩展的晶格能够在一定程度上提高离子导电性。目前的工作尚未严格讨论在晶格参数范围内存在最大锂离子导电性的机理。一项计算研究指出了关于内部结构的具体参数,诸如八面体和四面体Li位点的大小或体积以及三角形窗口是如何随掺杂物变化而变化的[107]。在掺Ta的LLZO中存在晶格收缩现象,锂离子的含量和表面积都增加,空位同样增加。与Zr相比,Ta对邻近的O离子的吸引力更强,由于Ta—O键收缩,LaO8的8个扭曲的立方结构则保持刚性,最终增加了位点大小和颈部面积。
一般认为,掺杂剂(如Al3+;烧结过程从坩埚中部分取代LLZO或直接掺杂)可以稳定立方相。Geiger等[108]研究了Al掺杂和烧结温度对Li7La3Zr2O12结构的影响。Al存在于LLZO晶体结构中的两个Li位置上。在没有Al掺杂和较低烧结温度下得到LLZO为四方相结构。Kotobuki等[109]报道了Al2O3作为烧结助剂可以降低c-LLZO的烧结温度(约200ºC),并且抑制La2Zr2O7杂质的生成。对于掺杂Al的化合物,晶格会随着填满四面体位置的铝离子的增加而扩展。随着Al掺杂量的增加,位点大小没有明显变化,但颈部尺寸增大。研究人员通过中子衍射、27Al-NMR测试手段研究了Al在c-LLZO晶格中的位置[109-111]。结果为四面体空隙24d位和八面体空隙96h位与Li+竞争。一个Al3+可以向晶格中引入3个Li空位,同时Al3+在四面体中的迁移也会相对Li离子困难得多。尽管Al3+占据了四面体的位置,对Li的传导有一定阻碍作用。但因为增加了平均颈部尺寸,所以Al的引入实际是有利于提升离子电导率的。值得注意的是,不同元素掺杂对LLZO离子电导率的提升存在一定浓度范围。在此浓度范围之外,掺杂剂的浓度要么低到无法对结构产生影响,要么高到无法被容纳在石榴石结构框架中。元素掺杂同样可能导致Li浓度升高或降低。过度偏离的晶体结构与Li浓度都将导致Li离子电导率下降。最高导电率的LLZO基化合物的Li含量为每单元6.1~6.8,低于每单元7.5的理论极限。Zeier已经指出了石榴石族的最佳极限,迄今为止已实现最高电导率的为Li6.55Ga0.15La3Zr2O12,室温下可达2.06×10-3S/cm[106]。Jalem等[112]使用分子动力学模拟计算得出,Li7-3xGaxLa3Zr2O12(x=0.02)离子电导率可以达到6.08×10-3S/cm。该值很可能是石榴石型固态电解质锂离子电导率的上限。迄今为止,LLZO离子电导率的最高值仍比普通电解液低一个数量级。
4 构筑LLZO基固态电池的尝试及展望
当前高能量密度锂电体系仍依赖于高镍三元正极、硅碳负极和电解液的组合。商业化的锂电池有望在未来5年内达到350 W·h/kg的极限,但这仍无法满足动力电池在能量密度方面日益增长的要求。因此全固态电池被推到了前端,构筑LLZO基固态电池在最为关键的能量密度方面,有望彻底解决纯电动汽车的里程焦虑。目前商用体系下的锂离子电池已经逐步接近极限性能,特斯拉NCA 18650电芯下的电池组,能量密度为250 W·h/kg,应用于Model 3的21700电芯能量密度更是高达300 W·h/kg,支持续航里程400~500 km。如此高的性能也仍然无法解决续航里程焦虑。根据《汽车产业中长期发展计划》《节能与新能源汽车技术路线图》的相关指引,动力电池系统的能量密度需要在2025—2030年内达到350 W·h/kg以满足市面上电动汽车的续航里程需求。从目前技术来看,仅凭借传统锂电池的技术研发,这一目标显然已经无法实现。而为保证动力电池的高能量密度和安全性,固态电池的研发进度给整个新能源汽车行业带来了光明。因此,全固态电池被广泛认为是下一代动力电池正确的技术研发方向。不过固态电池虽然具有诸多优势,但根据现有的研发进展来看,也还有两项技术难题尚未攻破。一是固态电解质在室温条件下的离子电导率不高,二是固态电解质与正负极之间界面阻抗比较大。
绝大多数基于氧化物和硫化物的固态电解质材料在与锂金属接触时是热力学不稳定的,这可能导致在二者界面处形成具有不同性质的新相或混合物。这种界面一般具有较差的离子导电性,导致高的界面阻抗甚至是成分降解。固态电解质用于构筑全固态锂电池的一个潜在缺点是离子扩散依赖于固体颗粒间的接触。低离子电导率与高界面阻抗导致了固态电池的高内阻,锂离子在电池内部传输效率低,在高倍率大电流下的运动能力更差,直接影响电池的能量密度与功率密度。在多晶材料和复合电极中,为了实现高效离子传导,必须最大限度地保持固体颗粒之间的接触。发展有效的策略来解决物理接触的问题是构筑固态电池的当务之急。LLZO与金属Li有着优异的电化学稳定性,但许多研究报道了其具有较高的面积比阻抗(ASR)。典型的阻抗值达到数百个kΩ·cm2,这些研究表明Li与LLZO粘附性差或LLZO表面杂质(如Li2CO3)导致了Li和LLZO之间较差的物理接触。为了改善金属Li与LLZO界面接触差的问题,当前采用较多的技术手段包括原子层沉积(ALD)、溅射、湿法处理、热蒸发、抛光、加热等[113-119]。在已报道的技术中,将Li加热熔化以改善界面接触是最直接且简单的方法。据报道[120-121],在加热后,界面电阻在室温下下降至 25~28 Ω·cm2。Li2CO3钝化层的形成同样会阻碍Li对LLZO表面的粘附。Sakamoto等[122]已通过试验证明在LLZO表面加热金属Li之前,采用湿法(乙二醇基添加剂)抛光石榴石表面的策略,可以更进一步降低Li-LLZO界面电阻至2 Ω·cm2。Li等[123]则尝试在合成过程中添加2%(质量分数)LiF以降低H2O和CO2在LLZO中的扩散,以此来抑制Li2CO3的形成。LiF的添加使Li和石榴石之间的ASR降低至345 Ω·cm2。
在已报道的文献中,Al2O3的原子层沉积(ALD)效果是最好的。该方法可以将室温下的ASR从1710 Ω·cm2降低至1 Ω·cm2[112],效果十分显著。在ALD处理过的LLZO表面上熔融金属Li时,Al2O3层的存在增加了界面接触面积,同时抑制了Li2CO3的形成。尽管ALD非常有效,但由于较高的成本和操作的复杂性,ALD法在商业应用中并不普及。简单的抛光可能对于实际应用来说更具吸引力。Thangadurai等[122]采用湿法处理技术,将Zn(NO3)2溶液均匀分布在LLZO表面并使其热分解形成ZnO,同样有效地降低了Li和LLZO之间的ASR。碳的引入被认为可以有效改善Li与固态电解质的界面接触性。Duan等[119]采用的是Li-C复合负极。Li-C复合材料是通过在250ºC的热板上向连续搅拌熔融的Li中添加石墨粉制备的。Li-C复合材料与石榴石的界面电阻仅为11 Ω·cm2,与Li-LLZO界面电阻381 Ω·cm2相比有了很大的降低。
正极材料与LLZO界面的构筑目前研究得较少。为确保LLZO和正极材料的界面有良好的接触,研究人员进行了各种尝试。Ohta等[124]通过脉冲激光沉积技术,在Li6.75La3Zr1.75Nb0.25O12上沉积了LiCoO2,在3.95 V(vs.Li/Li+)充电状态下正极-电解质界面处的ASR为170 Ω·cm2,与液态有机电解质的ASR值相当。Liu等[125]将V2O5涂覆在Li7La2.75Ca0.25Zr1.75Nb0.25O12颗粒上,随后将其加热至800ºC。该电解质的室温ASR降低至71 Ω·cm2。Park等[126]也同样采取了类似的退火技术,把LiCoO2在LLZO表面加热至700ºC,保温6 h。飞行时间二次离子质谱(TOF-SIMS)和XRD研究证实,在加热时,LiCoO2的存在会导致c-LLZO相转变t-LLZO。除了传统的插层正极材料外,研究人员同样将目标放在与下一代正极材料的界面,特别是与硫的界面的构筑方面。Fu等[127]的实验结果表明LLZO与熔融硫混合后仍为立方相,但计算和实验结果表明,在硫与LLZO界面上形成了由Li2S和Li2SO4组成的钝化层。
为了实现全固态锂电池的长循环,在构筑电池单元时,研究人员通常会在固态电解质和正/负极之间添加“少量”(通常为几μL)传统液体电解质。研究发现,尽管具有“混合电解质”的电池显示出比全固态电池更高的容量,但其循环能力比传统液体电池更差。Xu等[128]认为混合电解质电池的不良循环可能是由于与液体电解质接触的石榴石表面上的Li+/H+交换和固液电解质高电阻界面的形成造成的。Liu等[129]证实了Li6.5La3Zr1.5Ta0.5O12对于典型的锂离子电池液态电解液LP30是不稳定的。由于二者间的反应,在其接触界面上会生长一层新的SEI界面层,该SEI主要由Li2O、Li2CO3、LiF以及一些有机物等构成,大大增加了界面的电阻。缺少少量的传统液体电解质的添加,全固态电池很难进行充放电循环。虽然从商业电池中去除液体电解质并过渡到全固态电池是理想的,但石榴石和正极材料之间的高界面电阻仍然是一个难以解决的问题。在未来的电池设计中,液体电解质可能仍会保留一段时间。综合来看,安全性高、能量密度潜力大的固态电池必然是下一代动力电池的研发方向,但截止到目前,确实还没有任何量产的产品能够在各方面明显胜过传统锂离子电池。固态锂电池更大的能量密度空间成为一些企业追求固态电池的一个重要原因。就目前情况来看,单纯的LLZO陶瓷片是无法用来制备大容量电芯的。除此之外,LLZO基固态锂电池成本也远高于液态锂电池;在工程化层面,全固态电池在材料和工艺层面也面临很多问题,比如充放电过程中的膨胀问题,加压、涂布等生产工艺的挑战,这些都是商业化生产中必须解决的问题。
虽然LLZO基固态电解质用于固态电池商业化之路困难重重,但是国内外众多企业纷纷入局固态电池研发。2011年,法国博洛雷(Bolloré)首次将商业化固态电池应用于EV。2018年,本田、日产联手丰田、松下、汤浅以及日本三大化工集团成立了“锂电池技术与评估中心”,以联盟的形式开展固态电池的研发。2018年11月,清陶新能源宣布建设第一条单体能量密度达到400 W·h/kg的固态电池生产线,并于2019年11月正式投产。一直坚持混动和氢燃料电池路线的丰田计划在2020年以后全面引进EV,在2020年东京奥运会期间推出一款搭载固态电池的电动汽车,预计2025年左右可以大规模生产固态电池汽车。宝马集团正与固态电池公司Solid Energy合作共同开发固态电池,大众集团同样看好固态电池前景,并入股研发固态电池的创业公司Quantum Scape。此外,从2019年5月起,日本政府将出资16亿日元,联合国内丰田、本田、日产、松下、GS汤浅、东丽、旭化成、三井化学、三菱化学等大型汽车厂商、电池和材料厂商,共同研发固态电池。
5 结 语
电解质作为电池的重要组成部件,其性能的好坏直接决定了电池性能的优劣。总体而言,与液态电解液相比,固体电解质在材料安全性、稳定性和组装电池的设计简单性等方面具有明显优势。但固态电解质体系仍然面临离子电导率较低(对比电解液)以及固-固界面不兼容的问题。LLZO作为最具市场化潜力的固态电解质材料之一,一直吸引着众多研究人员的关注,通过深入了解LLZO晶体结构以及通过元素掺杂对富锂石榴石结构进行优化,已经将LLZO的锂离子电导率提高一个数量级,并且诸多结果表明,对富锂石榴石家族的晶体结构和Li+浓度的调控已经达到顶峰。尽管如此,构筑低阻抗与重现性高的固体电极/固体电解质界面等突出问题仍有较长的路要走,固态电池的春天还没有到来。从综合布局固态电池的企业数量以及电动汽车产业需求来看,固态动力电池产业仍然是风险与机遇并存,并且存在潜在风险难以评估的问题。
