三元NCM锂离子电池高电压电解质的研究进展
2020-04-04毛舒岚王卓雅陆盈盈
毛舒岚,武 倩,王卓雅,陆盈盈
(浙江大学化学工程与生物工程学院,浙江 杭州 310027)
目前,锂离子电池在便携式电子产品、电动汽车、混合动力汽车及智能电网等领域具有广阔的应用前景[1-3]。现有的正极材料中,层状三元材料LiNixCoyMn1-x-yO2( 以 下 简 称 NCM) 和LiNixCoyAl1-x-yO2(以下简称NCA)具有较高的比容量和工作电压平台及良好的倍率性能,在电动汽车领域占据重要地位[2]。然而,目前的电动汽车快速的发展对电池能量密度提出了更高的要求[4]。提高三元材料的操作电压(>4.3 V)可以使Co3+氧化为Co4+,释放更多的容量[5],且能量密度=电压×比容量[6],因此,高工作电压极大地提升了三元锂离子电池的能量密度,从而满足电动汽车的续航里程需求。但目前国内NCA正极材料的生产技术并不成熟,故本综述主要对高工作电压下NCM电池进行探讨。
传统碳酸酯电解液电化学窗口较窄(<4.3 Vvs.Li+/Li)[7],电压升高后,一方面电解液自身会发生分解;另一方面正极与电解液之间的副反应加剧,NCM中过渡金属溶出,进一步使得电解液分解。由此产生大量气体,极易引发燃烧爆炸[8-9]。针对以上问题,本综述重点在于如何进行非水系高电压电解质的设计,从电解液在高电压下分解以及界面副反应的机理出发,总结了近年来三元正极材料锂离子电池在高电压溶剂、锂盐、添加剂方面的进展,以及固态电解质和离子液体在高电压NCM电池中的应用,最后对高电压电解质未来的发展方向提出展望。
1 高电压电解液机理分析
1.1 前线轨道理论
前线轨道理论认为在分子中,最高占据轨道(highest occupied molecular orbital,HOMO)上的电子能量在所有的占轨道中最高,容易发生亲电反应;而最低未占轨道(lowest unoccupied molecular orbital,LUMO)在所有的未占轨道中能量最低,容易接受电子发生亲核反应。HOMO和LUMO是电解液的窗口,为了维持电解液的热力学稳定,需要将其电极电势控制在此窗口内[10]。对于高电压电解液,电解液组分的HOMO能量应该尽可能低[11]。因而,由溶剂分子得到或失去电子的能力可以判定溶剂的稳定性,根据前线轨道理论与物质电化学稳定性的关系,通过计算、比较不同化合物的能量大小,可以从理论上确定合适的溶剂和添加剂[12]。
1.2 电极-电解质界面
一般认为,NMC化合物中Ni、Co、Mn的主要氧化态分别为+2、+3、+4价,同时存在少量Ni3+、Mn3+离子。充电过程中,NCM中发生Ni2+→Ni3+、Ni3+→Ni4+反应,随后Ni4+与电解质发生氧化还原反应,电解质被氧化形成正极固体电解质界面(CEI)。CEI层的形成在大多数情况下会消耗电解质而导致功率衰减、容量衰减、高阻抗、低库仑效率、气体析出等多种问题[13]。同时,CEI层又可以阻碍电极与电解液之间发生电子转移反应,有效地抑制电解液/电极的界面反应,对提高正极材料的表面稳定性起着重要作用[14]。因此,通过在电解液中加入功能添加剂,经电化学反应在正极材料表面生长合适的人工CEI层,避免正极与电解液进一步接触,从而提高界面稳定性[15]。
大多数锂离子电池的CEI的组成和性能与电势关系密切,在反复的充放电过程中不断发生变化,难以确定其组成和含量[16]。Liu等[17]通过设计增强拉曼光谱(SERS)活性纳米粒子的单层组装,研究了无黏结剂LiNi1/3Co1/3Mn1/3O2(NCM111)电极的CEI动态变化过程,在实验中观察到CEI中含有酯链和醚链。Li等[18]通过对富镍层状锂过渡金属氧化物模型材料进行三维化学和成像分析,描述了正极在普通非水电解质中的动态行为,绘制电池运行过程中复杂的电极-电解质界面化学和结构演化的示意图,如图1所示。研究指出CEI中的部分物质在约4.5 V的高氧化环境下会分解,活性物质的溶解加剧,而在4.5V的反复循环过程中,CEI趋于稳定,并在一定程度上抑制表面颗粒溶出和结构重构。在100圈循环后仍在LiNi0.7Co0.15Mn0.15O2表面检测到MFn、LiF、RCFx、C2HO-等,证明这些组分能够在一定程度下耐受4.5 V高电压。
与负极不同,正极组成更加复杂,导致CEI的组分更加复杂且随循环动态演化,并且导电碳也会影响CEI组分,所以目前的表征手段一般只监测了其电化学反应开始后的厚度变化,进一步需要有效的原位表征手段探究其不同组分在高电压下的变化过程。
2 溶 剂
基于理论计算并结合对界面反应机理的理解,可以有效研究、设计电解液。电解液一般由溶剂、锂盐、添加剂构成,传统用于NCM的电解液大多包含大量的碳酸酯基溶剂,如碳酸亚乙酯(EC)、碳酸二乙酯(DEC)以及碳酸二甲酯(DMC),它们的离解能力高、离子导电性好并且能在石墨负极上形成合适的固体电解质界面(SEI)层,被广泛用作溶剂,可以在4.3 V(vs.Li/Li+)以下的锂离子电池中正常工作。然而当电压增至4.6 V(vs.Li/Li+)以上后,电解液将会持续分解,并面临各种安全性和稳定性威胁[19],因而急需研发适用于高电压锂离子电池的电解液溶剂。近年来,研究人员相继开发了砜类、腈类、氟代碳酸脂等适用于高电压下的新型溶剂。
2.1 砜类溶剂
砜类溶剂包括环状砜和线性砜。与传统溶剂相比,砜类溶剂具有更高的介电常数(ε=43.4),更宽的电化学窗口(>5 V,vs.Li/Li+)[20]。但是,大多数砜基电解液的黏度很高,需要与其他具有低熔点和低黏度的溶剂混合使用才能构成实际可用的电解液体系[21]。Wu等[22]结合理论量子化学计算和电化学表征,研究二甲基亚硫酸盐(DMS)、二乙基亚硫酸盐(DES)作为助溶剂在环丁砜(TMS)上的应用,讨论了助溶剂对电解液黏度和导电率的影响,结果表明,TMS/DMS和TMS/DES能有效改善电解液的电化学性能。
2.2 腈类溶剂
腈类溶剂具有较高的燃点和闪点,表现出良好的热稳定性和耐氧化能力,可以减轻电解质溶液的易燃性。乙腈作为电解液溶剂,其离子电导率较高,电压较高下具有很好的电化学稳定性,但由于其沸点较低、毒性较大,不能替代传统的电解液溶剂[23]。较短的二腈烷比较长的二腈烷有更高的电导率,因为后者的黏度更高,介电常数更低,短链烷烃二腈(如己二腈和二腈)比长链烷烃二腈(如癸二腈和亚二腈)具有更高的容量,而长链烷烃二腈和亚二腈具有类似的容量衰减[24]。
然而,腈类溶剂与石墨阳极的不相容性限制了其应用,因为在低电势下腈基很容易被还原,而且还原产物不能形成稳定的界面层[25]。Zhang等[26]通过使用丁二腈(SN)和碳酸氟代亚乙酯(FEC)同时用作溶剂,调控电极/电解质界面,大大延长LiNi0.5Co0.2Mn0.3O2(NCM523)在4.7 V高电压下的循环寿命和速率性能,显著改善腈类电解液与电极的兼容性。部分腈类还可以作为电解液添加剂使用,Lee等[27]将1%(质量分数)的己二腈(C6H8N2)加入基准电解液中作为一种新型双功能添加剂,在锂负极上产生导电且坚固的界面层,同时,Ni4+与C6H8N2中的腈基之间的强配位可减少电解质与富镍正极表面之间的副反应,有效地提高锂金属负极和高镍NCM正极表面的界面稳定性,从而提升Li/全浓度梯度Li[Ni0.73Co0.10Mn0.15Al0.02]O2电池的容量保持率和倍率性能。
2.3 氟代碳酸酯
由于氟是强吸电子原子,用氟取代碳酸根和羧酸酯中的氢可以降低它们的HOMO能级,使其具有更高的抗氧化能力[28],因而氟代碳酸盐可以作为很好的高稳定性、高导电性、与石墨电极具有良好相容性的高压电解液[29]。
基于量子化学模拟,He等[30]开发了一个新的氟电解质配方,1.0 mol/LLiPF6+氟代碳酸乙烯酯(FEC)/二 (2, 2, 2-三氟乙基)碳酸酯(HFDEC)+1.0%二氟草酸硼酸锂(LiDFOB)添加剂。与非氟化电解质相比,当采用更高的截止电压(4.6 V)时,NCMC523/石墨电池在新型氟化电解质中的库仑效率和容量保持能力有了很大的提高。
Fan等[31]基于低挥发性、低可燃性的氟代碳酸酯电解质,通过向低挥发性、低可燃性的氟代碳酸酯电解质中添加含氟的非极性1,1,2,2-四氟乙基-2,2,2-三氟乙基醚(D2)与甲基九氟丁醚(M3),削弱了溶剂间相互作用力,不仅降低了电解液的可燃性,且使得LiNi0.8Co0.15Al0.05O2在-95~+70℃之间获得>99.9%的库仑效率。
新型溶剂的出现为NCM向更高压发展提供了广阔空间。
3 锂盐
目前商业上最成功的锂盐是LiPF6,因为它均衡了各项性能,如良好的解离度、溶解性、离子电导率以及能够钝化铝箔等。但它在痕量水存在的情况下会与水反应生成HF侵蚀正极,此外它在80℃即发生分解[32]。LiPF6较差的化学稳定性和热稳定性限制了其在高电压三元锂离子电池中的应用,故对于新的替代锂盐的寻找从未停止。其中被深入研究的有双草酸硼酸锂(LiBOB),二氟草酸硼酸锂(LiDFOB),双氟磺酰亚胺锂(LiFSI)及双三氟甲烷磺酰亚胺锂(LiTFSI)等[33-35]。但在实际应用中,除了成本限制,这些锂盐都有各自的局限性,如LiBOB和LiDFOB较差的溶解性,LiFSI和LiTFSI较差的纯度和在高压下(4.0 V,vs.Li+/Li)对铝箔严重腐蚀等等,所以一般作为添加剂(第4部分介绍)或将几种盐混合使用[36]。
3.1 混合锂盐
对于高电压体系,混盐的优势在于其改善了高电压下电池的电化学性能,提供了新型锂盐如LiTFSI在高电压下使用的可能性,提升了LiPF6在高电压下的稳定性。
在性能提升方面,Weber等[37]将双盐电解液LiDFOB/LiBF4(FEC/DEC)用于NCM523/Cu无负极软包中,在4.5 V下充放电90次后的剩余容量为80%,这是迄今为止报道的最长寿命负极无锂源的电池(图2)。NMR表征说明LiDFOB和LiBF4不断分解限制了电池寿命,可通过增加电解液含量和锂盐浓度,或将不分解与分解的锂盐混合进一步提升寿命。
LiTFSI和LiFSI的电导率和LiPF6相当且稳定性更好,将两者与LiPF6或LiDFOB共混,可以防止其在高电压下对铝箔的腐蚀,使其能够应用于高电压体系。Xia等[38]通过比较不同摩尔比的LiFSI和LiPF6(总盐含量为1.2 mol/L)在EC/EMC(体积比3:7)的铝腐蚀行为(图3),表明LiFSI-LiPF6双盐电解液的LiFSI浓度低于0.3 M时,不仅在4.3 V(vs.Li+/Li)下钝化铝箔,还改善了循环性能。0.2 mol/L LiFSI+1.0 mol/L LiPF6用于人造石墨/NCM111软包,在1 C倍率下循环360次后容量仍保持93.9%。
相比于LiPF6,LiBF4的热稳定性和耐水解性更好,且在高电压下与正极良好兼容。Ellis等[39]将二者共混用于4.35 V的NMC442/石墨软包中,指出LiPF6/LiBF4在1∶1时电池循环600圈后容量衰减最小,这归因于二者的协同作用即LiBF4减小了正极的阻抗而LiPF6改善了负极的成膜特性。
但是目前对混盐电解质的研究大多依据性能评价,对其在界面组分和界面反应过程中的内部协同作用缺乏进一步的阐述,需要通过原位的表征手段和理论计算进一步揭示锂盐混合后在正负极/电解液界面反应行为及生成的物质。
3.2 高浓锂盐
提高锂盐浓度会增强正负离子与溶剂分子的相互作用,当锂离子浓度达到一定程度时(一般3~5 mol/L),自由溶剂分子消失,与Li+配位的溶剂分子显示出更低的HOMO能级因此有更强的氧化稳定性[40-41];其次,由于没有多余的自由溶剂分子能与金属离子配位,且增强的3D溶剂网络[42]进一步阻止了金属溶解,故高浓电解液提升了正极材料在高电压下的稳定性且阻止了铝箔的腐蚀[43]。Fan等[44]将10 mol/L LiTFSI溶于EC/DMC中,NCM622/Li电池在4.6 V和2.5 mA.h/cm2的高负载时,100次循环后容量保持率86%。XPS表明来自阴离子的富氟CEI包括LiF、CFx和SF,形成致密的正极界面,抑制了正极与电解质之间的副反应。
醚类溶剂由于容易被氧化难以被应用到高电压,但是通过高浓加混盐的策略逆转了这一情况[45]。Alvarado 等[46]将 4.6 mol/L LiFSI+2.3 mol/L LiTFSI溶于DME,由于两种阴离子(TFSI和FSI)的共存通过优先分解机制引入了全新的界面相,这一电解液在4.4 V NCM622/Li电池中经过300次循环后容量保持率超过88%,在4.4 V NCM622/Cu“无负极”电池中经过50个循环后容量保持率比对照组提高了30%。
高浓盐尽管有以上优势,但在实际应用中仍存在着两大制约因素:离子电导率和成本。离子电导率随着浓度的增大存在一个最大值,一般在有机碳酸酯溶剂中这个值是1 mol/L[47]。浓度过高导致电解液黏度增大不仅降低离子电导率,还使得电极润湿性能下降,所以需要采用容易解离的锂盐如LiFSI和低黏度的溶剂提升电导率,或者采用局部高浓的策略[48]。因为锂盐的价格是碳酸酯类溶剂的十多倍[40],所以锂盐用量增大必然增加成本,给企业造成一定的经济负担。相比之下,低浓度的混盐是更加利于工业化的策略。
4 高电压电解液添加剂
除了溶剂和锂盐,添加剂也是电解液中的一个重要组成部分,相比于重新寻找一个新的溶剂和锂盐匹配体系,在现有的电解液基础上加入少量的(一般0.1%~5.0%质量或体积分数)添加剂就可以提升电池某一方面的性能,这是最经济有效且最容易实现工业化的方式。针对高电压的应用场景,需要HOMO能级较高的成膜添加剂对NCM正极材料起到保护作用。
4.1 单一添加剂
表1列举了近年来提出的用于高电压NCM电池的添加剂。这些添加剂含有不饱和键、C2O42-、Si—O等活性功能基团,容易被氧化还原且具有良好的成膜性能[49]。
LiBOB的分解电压较低(4.2 V)[35],Li等[50]在基础电解液中添加了1.5%的LiBOB,用TOF-SIMS表征了高镍正极LiNi0.94Co0.06O2表面富含BxOy的稳定CEI,将全电池在4.4 V(vs.Li+/Li)下循环500圈的容量保持率从61%提升至80%。但是LiBOB成膜阻抗较大,相比之下,LiDFOB的阻抗更小而受到了广泛的关注[51]。Shkrob等[52]使用电子顺磁共振(EPR)光谱提出了LiBOB和LiDFOB的成膜机理(图4),表明阴离子的氧化脱离CO2并形成稳定的酰基自由基,自由基在氧化物-电解质界面处的重组产生二氟硼烷二聚体,该二氟硼烷二聚体(为强路易斯酸)与表面的氧形成强B—O键,从而使电极钝化并防止电解质氧化。
Ma等[53]提出和甲基二磺酸亚甲酯(MMDS)类似结构的新型添加剂1,2,6-二氧杂噻吩2,2,6,6-四氧化物(ODTO)用于4.3 V的AG/NCM523软包,并与VC、FEC、LiPO2F2作比较,实验表明3%DOTO具有最优的库仑效率和循环稳定性,未包覆的正极经过1300次循环后仍有91.3%的容量。进一步的结论指出,有效添加剂存在下包覆并非是必须的。
4.2 复合添加剂
在实际应用过程中,单一添加剂往往只具有某一方面的优势,所以需要多种添加剂之间的协同作用来提升高电压下电池的整体性能。在这方面Dahn等[54-57]做了一系列的工作,他们通过比较4.2~4.7 V下的阻抗及循环稳定性,提出2%PES+1%TTSPi+1%MMDS(质量分数)即“PES-211”适用于4.4V的石墨/LiNi0.4Co0.4Mn0.2O2(NCM442)软包电池。然而进一步的研究发现PES-211并不适用于高镍LiNi0.8Co0.1Mn0.1O2(NCM811)正极[54],说明添加剂与正极表面存在复杂的相互作用,添加剂的选择要考虑不同的正极体系。添加剂还使无EC的线性碳酸酯溶剂用于高电压三元锂离子电池成为可能[57]。
除了界面成膜性能,Qian等[58]指出添加剂还可以抑制电解质溶剂之间的酯交换反应,从而维持电解液本身的结构。此外,Ming等[59]提出石墨负极稳定性提升并非得益于加入添加剂后表面形成的稳定SEI,而是强配位添加剂的加入削弱了Li+-溶剂的相互作用,有利于Li+脱嵌并阻止Li+-溶剂的共嵌入,这对添加剂进一步研究提供了新的方向。对于高电压NCM添加剂,关键在于能否在正极表面形成一层稳定的CEI,阻止界面副反应。目前添加剂的发展正朝着多元以及有机-无机结合的方向迈进。
5 混合及全固态电解质
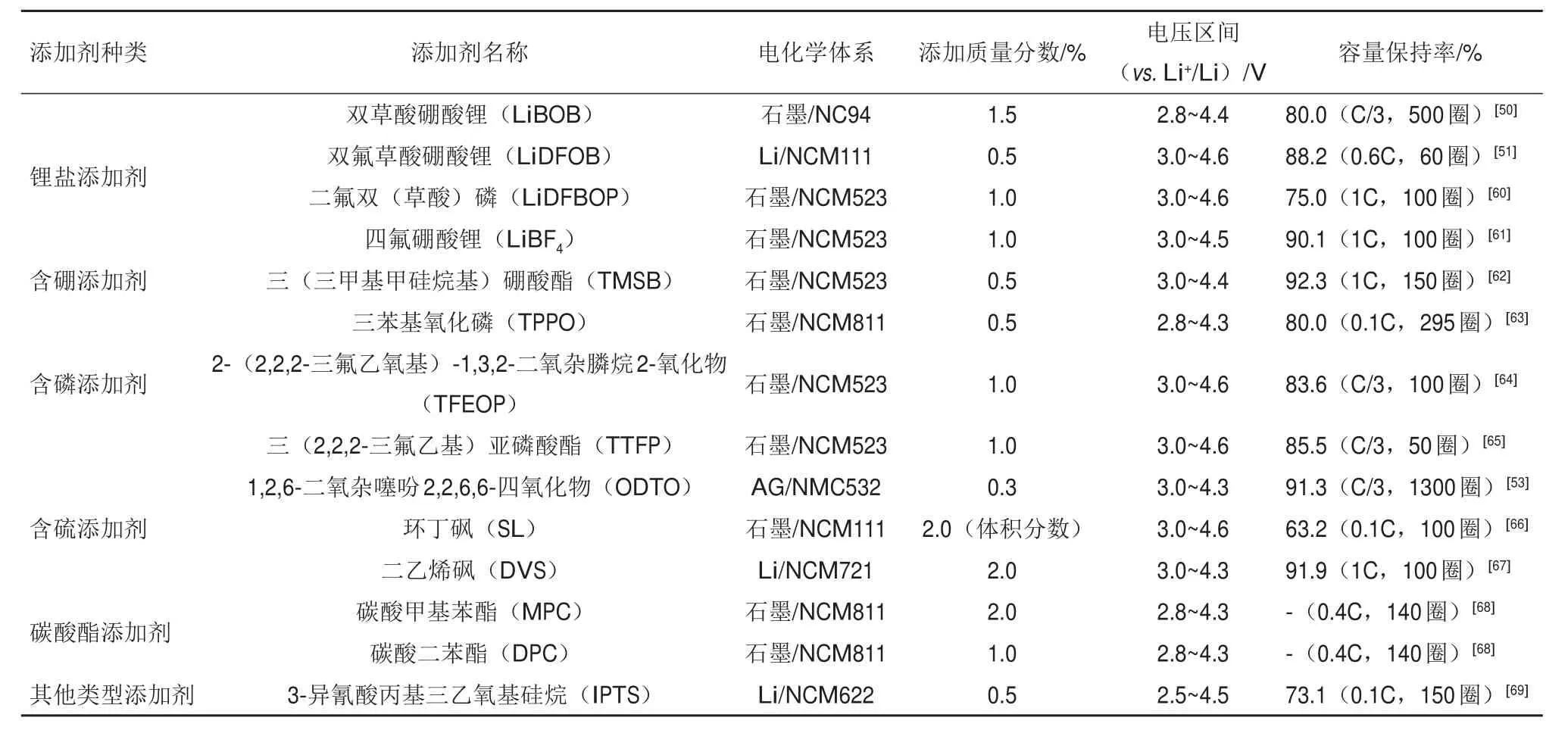
表1 用于高电压NCM电池的添加剂Table 1 Additives for high voltage NCM batteries
液态电解液采用的是易燃的有机溶剂,电池内部温度升高时,电解液与电极间副反应加剧,易热失控,存在安全隐患[70]。固态电解质的使用消除了对电解液的需求,简化了电池设计,且不挥发,可在宽的温度范围内保持稳定,提高了安全性和耐用性[71]。在找寻到合适材料前提下,采用全固态电解质被认为是平衡高压NCM正极锂离子电池电化学性能和安全性的选择[72-73]。全固态电解质包括固态聚合物、无机及其复合电解质,但存在严重的界面问题:固相接触界面阻抗较大,离子电导率低;电解质与电极间的界面反应影响电化学稳定性;充放电过程中,电极材料晶格发生各向异性变化,与电解质间界面应力增大,接触变差。以上问题严重阻碍全固态电解质在NCM正极锂离子电池中的实际应用。通过将固态聚合物、无机及液态电解质的优点结合起来,开发混合固态电解质(Hybrid solidstate electrolytes,HSSEs)被认为是开发高性能电解质的可行方法[70,74-75]。
HSSEs由两种或多种不同组分组成,如两种离子导体复合材料或具有导离子功能的结构组合,前者一般是固态聚合物和无机电解质复合体,后者通常是液态电解液分布于多孔介质中或在电极与固态电解质界面加入液态电解液,形成固液混合电解质[76-77]。固液混合电解质中液态一般为含锂盐(LiPF6、LiCF3SO3、LiTFSi等)的有机溶剂(EC、DEC、EMC等)[78],固态一般为聚合物(PEO、PVDF等)或无机陶瓷材料(ZrO、LiSICON-型Li1.5Al0.5Ge1.5(PO4)3等)[79]。出于实际应用考虑,目前固液混合电解质使用广泛,其中,凝胶聚合物电解质已经商业化,但全固态电解质依旧是未来的主要研究方向。
5.1 凝胶聚合物电解质
凝胶聚合物电解质(gel polymer electrolytes,GPEs)以聚合物为骨架,碱金属盐和有机增塑剂形成电解液均匀分布在骨架中[80]。常用的基体有:聚丙烯腈(PAN)、聚氧化乙烯(PEO)、聚甲基丙烯酸甲酯(PMMA)和聚偏氟乙烯(PVDF)等。GPEs中的电解液起到离子传导及在电极表面形成稳定固体电解质膜的作用,其电导率在室温下一般可达10-3S·cm-1以上[81],与有机溶剂的种类相关,常用的增塑剂有EC、PC等。Cui等[73]报道了聚对苯二甲酸乙二酯无纺织物与聚乙基α-氰基丙烯酸酯组成的复合膜作体基质的GPEs。基于该复合膜的添加1 mol/L LiPF6碳酸盐溶剂的电解质,室温下电导率为2.54 mS·cm-1,稳定的电化学电压窗口可达4.7 V。将其用于石墨/NCM523全电池,与液态电解液相比,在3.0~4.6 V电压内,容量保持率从20%增加到77%。
GPEs的机械稳定性和热稳定性优于液态电解液,但氧化电压较低,可应用的种类有限,提高其抗氧化功能的策略有:寻找低HOMO能级的极性基团,进行聚合物分子设计[82];利用聚合物与锂盐分子间相互作用降低电解质的HOMO[83-84]等。
5.2 全固态电解质
5.2.1 固态聚合物电解质
作为能有效溶解锂盐的聚合键,寡醚(-CH2-CH2-O-)n是自Wright等发现以来固态聚合物电解质(solid polymer electrolytes,SPEs)的主要结构单元[85]。除了Tominaga等[86-89]开发的聚碳酸酯,大部分SPEs工作仍集中在改变聚醚结构。SPEs所面临的最严峻挑战仍是低离子电导率、电极与电解质之间的界面接触及电化学稳定窗口。改进措施主要有使用新的锂盐和阴离子受体,通过共聚和接枝修饰聚合物结构及与无机陶瓷形成复合材料。Archer等[90]报道铝离子在电化学电池中引发分子醚的开环聚合以产生SPEs,该电解质与电池组分保持共形界面接触,在室温下表现出高离子电导率(>1 mS·cm-1),界面电阻低,在Li/NCM622全电池中应用表明,采用原位SPEs设计可实现高库仑效率(>99%)和长电池寿命(>700圈循环)。
5.2.2 固态无机电解质
固态无机电解质具有较高安全性和较宽电化学窗口,可保证高压下NCM正极锂电池的高安全性和高能量密度[91],其包括氧化物,如钙钛矿Li3yLa2/3-yTiO3(LLTO)[92], 石榴石Li7La3Zr2O12(LLZO)[93]和LiSICON型磷酸盐[92],及硫化物,如Li10GeP2S12(LGPS)和硫代-LiSICON[94-95],其中,硫化物室温电导率最高 (10-3~10-2S·cm-1)[94-95]。Kato 等[95]报道将 80Li2S·19P2S5·1P2O5(摩尔分数)固态电解质用于NCM111正极锂离子电池,首圈放电容量为115 mA·h·g-1,在2.5~4.4 V电压下,循环10次,保持了110 mA·h·g-1的可逆容量。但由化学电位差引起的氧化物正极与硫化物电解质间的空间电荷层阻碍锂离子在其界面间传输,大电流密度下电池极化严重,容量衰减快[6]。Hirokazu等[96]用Li4Ti5O12包覆NCM111,有效降低界面阻抗,改善电化学性能。
固态电解质的使用抑制了电解液的腐蚀效应及金属溶解,但不能抑制正极材料相变,高压下与NCM材料的界面问题严重,降低电池能量密度。SPEs可通过弹性和塑性变形补偿电极体积变化,与正极界面相容性优于固态无机电解质,且后者加工性能差,成本高,故SPEs在固态电池的商业化中更具吸引力。但SPEs离子电导率低,电池在室温下无法工作,即使在电动汽车要求的80℃以上的工作温度下[97],其锂离子电导速率仍有限,不能用于快充[98]。因此,寻找在环境温度下具有足够离子电导速率的稳定聚合物电解质是未来几年锂离子电池面临的挑战之一[97]。
GPEs与SPEs统称聚合物电解质,Chen和Cui等[99-107]通过设计聚合物的化学结构及调优聚合物和锂盐或添加剂的分子间相互作用,探讨了一系列具有宽电化学窗口的聚合物电解质,应用于高压三元正极材料锂离子电池,总结于图6[6],为研究者提供了重要参考。
6 离子液体
离子液体(Ionic liquids,ILs)不易挥发,不易燃,具有较宽的电化学窗口,良好的导电性,热稳定性好。ILs的加入改善了锂离子电池的热稳定性和电化学性能,作为电解质可分为单一ILs、ILs-有机溶剂、ILs基凝胶电解质等[108-109]。然而,ILs黏度较高、电化学稳定性差、与石墨电极匹配性差、价格较高,与常用的有机碳酸盐溶剂相比,多数使用ILs的电池显示出较差的倍率性能,目前只有少数ILs被用作三元正极材料锂离子电池电解液的溶剂或添加剂。Martin Winter等[110]设计了两种含氟环磷(III)基化合物,即2-(2,2,3,3,3-五氟丙氧基)-1,3,2-二氧磷杂环烷[2-(2,2,3,3,3-pentafluoropropoxy)-1, 3, 2-dioxaphospholane,PFPOEPi]和2-(2,2,3,3,3-五氟丙氧基)-4-(三氟甲基)-1,3,2-二氧磷杂环烷(2-(2,2,3,3,3-pentafluoro-propoxy)-4-(trifluormethyl)-1,3,2-dioxaphospholane,PFPOEPi-1CF3),如图7所示。分别用于1mol/L LiPF6(EC/EMC体积比为1/1)电解液中作添加剂,添加0.5%(质量分数)PFPOEPi和PFPOEPi-1CF3的石墨/NCM111全电池在4.5V截止电压下循环100圈,展示出88.3%和90.6%的容量保持率,优于不含添加剂的83.9%。
ILs电解质在锂离子电池中用于商业化的前提是提高锂离子在其中的迁移速率,故关键在于降低其黏度,使用具有不对称结构的ILs可降低其黏度。同时,将ILs与碳酸酯、聚合物或无机陶瓷混合,形成的三类电解质也取得较好进展,有助于其在锂离子电池中的实际应用。
7 结语
为了解决电动汽车的里程焦虑,实现正极材料800W·h·kg-1的能量密度,提高三元NCM的工作电压是一条必经之路。就电解质而言,目前,商用NCM动力电池的电解液仍然由1 mol/L或1.2 mol/L LiPF6溶于EC加线性碳酸酯溶剂并配以添加剂组成。这是因为LiPF6综合性能优越,1 mol/L下其离子电导率最高,EC的存在保证了石墨的稳定成膜。一旦电压提高,这个体系将不再稳定,这就制约了NCM锂离子电池向高电压发展。本文从溶剂、锂盐、添加剂、固态电解质、离子液体分别总结了改进方案,为解决高电压电解液问题提供参考。
溶剂方面,砜类和腈类溶剂与石墨负极的兼容性差,暂时不太可能完全取代碳酸酯类溶剂。相比之下将碳酸酯氟代对于高电压下电解液的整体性能发挥更加有利。但是氟代溶剂溶解锂盐的能力有限,需配以易于解离的锂盐或可作为共溶剂使用。锂盐方面,因为综合性能优越,LiPF6的地位暂时难以撼动。LiTFSI和LiFSI若能解决纯度和腐蚀的问题将具有很大的竞争力。而高浓锂盐由于成本的限制工业化的可能性不大。所以对于LiPF6的稳定性问题,锂盐混合或许是目前更加合适的方式。添加剂方面,为了达到整体优化性能,添加剂势必向复合发展。研究添加剂的作用机理,从结构方面进行优选组合将事半功倍并使添加剂的功能得到最大程度的发挥。溶剂、锂盐、添加剂三者之间相互关联,如何组合调控实现高电压稳定性将是研究人员值得思考的问题。
为了实现高电压下电池的安全性能,固态电解质是公认的解决方式,但是全固态电解质由于界面、离子电导、电化学窗口等诸多问题暂时难以实现,所以目前仍以固液混合为主。相比于氧化物、硫化物、聚合物等单一组分,无机固态电解质主体加上有机聚合物电解质界面可以兼顾高电导率和界面接触,是实现全固态的一种方式。
相信在科研工作者的不断努力下,电解质将不断拓宽电化学窗口,同时具备良好的正负极兼容性,实现高电压NCM锂离子电池在电动汽车中的应用。
