气调醇化过程中片烟细菌群落结构的变化
2020-03-30陈善义范坚强李菁菁何伟颜奕华陈义强林俭包可翔张瑞强
陈善义 范坚强 李菁菁 何伟 颜奕华 陈义强 林俭 包可翔 张瑞强
摘 要:氣调醇化是片烟醇化的一种方法。微生物尤其是细菌在片烟醇化过程中对烟叶的吸食品质起着至关重要的作用。为研究气调醇化过程中片烟细菌群落结构变化规律,利用Illumina MiSeq测序平台比较气调防霉杀虫阶段(S1)、气调醇化阶段(S2)及气调保质阶段(S3)共36份样品的细菌16S rDNA序列的多样性。结果表明,从S1到S3的过程中,片烟中细菌的物种丰富度和多样性水平呈增加趋势。S1阶段片烟的优势种群为鞘氨醇单胞菌属、假单胞菌属和甲基杆菌属,其占比在整个气调醇化过程中呈逐渐下降趋势;S2阶段的优势种群为芽孢杆菌属、鞘氨醇单胞菌属和伯克霍尔德菌属,其中芽孢杆菌属和伯克霍尔德菌属在整个气调醇化过程中占比呈先上升后下降的趋势;S3阶段细菌种群分布较为均匀。非度量多维尺度分析结果表明,3个醇化阶段的样品可以较明显地区分开来。可见,气调醇化过程中片烟的细菌种群组成非常丰富,不同醇化阶段活跃的微生物类群有所不同,鞘氨醇单胞菌属、假单胞菌属和甲基杆菌属主要在醇化前期参与了烟叶醇化过程,而芽孢杆菌属和伯克霍尔德菌属则主要在醇化后期发挥着微生物醇化的作用。
关键词:片烟;气调醇化;16S rDNA;微生物区系
Alteration of Bacterial Community Structures of Tobacco Strips During Controlled Atmosphere Aging
CHEN Shanyi1, FAN Jianqiang1*, LI Jingjing1*, HE Wei1, YAN Yihua1, CHEN Yiqiang1,
LIN Jian1, BAO Kexiang1, ZHANG Ruiqiang2
(1. Technology Centre, China Tobacco Fujian Industrial Co., Ltd., Xiamen 361021, China; 2. Xiamen Tobacco Industrial Co., Ltd., Xiamen 361022, China)
Abstract: Controlled atmosphere aging (CAA) is a method of tobacco strips aging. Microorganisms, especially bacteria, play an important role in smoking quality of tobacco during the aging process. In order to study the alteration of bacterial community structure in tobacco strips during the process of CAA, the diversity of bacterial 16S rDNA sequences were carried out. 36 samples were compared by using Illumina MiSeq sequencing platform in three stages including the mildew and insect control stage(S1), the aging stage (S2) and the quality guarantee stage(S3) . The results showed that the species richness and diversity of bacteria in tobacco strips increased from S1 to S3. The dominant populations of tobacco strips in S1 wereSphingomonas,PseudomonasandMethylobacterium, with a proportion of which gradually decreased during the whole process of CAA. The dominant populations in S2 wereBacillus,BurkholderiaandSphingomonas, with a proportion ofBacillusandBurkholderiaincreased first and then decreased in the whole process. The distribution of bacteria population in S3 was more uniform. Nonmetric multidimensional scaling analysis showed that the samples of three aging stages could be distinguished clearly. It was clear that the tobacco strips in CAA process harbored abundant levels of bacteria, and the active microbial groups were different in different aging stages.Sphingomonas,PseudomonasandMethylbacteriumwere mainly involved in the early process, whileBacillusandBurkholderiamainly played an important role in the later process.
Keywords: tobacco strips; controlled atmosphere aging; 16S rDNA; microbiota
片烟醇化是卷烟生产上提高烟叶吸食品质的必经环节。未经醇化的烟叶存在杂气重,吸味辛辣、烟气不够细腻、刺激性大等缺陷,需通过醇化以促使烟叶中对感官吸食品质不利的化学成分充分转化,达到吸味醇和的目的[1]。气调醇化法是片烟醇化的一种方法,其主要通过依次在气调防霉杀虫阶段、气调醇化阶段和气调保质阶段控制不同的氧气浓度、温湿度,实现片烟的防霉、杀虫、醇化及延长片烟适宜使用期的目的[2]。气调醇化法相对于自然醇化法具有对环境友好(无需磷化铝熏蒸)、醇化周期易于调控、醇化质量最佳状态保持时间较长等优势[3],在片烟的仓储养护上得以逐步推广和应用。
烟叶醇化过程主要包括化学变化、酶催化和微生物作用3个方面。微生物尤其是细菌,在片烟醇化过程中对烟叶的吸食品质起着至关重要的作用[4-5]。有关烟叶醇化过程中细菌区系变化的研究主要集中在自然醇化法[6-10],对于气调醇化法鲜有报道。本课题组分析了云南沾益、贵州长顺、福建尤溪、河南确山4个产地的片烟在自然醇化过程中细菌菌群的多样性[10],然而对于气调醇化过程中片烟菌群的动态变化尚不明确。为此,以上述产地的片烟为材料,在自然醇化3个月的基础上,依次加以气调防霉杀虫、气调醇化及气调保质处理并在各处理阶段末尾取样,利用Illumina MiSeq测序平台比较气调醇化过程中不同醇化阶段片烟细菌16S rDNA序列的多样性,明确细菌群落结构的变化规律,旨在为有益微生物的挖掘和气调醇化技术的改进提供依据。
1 材料与方法
1.1 试验材料
试验样品为2014年生产的片烟,产地为云南沾益(品种为云烟87)、贵州长顺(品种为云烟87)、福建尤溪(品种为CB-1)、河南确山(品种为云烟87),部位包含上部、中部、下部。片烟于厦门东孚烟叶仓库采用气调醇化法进行醇化。醇化过程分气调防霉杀虫(于氧气浓度为2%的密封条件下保持3个月,代号S1)、气调醇化(于氧气浓度为8%的密封条件下保持6个月,代号S2)及气调保质(于氧气浓度为2%的密封条件下保持6个月,代号S3)3个阶段。试验于2015年5月至2016年8月期间进行,于每个醇化阶段结束后进行取样。采用5点取样法进行取样,具体参照包可翔等[10]的研究。整个试验过程取样36份(表1)。
1.2 方法
1.2.1 基因组DNA提取和PCR扩增 样品基因组DNA的提取和PCR扩增方法参照包可翔等[10]的研究。扩增产物经2%琼脂糖凝胶电泳分离后,切胶回收目标片段,用AxyPrep DNA Gel Extraction Kit(美国Axygen公司,AP–GX–250)进行目标片段的纯化,然后用Quant-iT PicoGreen dsDNA Assay Kit试剂盒(美国Invitrogen公司,P7589)和FLx800荧光酶标仪(美国BioTek公司)对扩增子进行定量,均一化后混匀。
1.2.2 MiSeq测序 使用TruSeq Nano DNA LT Library Prep Kit试剂盒(美国Illumina公司,FC-121-4003)对混匀后的扩增子进行文库构建。并利用Illumina MiSeq高通量测序平台(上海派森诺生物科技股份有限公司)进行细菌16S rDNA测序。
1.2.3 数据处理与分析 使用Qiime 1.9.0软件[11]和Mothur 1.31.2软件[12]对测序所得的原始序列进行过滤、嵌合体去除,获得优质序列。将获得的优质reads以97%為划定阀值进行操作分类单元(Operational taxonomic unit, OTU)聚类,并利用Greengenes数据库(http://greengenes.secondgenome. com/)[13]进行注释。剔除宿主叶绿体和线粒体序列后,统计各样品细菌群落门、属所占比例,最后利用Excel 2007软件进行不同醇化阶段样品OTU的韦恩图分析。基于OTU聚类结果,利用Mothur 1.31.2软件对36份样品的细菌群落进行α多样性指数分析、样品间非度量多维尺度(Nonmetric Multidimensional Scaling, NMDS)分析及基于主要属所占比例的样品聚类热图分析。Chao指数为估算样品中微生物丰富度的指数[14],Shannon指数为估算样品中微生物多样性的指数[15]。
某菌群所占比例(某菌群reads数/样品总reads数)×100%。
2 结 果
2.1 测序结果及α多样性分析
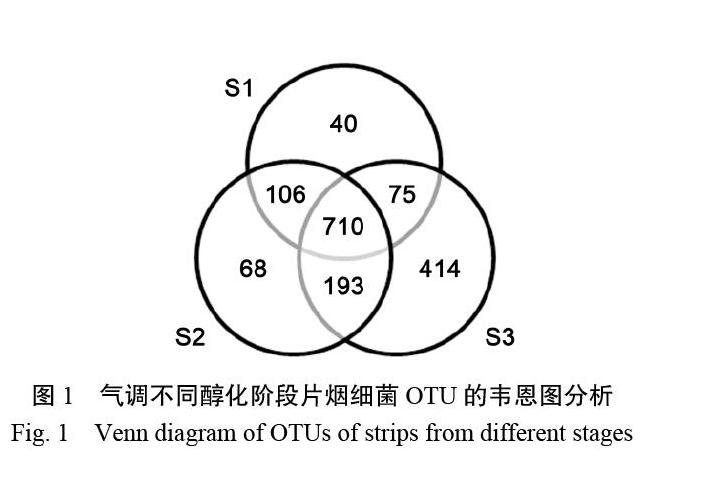
36份片烟样品平均获得64 440条有效reads,去除低质量reads后平均获得60 937条优质reads,优质reads占有效reads数的94.56%。这些reads归属于1606个OTUs(包括36份样品共有和特有OTUs)。其中,710个OTUs为3个醇化阶段所共有,占总OTU个数的44.21%;S1、S2、S3阶段特有的OTU个数分别为40、68、414,分别占总OTU个数的2.49%、4.23%、25.78%(图1)。
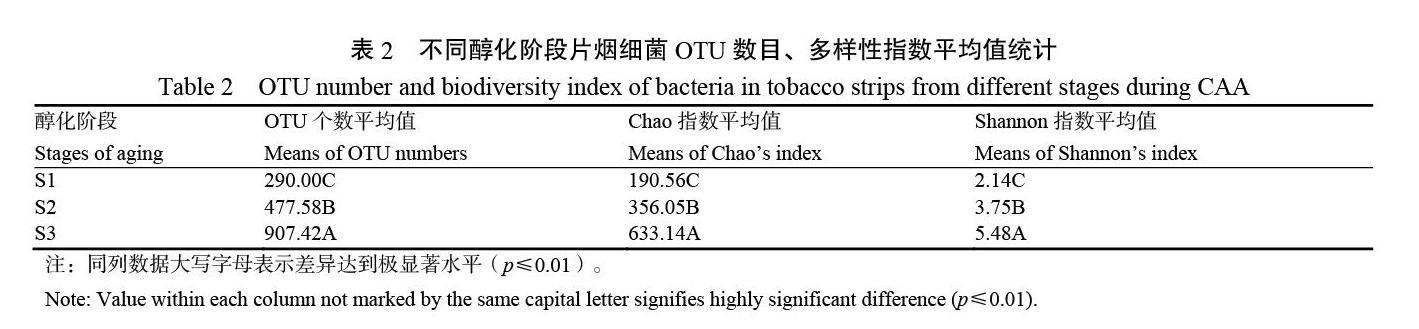
随着气调醇化过程的进行,12个等级的片烟中细菌的平均OTU个数、Chao值指数表现增加的趋势,表明细菌的物种丰富度增加;Shannon指数值也呈上升趋势,说明细菌的多样性随着气调醇化的进行而增加(表2)。S1、S2、S3阶段两两之间的细菌物种丰富度和多样性水平差异均达到极显著水平。气调醇化过程完成之后(S3),物种丰富度、多样性指数平均值比气调防霉杀虫阶段(S1)分别上升了232.25%和156.07%。
2.2 门水平细菌群落结构变化分析
从各门的占比平均值方面来说(图2),气调醇化过程中片烟的细菌以变形菌门(Proteobacteria,平均占比43.20%~72.43%)、厚壁菌门(Firmicutes,平均占比11.49%~37.63%)为主,且变形菌门为优势菌门。随着气调醇化过程的进行,变形菌门占比从S1阶段的72.43%逐渐下降至S3阶段的43.20%,而厚壁菌门占比则从S1阶段的11.49%逐渐上升至S3阶段的37.63%;S1、S2阶段的变形菌门平均占比差异显著,厚壁菌门平均占比差异极显著;而S2、S3阶段的变形菌门和厚壁菌门平均占比差异均不显著(表3)。
2.3 属水平细菌群落结构变化分析
由图3可知,在能鉴定至属水平的菌属中,片烟气调醇化过程中平均占比≥2%的细菌种群为鞘氨醇单胞菌属(Sphingomonas)、假单胞菌属(Pseudomonas)、甲基杆菌属(Methylobacterium)、红球菌属(Rhodococcus)、芽孢杆菌属(Bacillus)、不动杆菌属(Acinetobacter)、链球菌属(Streptococcus)、伯克霍尔德菌属(Burkholderia)、乳球菌属(Lactococcus)、李斯特菌属(Listeria)、枝芽孢杆菌属(Virgibacillus)、劳尔氏菌属(Ralstonia)、乳酸菌属(Lactobacillus)、苍白杆菌属(Ochrobactrum)、颤螺菌属(Oscillospira)共15个菌属。此外,S1、S2、S3阶段分别有占比为38.08%、30.16%、42.48%的OTU无法鉴定至属水平,表明气调醇化过程中的片烟含有大量的未知细菌。
气调醇化过程中细菌的群落结构变化较大。在能鉴定至属水平的菌属中,S1阶段的细菌以鞘氨醇单胞菌属、假单胞菌属和甲基杆菌属为相对的优势菌群(平均占比≥7%),S2阶段则以芽孢杆菌属、鞘氨醇单胞菌属和伯克霍尔德菌属为优势菌群(平均占比≥7%),而S3阶段的主要菌属占比差异较小(2.11%~5.76%),细菌种群分布相对前2个阶段而言较为均匀(图3)。在能鉴定至属水平的菌属中,共有7个菌属在气调醇化过程中(S1至S3阶段)占比发生了较大的变化。鞘氨醇单胞菌属、假单胞菌属、甲基杆菌属在样品中的平均占比表现出逐渐下降的趋势;芽孢杆菌属、伯克霍尔德菌属则呈现先上升后下降的趋势;乳酸菌属、乳球菌属总体上表现出上升的趋势(表4)。
2.4 不同醇化阶段样品间的NMDS分析及聚类分析
NMDS分析可通过样本在低维空间中的排序情况来描述样品间的距离远近关系,以考察不同样品之间微生物群落结构的相似性。由图4可知,总体上,3个醇化阶段的样品能明显地区分开;S1、S2阶段的样品在NMDS二维图上距离相对较近,而S3阶段的样品与S1、S2阶段的样品距离相对较远。这说明气调保质处理6个月后的片烟其细菌群落结构较前2个阶段发生了明显的变化。
热图(Heatmap)分析进一步说明了36份样品细菌群落结构分组情况。由图5可知,S1、S2阶段大多数样品(各10个,图中蓝色虚框标注)形成一个小的分枝,S3阶段的7个样品(图中红色虚框标注)形成另一小分枝;此外S3阶段的3个样品(图中黑色虚框标注)形成一个独立的分枝。这说明S1、S2阶段的样品细菌群落结构比较相似,S3阶段的样品与S1、S2阶段样品的细菌群落结构差异较大,这与NMDS的分析结果相一致。
3 讨 论
利用MiSeq高通量测序技术对气调醇化过程中片烟的细菌进行16S rDNA多样性分析,获得了不同醇化阶段细菌区系的变化规律。陈竹亭等[7]对福建产地的上、中、下部自然醇化片烟的细菌多样性研究表明,整个24个月的醇化过程中细菌的种类数有不明显的减少。本研究發现,从S1到S3阶段,细菌的OTU数目呈增加趋势。造成这种差异的可能原因有以下2个方面:①气调醇化法氧气浓度较低,造成厌氧和兼性厌氧细菌得以大量繁殖;②测序方法不同。陈竹亭等[7]的研究采用的是16S rDNA克隆文库法,而本研究采用的是MiSeq高通量测序法,该方法能够涵盖更多序列,灵敏度更高。本研究中,气调醇化过程中片烟表面的细菌在门分类水平上以变形菌门、厚壁菌门为主,这与龚俊[9]对自然醇化烤烟的微生物区系的研究结果一致。本研究发现,随着气调醇化的进行,变形菌门的占比下降,厚壁菌门的占比上升,可能原因是厚壁菌门的大多数能产生芽孢,更能适应不利的环境而得到富集。
在属分类水平上,从S1阶段到S3阶段,有30.16%~42.48%的OTU无法鉴定至属水平,表明醇化过程中的片烟含有大量的未知细菌,这与龚俊[9]的研究结果一致。本研究发现,鞘氨醇单胞菌属、假单胞菌属、甲基杆菌属、芽孢杆菌属、伯克霍尔德菌属、乳酸菌属、乳球菌属7个菌属在气调醇化过程中占比发生了较大的变化,它们当中的某些属在气调醇化过程中对烟叶的醇化质量可能起着重要的作用。研究表明鞘氨醇单胞菌属、假单胞菌属能降解烟叶中的烟碱[16-18]。芽孢杆菌属能降解烟叶中的蛋白质[19-21]、β胡萝卜素[21]、淀粉[21-22]、纤维素[20-21,23]、果胶[20,24]、TSNAs[25]、木质素[26]等物质,生成对提升感官质量有利的小分子物质。S1阶段以鞘氨醇单胞菌属、假单胞菌属和甲基杆菌属为优势菌属,S2阶段则以芽孢杆菌属、鞘氨醇单胞菌属和伯克霍尔德菌属为优势菌属。因此,鞘氨醇单胞菌属、假单胞菌属和甲基杆菌属可能主要在醇化前期参与了烟叶醇化过程,而芽孢杆菌属和伯克霍尔德菌属则可能主要在醇化后期发挥作用。甲基杆菌属、伯克霍尔德菌属、乳酸菌属、乳球菌属在片烟气调醇化过程中起的作用有待于进一步的研究。本研究结果有助于揭示片烟气调醇化的微生物作用机理,挖掘气调醇化过程中的有益微生物并改进气调醇化技术。
4 结 论
研究結果表明,片烟在气调醇化过程中,细菌群落结构发生了较大的变化,细菌的物种丰富度和多样性水平呈增加之势。在门分类水平上,变形菌门、厚壁菌门为优势菌门,在气调醇化过程中占比分别呈下降、上升的趋势。在属分类水平上,气调醇化过程中活跃的细菌主要为鞘氨醇单胞菌属、假单胞菌属、甲基杆菌属、芽孢杆菌属和伯克霍尔德菌属;鞘氨醇单胞菌属、假单胞菌属和甲基杆菌属主要在醇化前期参与了烟叶醇化过程,而芽孢杆菌属和伯克霍尔德菌属则主要在醇化后期发挥着微生物醇化的作用。
参考文献
- 王永红,赵敏,潘广乐,等. 仓储方式对复烤烟叶醇化品质及表面细菌多样性的影响[J]. 烟草科技,2018,51(11):36-42.
WANG Y H, ZHAO M, PAN G L, et al. Effects of storage methods on aging and bacterial diversity of redried tobacco[J]. Tobacco Science & Technology, 2018, 51(11): 36-42.
- 范坚强,陈义强,宋纪真,等. 一种四段式烟叶醇化方法:CN201210513271.8[P]. 2013-4-24.
FAN J Q, CHEN Y Q, SONG J Z, et al. Four-stages alcoholization method for tobacco: CN201210513271.8[P]. 2013-4-24.
- 杨欣玲,杨永锋,张俊岭,等. 气调贮存技术对片烟醇化质量的影响[J]. 河南农业科学,2017,46(10):153-159.
YANG X L, YANG Y F, ZHANG J L, et al. Effect of controlled atmosphere storage (CAS) technology on the alcoholization quality of flue-cured tobacco lamina[J]. Journal of Henan Agricultural Sciences, 2017, 46(10): 153-159.
- 曾晓鹰,杨金奎,段焰青,等. 烟叶生物酶活性与其等级和醇化时间的相关性[J]. 烟草科技,2009(5):48-51.
ZENG X Y, YANG J K, DUAN Y Q, et al. Enzyme activities in flue-cured tobacco and their correlations with tobacco grades and aging duration[J]. Tobacco Science & Technology, 2009(5): 48-51.
- 朱大恒,陈锐,陈再根,等. 烤烟自然醇化与人工发酵过程中微生物变化及其与酶活性关系的研究[J]. 中国烟草学报,2001,7(2):26-30.
ZHU D H,CHEN R,CHEN Z G,et al. The relationship between microorgnisms and enzyme activites in flue-cured tobacco during aging and fermentation[J]. Acta Tabacaria Sinica, 2001, 7(2): 26-30.
- ZHAO M Q, WANG B X, LI F X, et al. Analysis of bacterial communities on aging flue-cured tobacco leaves by 16S rDNA PCR-DGGE technology[J]. Applied Microbiology and Biotechnology, 2007, 73(6): 1435-1440.
- 陈竹亭,焉婷婷,汤朝起,等. 应用16S rDNA克隆文库技术分析陈化烟叶细菌多样性[J]. 中国烟草学报,2012,18(4):77-82.
CHEN Z T, YAN T T, TANG C Q, et al. Analyzing bacterial diversity in aging flue-cured tobacco leaves using 16S rDNA clone library analysis[J]. Acta Tabacaria Sinica, 2012, 18(4): 77-82.
- 伍雪莹,梁书利,韩双艳,等. 不同陈化期烤烟叶表细菌的多样性及发育分析[J]. 广东农业科学,2014,41(18):28-33,38.
WU X Y, LIANG S L, HAN S Y, et al. Diversity and phylogenetic analysis of bacterial communities on flue-cured tobacco leaves at different aged phases[J]. Guangdong Agricultural Sciences, 2014, 41(18): 28-33, 38.
- 龚俊. 烤后片烟储存过程中微生物多样性及变化动态[D]. 上海:华东师范大学,2015.
GONG J. The diversity and dynamic of microorganism on flue-cured tobacco leaves during different aged phases[D]. Shanghai: East China Normal University, 2015.
- 包可翔,林俭,何伟,等. 不同產地和部位对片烟自然醇化过程中细菌群落结构的影响[J]. 烟草科技,2017,50(4):10-17.
BAO K X, LIN J, HE W, et al. Effects of growing area and stalk position on bacterial community structure in tobacco strips during aging[J]. Tobacco Science & Technology, 2017, 50(4): 10-17.
- CAPORASO J G, KUCZYNSKI J, STOMBAUGH J, et al. QIIME allows analysis of high-throughput community sequencing data[J]. Nature Methods, 2010, 7(5): 335-336.
- SCHLOSS P D, WESTCOTT S L, RYABIN T, et al. Introducing mothur: open-source, platform- independent, community-supported software for describing and comparing microbial communities[J]. Applied and Environmental Microbiology, 2009, 75(23): 7537-7541.
- DE SANTIS T Z, HUGENHOLTZ P, LARSEN N, et al. Greengenes, a Chimera-checked 16S rRNA gene database and workbench compatible in ARB[J]. Applied and Environmental Microbiology, 2006, 72(7): 5069–5072.
- PITTA D W, PINCHAK W E, DOWD S E, et al. Rumen bacterial diversity dynamics associated with changing from bermudagrass hay to grazed winter wheat diets[J]. Microbial Ecology, 2010, 59(3): 511-522.
- CHAO A, SHEN T J. Nonparametric estimation of Shannon's index of diversity when there are unseen species in sample[J]. Environmental and Ecological Statistics, 2003, 10(4): 429-443.
- CHEN C M, LI X M, YANG J K, et al. Isolation of nicotine-degrading bacterium Pseudomonas sp. Nic22, and its potential application in tobacco processing[J]. International Biodeterioration & Biodegradation, 2008, 62(3): 226-231.
- LI H J, LI X M, DUAN Y Q, et al. Biotransformation of nicotine by microorganism: the case of Pseudomonas spp.[J]. Applied Microbiology and Biotechnology, 2010, 86(1): 11-17.
- 杨贵芹. 两株高效尼古丁降解菌的分离鉴定及其尼古丁代谢途径的分析[D]. 杭州:浙江大学,2011.
YANG G Q. Isolation, identification and nitotine metabolism pathways analysis of two nicotine-degrading bacteria[D]. Hangzhou: Zhejiang University, 2011.
- 王继莲,李明源,马永凯,等. 细菌酶制剂对烟叶中蛋白质的降解作用研究[J]. 农业生物技术学报,2014,22(4):486-494.
WANG J L, LI M Y, MA Y K, et al. Using bacterial enzyme to degrade protein in tobacco(Nicotiana tabacum) leaves[J]. Journal of Agricultural Biotechnology, 2014, 22(4): 486–494.
- 张鸽,梁开朝,辛玉华,等. 四个国家雪茄外包皮烟叶表面细菌分离与活性测定[J]. 中国烟草科学,2018,39(2):82-88.
ZHANG G, LIANG K C, XIN Y H, et al. Isolation and activity determination of surface bacteria in cigar wrapper leaves from four different countries[J]. Chinese Tobacco Science, 2018, 39(2): 82-88.
- 薛磊,郑泽浩,郭志剛,等. 烟草增香细菌的筛选及其作用效果[J]. 中国烟草科学,2019,40(5):60-67.
XUE L, ZHENG Z H, GUO Z G, et al. Screening and application of aroma-enhancing bacteria for tobacco[J]. Chinese Tobacco Science, 2019, 40(5): 60-67.
- XIE F H, QUAN S J, LIU D H, et al. Purification and characterization of a novel α-amylase from a newly isolated Bacillus methylotrophicus strain P11-2[J]. Process Biochemistry, 2014, 49(1): 47-53.
- 倪涵,马永凯,林连兵,等. 玉溪醇化烟叶表面细菌酶制剂对烟叶中淀粉和纤维素的降解作用[J]. 农业生物技术学报,2012,20(3):268-274.
NI H, MA Y K, LIN L B, et al. Degrading starch and cellulose in tobacco leaves by bacteria enzyme agents isolated from Yuxi tobacco leaf surface[J]. Journal of Agricultural Biotechnology, 2012, 20(3): 268–274.
- KAUR S J, GUPTA V K. Production of pectinolytic enzymes pectinase and pectin lyase by Bacillus subtilis SAV-21 in solid state fermentation[J]. Annals of Microbiology, 2017, 67(4): 333-342.
- WEI X T, DENG X W, CAI D B, et al. Decreased tobacco-specific nitrosamines by microbial treatment with Bacillus amyloliquefaciens DA9 during the air-curing process of burley tobacco[J]. Journal of Agricultural and Food Chemistry, 2014, 62(52): 12701-12706.
- 郑艳红,戴芸芸,杨洋,等. 废次烟叶提取液源木质素降解菌Bacillus subtilis SM降解特性[J]. 微生物学通报,2017,44(7):1525-1534.
ZHENG Y H, DAI Y Y, YANG Y, et al. Lignin degrading characteristics ofBacillus subtilisSM isolated from tobacco waste extract[J]. Microbiology China, 2017, 44(7): 1525-1534.
