沙门氏菌噬菌体裂解酶LysLorf22的制备及溶菌活性分析
2020-03-27蔡幸哲彭林刘珂芮刘书亮李诚刘爱平
蔡幸哲 彭林 刘珂芮 刘书亮 李诚 刘爱平


摘要:根据沙门氏菌噬菌体Lumpael的全基因组序列,预测该噬菌体裂解酶基因并对其进行生物信息学分析;优化其在大肠杆菌表达系统中的表达,并分析噬菌体裂解酶LysLorf22与外膜渗透剂最优组合的溶菌效果。结果表明,裂解酶LysLorf22的相对分子质量为1.76×104,等电点为9.14,其较优表达条件为:表达菌株Escherichia coli BL21,37 ℃诱导4 h。LysLorf22裂解谱较宽,最佳工作浓度为375 nmol/L,在30 min内可使氯仿处理的Salmonella Enteritidis ATCC 13076菌悬液OD600下降0.72;375 nmol/L的LysLorf22与0.5 mmol/L乙二胺四乙酸二钠联用对Salmonella Enteritidis ATCC 13076溶菌效果最佳,在2 h内可使活菌数从1.62×109CFU/ml下降至4.31×108CFU/ml。
关键词:沙门氏菌;噬菌体;裂解酶;外膜渗透剂
中图分类号:TS207.7文献标识码:A文章编号:1000-4440(2020)01-0212-07
Abstract:In this study, the gene encoding endolysin was predicted and analyzed by bioinformatic software based on the genomic sequence of Salmonella bacteriophage Lumpael. Besides, the expression of LysLorf22 in Escherichia coli expression system was optimized, and the bactericidal effect of LysLorf22 combined with outer membrane permeabilizing agents was analyzed. The results showed that the molecular weight of LysLorf22 was 1.76×104, and the isoelectric point was 9.14. The optimal expression condition of LysLorf22 was using expression strain Escherichia coli BL21, induced at 37 ℃ for four hours. LysLorf22 had a broad lytic spectrum, and its optimal working concentration was 375 nmol/L, in which the OD600 of chloroform-treated Salmonella Enteritidis ATCC 13076 could be reduced by 0.72 in 30 minutes. The combination of 375 nmol/L LysLorf22 and 0.5 mmol/L disodium ethylenediamine tetraacetate showed the best lytic effect on Salmonella Enteritidis ATCC 13076, which reduced the viable cells from 1.62×109CFU/ml to 4.31×108CFU/ml in two hours.
Key words:Salmonella;bacteriophage;endolysin;outer membrane permeabilizing agent
沙門氏菌是一种常见的人兽共患病原菌,主要通过蛋、肉等禽类产品感染人类[1]。人感染沙门氏菌后多出现剧烈头痛、发热、急性胃肠炎、呕吐等症状[2-3]。在世界各国各类细菌性食物中毒中,沙门氏菌食物中毒占比较高。抗生素在沙门氏菌的预防和治疗中发挥着重要作用,近年来,由于抗生素的滥用,细菌耐药性不断增强,沙门氏菌多重耐药菌株也不断出现。2017年CHINET中国细菌耐药监测结果显示,沙门氏菌属细菌超过50%对氨苄西林产生耐药性,伤寒沙门氏菌和副伤寒沙门氏菌对环丙沙星和氯霉素的耐药力较高[4-6]。沙门氏菌感染的控制面临极大挑战,亟待找到一种新型杀菌剂代替抗生素。
噬菌体在自然界中分布广泛,1958年Jacob等发现噬菌体编码的一类蛋白质具有裂解细菌的作用,将其纯化后命名为裂解酶[7]。噬菌体裂解酶作为杀菌剂具有高效、特异性较强的优点,并且作为一种蛋白质,其理化性质易于研究,便于对其进行改造优化和工业化生产[8]。但裂解酶的作用效果会受酶浓度、环境温度、pH和其他离子的影响,因此应用时还需要掌握裂解酶的最适剂量和最佳作用时间,并控制作用条件[9-10]。与抗生素相比,细菌更难对裂解酶产生抗性,这可能是由于裂解酶的作用位点高度保守,变异几率小[11]。裂解酶结构一般包括结合功能域和催化功能域,研究发现一种裂解酶可能含有1个或多个催化域,这也可能是细菌难以对裂解酶产生抗性的原因之一[12]。
噬菌体裂解酶能降解细菌细胞壁的肽聚糖。革兰氏阴性菌肽聚糖层较薄,但其肽聚糖层外有较厚的外膜保护,裂解酶难以直接自外裂解细菌[13]。目前关于沙门氏菌噬菌体裂解酶的研究较少。因此探究革兰氏阴性菌噬菌体裂解酶的生物学特性,将其与外膜渗透剂(Outer membrane permeabilizing agents,OMP)联用或者对裂解酶进行修饰以提高其裂解效果是当前研究的主要方向[14]。本研究根据沙门氏菌噬菌体Lumpael的基因组公开序列,利用生物信息学软件分析该噬菌体裂解酶,优化LysLorf22基因密码子及其在大肠杆菌(Escherichia coli,E.coli)表达系统中的表达,并分析裂解酶LysLorf22与OMP最优组合对沙门氏菌的溶菌效果,为其在食品、农产品安全中的应用提供参考。
1材料与方法
1.1材料
1.1.1试验菌种Pseudomonas aeruginosa ATCC、Escherichia coli ATCC 25922、Staphylococcus aureus ATCC 25923购自美国ATCC,Escherichia coli BL21、Escherichia coli DH5α购自德国Novagen公司,其它菌株由华中农业大学王小红教授和四川农业大学微生物实验室惠赠。
1.1.2主要试剂LB肉汤、XLD培养基购自青岛高科园海博生物技术有限公司,Triton X-100购自北京吉美生物技术有限公司,柠檬酸(Citric acid,CA)、苹果酸(Malic acid,MA)购自上海瑞永生物科技有限公司,3-color Pre-Stained Protein Ladder High Range PM5100购自台湾SMOBIO公司。
1.1.3主要仪器及设备JY 92-IIN超声波细胞粉碎仪,宁波新芝生物科技股份有限公司生产;Varioskan Flash酶标仪、ST 16R冷冻离心机,美国Thermo Fisher Scientific公司生产;Gel Doc XR+凝胶成像系统、Chem DocTM XRS+成像系统,美国Bio-Rad公司生产。
1.2试验方法
1.2.1裂解酶基因LysLorf22的生物信息学分析从沙门氏菌噬菌体Lumpael的全基因组序列(GenBank登录号:MK125141.1)查找其裂解酶基因LysLorf22的开放阅读框,对核苷酸序列进行翻译。利用ExPASy Bioinformatics Resource Portal(http://us.expasy.org/tools/protparam.html)对裂解酶LysLorf22的相对分子质量和等电点进行分析,利用NCBI BLAST工具对LysLorf22的氨基酸序列进行同源性比对,利用PRABI网站的SOPMA程序 (https://npsa-prabi.ibcp.fr)对LysLorf22的二级结构进行预测,采用NCBI Conserved Domain Database 和InterProScan(http://www.ebi.ac.uk/interpro/scan.html)对LysLorf22的模块化结构进行预测,利用SignalP 5.1 Server (http://www.cbs.dtu.dk/services/SignalP)分析LysLorf22的信号肽序列,利用TMHMM Server (http://www.cbs.dtu.dk/services/TMHMM/)分析LysLorf22跨膜结构域。
1.2.2裂解酶LysLorf22的表达
1.2.2.1重组载体pET-28b-LysLorf22的構建对裂解酶基因LysLorf22进行密码子优化(适于E.coli表达系统),由生工生物工程(上海)股份有限公司合成LysLorf22基因(序列3′端加6 x His标签)。按照合成序列,设计特异性引物并在其5′和3′端分别引入Nco I和Xho I酶切位点。以LysLorf22基因为模板,扩增并纯化PCR产物。分别对PCR产物和载体pET-28b进行Nco I、Xho I双酶切,16 ℃连接酶切产物,转化至E. coli DH5α感受态细胞,挑克隆子测序验证获得重组质粒pET-28b-LysLorf22。
1.2.2.2裂解酶LysLorf22的表达条件优化为优化裂解酶LysLorf22的表达,用不同的表达菌株和温度进行试验。首先,将重组质粒分别转化表达菌株E.coli BL21和E.coli C41,并将相应转化子的单菌落接种于5 ml含50 μg/ml卡那霉素(Kanamycin)的LB培养基(LBK)中37 ℃培养过夜。将过夜培养物接种至5 ml新鲜LBK,当OD600值约0.6时,将其进一步接种于100 ml LBK。当培养物的OD600值达到约1.0时,加入终浓度0.25 mmol/L异丙基β-D-1-硫代半乳糖吡喃糖苷(Isopropyl β-D-Thiogalactoside, IPTG),分别在16 ℃诱导12 h,30 ℃诱导4 h或37 ℃诱导4 h进行裂解酶的表达。诱导表达结束后,以7 000 r/min离心15 min收获菌体沉淀。以磷酸盐缓冲液(PBS;50 mmol/L NaH2PO4,300 mmol/L NaCl,pH 7.5)洗涤沉淀2次,将沉淀重悬于40 ml PBS,并使用冰浴在低于10 ℃的温度下超声破碎细胞(105 W 30 min,开2 s,停2 s),收集上清液(超声处理后的天然蛋白质提取物,NPE)和变性蛋白质提取物(超声处理后沉淀物溶解在8 mol/L尿素中,DPE),取同等体积样品用于SDS-PAGE分析[15]。
1.2.2.3裂解酶LysLorf22的表达与纯化确认裂解酶LysLorf22的较优表达条件后,将其在3 L培养基中诱导表达。收集NPE,按照Liu等[16]方法以Ni+-IDA柱(杭州NeuroPeptide生物科学与技术公司产品)纯化裂解酶LysLorf22,并进行SDS-PAGE和Western blot分析。
1.2.3裂解酶LysLorf22的裂解谱分析参考Mikoulinskaia等[17]的报道,通过浊度法分析裂解酶LysLorf22的裂解谱。将受试菌种接种于130 ml LB肉汤液体培养基中,其中革兰氏阴性菌在培养至对数生长期后加入5%(体积分数)的氯仿处理20 min以除去其外膜,以8 000 r/min离心15 min,经无菌水多次洗涤后离心收集菌体。将沉淀用50 mmol/L Tris-HCl缓冲液(含0.1% Triton X-100,pH 8.2)重悬,调节OD600至0.8~1.0,向200 μl细菌重悬液中加入50 μl裂解酶,于室温下作用30 min后检测OD600,以相同体积Tris-HCl缓冲液(含0.1%Triton X-100)替代裂解酶LysLorf22作为对照。所有试验重复3次,根据裂解率得出裂解酶的裂解谱。裂解率= [(试验组OD600的减小量-空白组OD600的减小量)/ 菌液初始OD600] ×100%。革兰氏阳性菌无需用氯仿处理,直接离心收集菌体。
1.2.4裂解酶LysLorf22最佳作用浓度参考Geng等[18]的方法,以裂解效果较好的Salmonella Enteritidis ATCC 13076作为靶标菌进行裂解酶LysLorf22最佳作用浓度试验。按照方法1.2.3制得经氯仿处理后的细菌重悬液,将50 μl不同浓度的LysLorf22加入到200 μl细菌重悬液中(LysLorf22终浓度分别为0.4 nmol/L、2.0 nmol/L、10.0 nmol/L、50.0 nmol/L、250.0 nmol/L、375.0 nmol/L和500.0 nmol/L),在室温下每隔1 min检测OD600,共监测30 min。以相同体积Tris-HCl缓冲液(含0.1% Triton X-100)替代裂解酶LysLorf22作为对照,所有试验重复3次。
1.2.5裂解酶LysLorf22与OMP联用的溶菌活性分析
1.2.5.1最佳OMP及其作用浓度的测定参考李萌[13]的方法,通过浊度法确定最佳OMP(EDTA、CA和MA)及其最适浓度。将Salmonella Enteritidis ATCC 13076接种于120 ml LB肉汤液体培养基中,培养至对数生长期后以8 000 r/min离心15 min,经无菌水多次洗涤后离心收集菌体。细菌沉淀用50 mmol/L Tris-HCl缓冲液(不含0.1% Triton X-100,pH8.2)重悬至OD600为0.8~1.0。将25 μl LysLorf22(终浓度为最佳作用浓度)、25 μl OMP(EDTA终浓度为0.10 mmol/L、0.25 mmol/L、0.50 mmol/L、1.00 mmol/L、5.00 mmol/L、10.00 mmol/L、20.00 mmol/L和25.00 mmol/L,CA、MA终浓度为0.1 mmol/L、0.5 mmol/L、1.0 mmol/L、5.0 mmol/L、10.0 mmol/L、20.0 mmol/L和25.0 mmol/L)和200 μl细菌重悬液混匀,在室温下静置[19-21],每隔30 min检测OD600,共监测2 h。设置对照,重复3次。
1.2.5.2最优联用组合的溶菌计数按照方法1.2.5.1的方法收集细菌沉淀并重悬至OD600为0.8~1.0。将100 μl LysLorf22(终浓度为最佳作用浓度)、100 μl OMP(方法1.2.5.1确定的最佳联用OMP及其最适浓度)和800 μl细菌重悬液混匀,在25 ℃静置2 h,取100 μl混合液梯度稀释后在XLD培养基上进行菌落计数。设置对照,重复3次。
2结果与分析
2.1裂解酶基因LysLorf22的生物信息学分析
根据沙门氏菌噬菌体Lumpael的基因组序列信息可知其ORF22编码长度为159个氨基酸的裂解酶(命名为裂解酶LysLorf22)。LysLorf22的相对分子质量为1.76×104,等电点为9.14。LysLorf22与Escherichia sp.噬菌体Skarpretter、Klebsiella sp.噬菌体 vB_KpnS_IME279以及Enterobacter bugandensis和Rhodobacter sphaeroides的溶菌酶氨基酸序列相似度为81%~85%。二级结构预测结果表明,LysLorf22主要由α螺旋、无规则卷曲、β折叠和延伸链结构组成,比例分别为43.40%、41.51%、6.92%和8.18%。LysLorf22是8~154位氨基酸与噬菌体λ溶菌酶结构域保守的球状蛋白质酶。LysLorf22不含信号肽序列,也不存在跨膜区域。
2.2裂解酶LysLorf22的表达
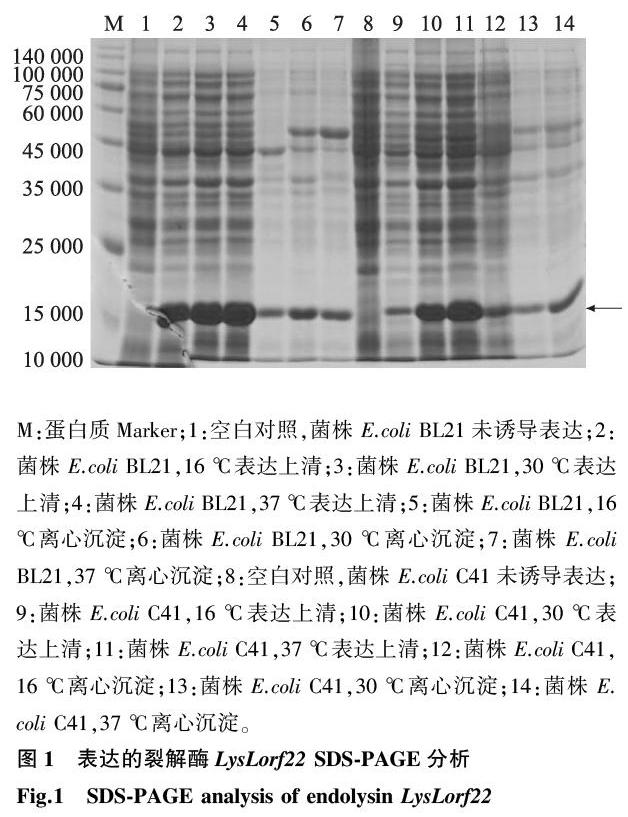
构建重组质粒pET-28b-LysLorf22,尝试不同表达菌株和表达温度组合优化裂解酶LysLorf22的表达。如图1所示,2种表达菌株经过诱导后均表达相对分子质量约1.70×104的蛋白质条带,且条带大小符合裂解酶LysLorf22的预测相对分子质量。由目的蛋白质条带深浅可知,较优的表达条件为:表达菌株E.coli BL21,37 ℃诱导4 h。经过大量表达和纯化,获得了较高纯度的LysLorf22(图2)。
2.3裂解酶LysLorf22的裂解谱
噬菌体裂解酶具有一定的特异性,但是相对于噬菌体,裂解酶的作用又具有一定的广谱性[22-24]。将19株菌株用于检测LysLorf22的裂解谱,结果见表1。LysLorf22基本不能裂解革兰氏阳性菌Listeria monocytogenes EGDe和Staphylococcus aureus ATCC 25923,但其对受试的经氯仿处理的17株革兰氏阴性菌均表现出裂解活性,宿主谱较宽。受试的12株沙门氏菌中,LysLorf22对Salmonella Enteritidis ATCC 13076的裂解率最高,为79%,故选择Salmonella Enteritidis ATCC 13076为后续试验靶标菌。虽然LysLorf22来源于沙门氏菌噬菌体,但是它對E.coli DH5α的裂解率最高(83%),对Salmonella enteritidis ATCC13076的裂解率次之(79%),这可能是由于LysLorf22与Escherichia sp.噬菌体Skarpretter具有较高的同源性。LysLorf22对氯仿预处理的表达菌株E.coli BL21具有较强裂解能力,在LysLorf22制备过程中,由于E.coli BL21未经氯仿处理且菌株所处环境缺乏OMP,故几乎未观察到表达菌株E.coli BL21发酵液变澄清。
2.4裂解酶LysLorf22最佳作用浓度
LysLorf22的最佳作用浓度检测结果如图3所示。LysLorf22浓度为2 nmol/L时即对经氯仿处理的宿主菌表现出明显的裂解效果。裂解酶浓度为250 nmol/L、375 nmol/L和500 nmol/L时裂解效果比较接近。当LysLorf22终浓度为375 nmol/L,与宿主菌作用30 min时,OD600下降最多,为0.72,说明噬菌体裂解酶裂解细菌具有高效性,这与之前的研究结果[25]一致。
2.5裂解酶LysLorf22与OMP联用的溶菌活性
革兰氏阴性菌由于肽聚糖外膜的保护作用,裂解酶不能直接自外裂解细菌,需要OMP协助裂解酶穿透外膜发挥作用。本研究将LysLorf22(375 nmol/L)与不同浓度的EDTA、CA和MA联用,通过浊度法探究裂解效果,结果如图4所示。裂解酶LysLorf22单独作用于活菌时,2 h仅使OD600下降0.06,几乎没有裂解效果,与Oliveira 等[26]的报道一致。EDTA(终浓度为0.10 mmol/L、0.25 mmol/L、0.50 mmol/L、1.00 mmol/L、5.00 mmol/L、10.00 mmol/L、20.00 mmol/L和25.00 mmol/L)单独作用于活菌时有一定的抑菌效果,在EDTA作用浓度为0.50 mmol/L时,2 h使OD600下降0.18。LysLorf22与0.1~25.0 mmol/L的EDTA联用时能有效裂解宿主菌,当EDTA浓度为0.5 mmol/L时,2 h内OD600下降最多,为0.47,且在最初30 min内作用效果最明显,OD600下降0.32。CA和MA(终浓度为0.1 mmol/L、0.5 mmol/L、1.0 mmol/L、5.0 mmol/L、10.0 mmol/L、20.0 mmol/L、25.0 mmol/L)单独作用于活菌时,抑菌效果不明显;不同浓度CA和MA(0.1~25.0 mmol/L)与LysLorf22联用时的裂解效果优于单独使用CA和MA,但均弱于EDTA与LysLorf22联用效果。
按照上述最优裂解组合,使用XLD培养基对其杀菌效果进行计数,结果如表2所示。LysLorf22(375 nmol/L)单独作用于Salmonella Enteritidis ATCC13076时没有裂解效果。EDTA(0.5 mmol/L)单独作用时效果较小,2 h内使细菌数量从1.62×109CFU/ml下降至1.14×109CFU/ml,而LysLorf22(375 nmol/L)与EDTA(0.5 mmol/L)联用2 h能使细菌数量下降至4.31×108CFU/ml,杀菌效率为73.40%。从裂解酶工作浓度和杀菌效果看,LysLorf22与OMP联用的活性明显优于Lim等[27]的报道。目前已有将溶菌酶与EDTA联用应用于食品生产的报道,如Marianna等[28]将溶菌酶、乳酸链球菌素和EDTA联合应用于肉饼杀菌,发现有明显的抑制活菌总数和乳酸菌生长的作用。
3结论
本研究基于生物信息学分析,选取pET表达系统对裂解酶LysLorf22的表达条件进行优化,经诱导表达获得相对分子质量为1.76×104的裂解酶LysLorf22。该酶具有高效性和较强的特异性,与外膜渗透剂联用时表现出一定程度的溶菌活性,其中LysLorf22与EDTA联用对沙门氏菌的杀灭效果最佳,具有较好的控制食品中沙门氏菌污染的潜力。由于LysLorf22对本试验中的两株革兰氏阳性菌没有明显的裂解效果,可在与EDTA联用的基础上再与革兰氏阳性菌噬菌体裂解酶、抗生素联用,配置成混合制剂,提高其杀菌广度。混合制剂可减少每种成分的用量,并降低细菌产生抗性的几率[29-30]。
参考文献:
[1]包红朵,张辉,王冉. 宽噬菌谱肠炎沙门氏菌噬菌体的生物学特性[J]. 江苏农业学报, 2011, 27(5): 1117-1121.
[2]包红朵,周艳,张鹏禹,等. 沙门氏菌裂解性噬菌体的分离鉴定及其生物学特性[J]. 食品科学, 2015, 36(5): 131-136.
[3]王晶钰,董睿,王利勤,等. 市售鲜鸡蛋中沙门氏菌的分离鉴定及毒力岛基因检测[J]. 食品科学, 2012, 33(16): 154-158.
[4]朱冬梅,彭珍,刘书亮,等. 肉鸡屠宰加工过程中沙门氏菌的污染情况及其耐药性分析[J]. 食品科学, 2014, 35(17): 214-219.
[5]胡付品,郭燕,朱德妹,等. 2017年CHINET中国细菌耐药性监测[J]. 中国感染与化疗杂志, 2018, 18(3): 241-251.
[6]冯彩峰,林居纯,张飞,等. 食品动物源沙门氏菌血清型及对β-内酰胺类耐药性调查[J]. 食品科学, 2015,36(7):101-104.
[7]JACOB F, FUERST C R. The mechanism of lysis by phage studied with defective lysogenic bacteria[J]. Microbiology, 1958, 18(2): 518-526.
[8]渠坤丽,徐永平,李振,等. 提高噬菌体裂解酶抗菌活性的研究进展[J]. 微生物学雜志, 2017, 37(1): 88-93.
[9]许东勤. 沙门氏菌噬菌体SLMP1裂解酶的重组表达及噬菌体在水产品中的应用研究[D]. 上海: 上海海洋大学, 2018.
[10]严晶,胡申才. 噬菌体裂解酶的应用概况[J]. 湖北农业科学, 2019, 58(10): 5-8.
[11]夏翡翡. 噬菌体裂解酶LysGH15与芹菜素联合应用治疗金黄色葡萄球菌肺炎的研究[D]. 长春: 吉林大学, 2016.
[12]张辉,周艳,包红朵,等. 噬菌体裂解酶结构域重构及其裂解功能分析[J]. 华北农学报, 2017, 32(6): 134-138.
[13]李萌. 宽裂解谱沙门氏菌噬菌体的基因组学分析及其重组内溶素抑菌活性研究[D]. 青岛: 中国海洋大学, 2014.
[14]朱丹,祝思路,付玉荣,等. 噬菌体裂解酶作用机制及用于细菌感染治疗的研究进展[J]. 基础医学与临床, 2018, 38(2): 241-245.
[15]杨曦. 大肠杆菌O157 Stx噬菌体裂解酶的原核表达及活性研究[D]. 上海: 上海交通大学, 2012.
[16]LIU A, XIONG Q, SHEN L, et al. A sandwich-type ELISA for the detection of Listeria monocytogenes using the well-oriented single chain Fv antibody fragment[J]. Food Control, 2017, 79: 156-161.
[17]MIKOULINSKAIA G V, ODINOKOVA I V, ZIMIN A A, et al. Identification and characterization of the metal ion-dependent l-alanoyl-d-glutamate peptidase encoded by bacteriophage T5[J]. Febs Journal, 2009, 276(24):7329-7342.
[18]GENG P, HU Y, ZHOU G, et al. Characterization of three autolysins with activity against cereulide-producing Bacillus isolates in food matrices[J]. International Journal of Food Microbiology, 2017, 241:291-297.
[19]LEGOTSKY S A, VLASOVA K Y, PRIYMA A D, et al. Peptidoglycan degrading activity of the broad-range Salmonella bacteriophage S-394 recombinant endolysin[J]. Biochimie, 2014, 107: 293-299.
[20]SCHMELCHER M, POWELL A M, CAMP M J, et al. Synergistic streptococcal phage λSA2 and B30 endolysins kill streptococci in cow milk and in a mouse model of mastitis[J]. Applied Microbiology & Biotechnology, 2015, 99(20): 1-12.
[21]BRIERS Y, LAVIGNE R, VOLCKAERT G, et al. A standardized approach for accurate quantification of murein hydrolase activity in high-throughput assays[J]. Journal of Biochemical Biophysical Methods, 2007,70: 531-533.
[22]HONG J, KIM K P, HEU S, et al. Identification of host receptor and receptor-binding module of a newly sequenced T5-like phage EPS7[J]. FEMS Microbiology Letters, 2008, 289(2): 202-209.
[23]ZIMMER M, VUKOV N, SCHERER S, et al. The murein hydrolase of the bacteriophage φ3626 dual lysis system is active against all tested clostridium perfringens strains[J]. Applied and Environmental Microbiology, 2002, 68(11): 5311-5317.
[24]YOONG P, SCHUCH R, NELSON D, et al. Identification of a broadly active phage lytic enzyme with lethal activity against antibiotic-resistant Enterococcus faecalis and Enterococcus faecium[J]. Journal of Bacteriology, 2004, 186(14): 4408-4412.
[25]SCHUCH R, NELSON D, FISCHETTI V A. A bacteriolytic agent that detects and kills Bacillus anthracis[J]. Nature, 2002, 418(6900): 884-889.
[26]OLIVEIRA H, THIAGARAJAN V, WALMAGH M, et al. A thermostable salmonella phage endolysin, lys68, with broad bactericidal properties against gram-negative pathogens in presence of weak acids[J]. PLoS ONE, 2014, 9(10): e108376.
[27]LIM J A, SHIN H, KANG D H, et al. Characterization of endolysin from a Salmonella typhimurium-infecting bacteriophage SPN1S[J]. Research in Microbiology, 2012, 163(3): 233-241.
[28]MARIANNA M, ANNALISA L, MILENA S, et al. Use of lysozyme, nisin, and EDTA combined treatments for maintaining quality of packed ostrich patties[J]. Journal of Food Science, 2010, 75(3): 178-186.
[29]TANJI Y, SHIMADA T, YOICHI M, et al. Toward rational control of Escherichia coli O157:H7 by a phage cocktail[J]. Applied Microbiology and Biotechnology, 2004, 64(2): 270-274.
[30]TANJI Y, SHIMADA T, FUKUDOMI H, et al. Therapeutic use of phage cocktail for controlling Escherichia coli O157:H7 in gastrointestinal tract of mice[J]. Journal of Bioscience and Bioengineering, 2005, 100(3): 280-287.
(責任编辑:张震林)
