离子液体超声波辅助提取白花葛茎多糖工艺优化
2020-03-27林志銮金晓怀张传海马春华
林志銮 金晓怀 张传海 马春华

摘要:利用超声波辅助提取多糖的方法,研究武夷山白花葛茎多糖的最优提取工艺条件。在单因素试验基础上,以白花葛茎多糖提取率为指标,进行四因素三水平Box-Behnken设计,用响应面法分析4个因素对白花葛茎多糖提取率的影响,并进行优化。最终以6%离子液体[BMIm][PF6] 3 ml、超声功率630 W、超声时间25 min、料液比1∶35(g/ml)为最佳提取条件,采用最优提取工艺条件对白花葛茎多糖进行提取,此时白花葛茎多糖的提取率为22.53 mg/g。扫描电镜观察发现,离子液体超声处理对白花葛茎粉末微观结构破坏程度较大。
关键词:白花葛;多糖;离子液体;超声波;响应面
中图分类号:Q946.3文献标识码:A文章编号:1000-4440(2020)01-0187-07
Abstract:The optimal extraction conditions of polysaccharide from Pueraria f. niveus stem in Wuyi Mountain were studied by ultrasonic assisted extraction method. On the basis of single-factor experiment, the extraction rate of polysaccharides from the Pueraria f.niveus was determined as the index. Box-behnken was designed with four factors at three levels. Response surface method was used to analyze the effect of four factors on the extraction rate of polysaccharides from the stem of Pueraria f.niveus, and the optimization was carried out. The optimal extraction conditions were as follows: the 6% ionic liquid [BMIm][PF6] was 3.00 ml, ultrasonic power was 630 W, ultrasonic extraction time was 25 min, the solid-liquid ratio was 1∶35. Under the optimal extraction conditions, the extraction rate of polysaccharide from the stem of Pueraria f. niveus was 22.53 mg/g. Besides, the scanning electron microscope observation results showed that the microstructure of the Pueraria f. niveus was destroyed greatly by ionic liquid ultrasonic treatment.
Key words:Pueraria f. niveus;polysaccharide;ionic liquid;ultrasonic;response surface
据《中国植物志》记载,葛花冠呈天蓝色或紫色,葛属中研究较多的是粉葛(P.thomsonii Benth)和野葛[Pueranalobata(Willd)Ohwi.],为药食两用植物。近年来,临床上用葛根治疗心绞痛等疾病均有显著疗效,有解肌退热,透疹,生津止渴,升阳止泻等功效,可用于治疗外感发热头痛、消渴、泄泻、眩晕头痛、中风偏瘫、胸痹心痛[1]。白花葛(Pueraria f. niveus)是葛属中新发现的品种,于2002年9月在福建省武夷山区发现[2]。多糖和黄酮类是葛根主要的有效成分,也是衡量其药材质量的重要指标[3]。
目前,关于葛根多糖的提取和测定已成为中国学者研究的热点。潘俊等[4]利用聚乙烯吡咯烷酮(PVP)辅助提取葛根中的葛根素,最佳条件为料液比1∶16(g/ml)、提取温度60 ℃、提取时间2.5 h、PVP质量浓度45 mg/ml,葛根素提取率为1.600%。董洲[5]采用水提醇沉法获取野葛根中水溶性粗多糖,纯化得到GE-1和GE-2两个组分,均能促进小鼠巨噬细胞RAW264.7分泌细胞因子。裴莉昕等[6]以葛根多糖为研究对象,用提取率和含量为指标,进行综合分析,得出葛根多糖的最佳提取工艺,该工艺获得葛根多糖提取率可达15.380%。周麗明等[7]在葛根渣中提取葛根多糖,通过正交试验优化多糖提取工艺,得到最佳的提取工艺为回流时间2.0 h、乙醇体积分数75%、料液比1∶40(g/ml)、回流温度95 ℃,葛根多糖提取率为1.209%。赵丹等[8]建立了葛根中11种单糖的离子色谱方法,利用色谱进行分离检测,经Box-Behnken响应面优化后的最佳提取工艺条件为料液比1∶28(g/ml)、超声时间44 min、超声温度65 ℃,认为不同产地的葛根样品中均含有岩藻糖、鼠李糖、葡萄糖。
本研究拟以白花葛为研究对象,为了更好地保护和利用此种植物,防止挖根破坏资源,对其进行开发性研究,从白花葛茎中提取多糖,利用离子液体和超声辅助提取,响应面法优化白花葛茎多糖提取的工艺条件,荧光分光光度计测定白花葛茎中多糖的含量,以期为推动白花葛的资源开发及利用提供理论参考。
1材料与方法
1.1试验材料与试剂
试验所用植株采自福建省武夷山市岚谷乡,经武夷学院张传海教授鉴定为豆科葛属白花葛(Pueraria f. niveus)。取白花葛茎为试验材料,洗净后低温烘干,用高速药物粉碎机进行粉碎,过60目筛,备用。
苯酚、硫酸、葡萄糖、三氯乙酸、正丁醇均由国药集团化学试剂有限公司提供,1-丁基-3-甲基咪唑六氟磷酸盐([OMIm][PF6])、1-辛基-3-甲基咪唑六氟磷酸盐([HMIm][PF6])、1-己基-3-甲基咪唑六氟磷酸盐([BMIm][PF6])均由上海麦克林生化科技有限公司提供。以上所有化学试剂均为分析纯,水为重蒸水(自制)。
试验所用仪器有SBH VEGA3型扫描电子显微镜(泰思肯公司产品)、F-4500型荧光分光光度计(日立公司产品)、BS224SS型电子天平(赛多利斯仪器系统有限公司产品)、DFY-1000C型植物粉碎机(比朗仪器有限公司产品)、S10H型超声波清洗机(致微仪器有限公司产品)、DHG-9070A型电热恒温鼓风干燥箱(福玛实验设备有限公司产品)。
1.2试验方法
6%离子液体溶液配制方法:准确称取0.3 g离子液体试剂,定容至50 ml,摇匀,备用。6%苯酚液体溶液配制方法:准确称取0.3 g苯酚试剂,定容至50 ml,摇匀,备用。2 mg/ml葡萄糖溶液配制方法:准确称取0.2 g葡萄糖(105 ℃烘2 h),定容至100 ml,摇匀,备用。
1.2.1显色准确移取葡萄糖溶液、重蒸水、多糖提取液和苯酚溶液各1 ml于25 ml比色管中,迅速加入5 ml浓硫酸,冷却至室温后定容至25 ml,静置20 min,显色完成[9-10]。测定其荧光强度(A),仪器的工作条件:激发狭缝5 nm;发射狭缝10 nm;扫描速度12 000 r/min,灯电压700 V,激发波长(Ex)和发射波长(Em)起始范围均为200~700 nm。
1.2.2葡萄糖标准曲线的绘制
准确移取0 ml、0.10 ml、0.25 ml、0.50 ml、1.00 ml、1.50 ml、2.00 ml、2.50 ml的2.00 mg/ml葡萄糖溶液,分别置于8支25.00 ml的具塞比色管中,按1.2.1的试验步骤进行显色反应。利用F-4500型荧光分光光度计测定其荧光强度。以浓度作为横坐标,荧光强度为纵坐标进行线性回归。
1.2.3单因素试验以白花葛茎提取液中的多糖提取率为指标,分别对超声功率(450 W、540 W、630 W、720 W、810 W)、超声时间(10 min、15 min、20 min、25 min、30 min)、离子液体体积(1 ml、2 ml、3 ml、4 ml、5 ml)、料液比[1∶10 (g/ml)、1∶15 (g/ml)、1∶20 (g/ml)、1∶25 (g/ml)、1∶30 (g/ml)、1∶40 (g/ml)、1∶50 (g/ml)]以及4种提取液(重蒸水、[OMIm][PF6]、[HMIm][PF6]、[BMIm][PF6])等有关因素进行考察和分析,重复3次取其平均值,确定适宜的试验条件。
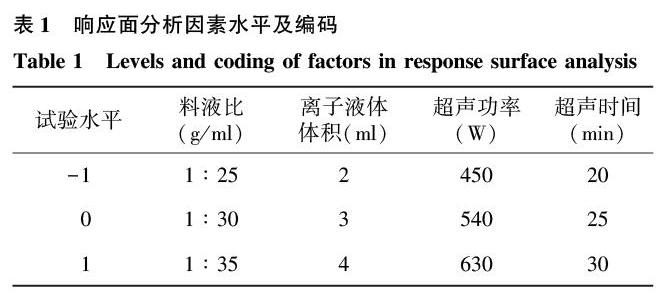
1.2.4响应面Box-Behnken试验设计以料液比、离子液体体积、超声功率、超声时间为4个变量,通过单因素试验,利用Box-Behnken软件设计L9(34)四因素三水平试验,具体如表1显示。
1.2.5多糖提取准确称取1 g白花葛茎粉末加入容量瓶中,加入一定体积提取液(恒温80 ℃),在一定功率下超声提取一段时间,减压过滤,浓缩至10.0 ml。将浓缩液与三氯乙酸试剂按照1∶1的体积比进行混合,在10 000 r/min的转速下离心20 min,取上清液,定容至10.0 ml,得到白花葛茎多糖提取液,备用。准确移取0.5 ml提取液于25.0 ml比色管中,经显色后,测定其荧光值,根据回归方程,计算多糖提取率:
白花葛茎多糖提取率(mg/g)=提取所得多糖的质量/原料干质量
1.2.6电镜扫描对不同提取液提取的白花葛茎粉末进行低温干燥,用扫描电子显微镜观察样品组织结构。
2结果与分析
2.1最大激发波长和发射波长的确定
准确移取葡萄糖溶液、重蒸水、多糖提取液和6%苯酚溶液各1 ml于25 ml比色管,迅速加入5 ml浓硫酸,冷却至室温后,定容至25 ml,静置20 min,显色完成,测定其荧光强度。结果(图1)表明,测定的最大激发波长为420 nm,最大发射波长为647 nm。
2.2葡萄糖标准曲线
以葡萄糖样品浓度(x)为横坐标,荧光强度(Y)为纵坐标,进行线性回归。结果表明,Y=3.51x+845.04,r=0.999 2。
2.3单因素试验结果
2.3.1提取液对白花葛茎多糖提取率的影响为了寻找最佳的提取液,本研究讨论了[OMIm][PF6]、[HMIm][PF6]、[BMIm][PF6]、重蒸水这4种提取液对白花葛茎多糖提取率的影响。结果(图2)表明,[BMIm][PF6]离子液体辅助提取的白花葛茎多糖提取率最大,达到22.78 mg/g。添加离子液体和不添加离子液体的对比結果表明,添加离子液体的白花葛茎多糖提取率明显增加[11-13],这是因为离子液体可以溶解更多的植物纤维并促进溶液进入细胞[14]。
2.3.2超声功率对白花葛茎多糖提取率的影响在料液比1∶30(g/ml)、超声时间20 min、[BMIm][PF6]体积3 ml条件下,选择不同的超声功率(450 W、540 W、630 W、720 W、810 W)提取白花葛茎多糖。结果(图3)显示,当超声功率为540 W时,白花葛茎多糖提取率最高,为17.30 mg/g。所以,最优超声功率为540 W。
2.3.3离子液体体积对白花葛茎多糖提取率的影响在料液比1∶30(g/ml)、超声功率540 W、超声时间20 min条件下,选择不同体积的[BMIm][PF6](1 ml、2 ml、3 ml、4 ml、5 ml)对白花葛茎多糖进行提取。结果(图4)显示,当[BMIm][PF6]离子液体用量为3 ml时,多糖提取率最高,为22.92 mg/g。适当添加离子液体能够增强植物细胞壁的破坏,但当[BMIm][PF6]添加量过大时,其黏度相应增大,导致离子液体难以穿透样品细胞壁,阻碍多糖的溶出[15]。因此,6%离子液体[BMIm][PF6]的最佳用量为3 ml。
2.3.4超声时间对白花葛茎多糖提取率的影响在料液比1∶30(g/ml)、超声功率540 W、[BMIm][PF6]体积3 ml条件下,选择不同的超声时间(10 min、15 min、20 min、25 min、30 min)对白花葛茎多糖进行提取。结果(图5)显示,当超声时间为25 min时,此时多糖提取率最高,为13.61 mg/g。所以,最优超声时间为25 min。
2.3.5料液比对白花葛茎多糖提取率的影响在超声功率540 W、超声时间25 min、[BMIm][PF6]体积3 ml条件下,选择不同的料液比[1∶10(g/ml)、1∶15(g/ml)、1∶20(g/ml)、1∶25(g/ml)、1∶30(g/ml)、1∶40(g/ml)、1∶50(g/ml)]对白花葛茎多糖进行提取。结果(图6)显示,当料液比为1∶30(g/ml)时,多糖提取率最高,為14.81 mg/g。所以,最佳料液比为1∶30(g/ml)。
2.4响应面试验结果
利用Box-Behnken软件设计L9(34)四因素三水平的试验,具体方案如表2显示。
对表2的数据进行响应面分析,得到多元二次响应面回归模型:Y=21.89+1.25A-1.73B+1.04C+0.27D-1.57AB+0.02AC-1.79AD+0.64BC-1.33BD-0.81CD-3.58A2-3.35B2-2.08C2-3.17D2,Y表示多糖提取率,A表示料液比,B表示离子液体体积,C表示超声功率,D表示超声时间,从多元回归方程中可以看出各变量对于响应值交互作用的影响表现为:离子液体体积>料液比>超声功率>超声时间。
表3显示,整体的数据模型反映出该二次方程模型差异极显著(P<0.01),能直观地表示结果的精密度和准确性。该回归方程失拟项的P值为0.844 3,数据结果差异不显著。说明干扰因素比较少,本试验数据模型回归方程的拟合度良好,试验结果可靠。
3D图根据形成的平面坡面陡峭度来判断显著性,坡面越陡峭,因素的交互作用越显著;坡面越平缓,则交互作用越不显著[16]。响应面图越陡,说明2个自变量的交互作用对响应值的影响程度越大,响应面图越平缓,交互作用影响越不明显。从响应面图(图7)观察得出,6%离子液体[BMIm][PF6]体积3 ml、料液比1∶35(g/ml)、超声功率630 W、超声时间25 min条件下,白花葛茎多糖提取率获得最大值。
2.5验证试验
准确称量1 g白花葛茎样品,在最优条件:料液比1∶35(g/ml)、6%离子液体[BMIm][PF6] 3 ml、超声功率630 W、超声时间25 min下提取多糖,重复5次。结果(表4)显示,经过平行提取5次,多糖提取率为21.75~22.99 mg/g,相对标准偏差为2.63%,多糖提取率平均值为22.53 mg/g。
2.6扫描电镜结果
用重蒸水、[OMIm][PF6]、[HMIm][PF6]、[BMIm][PF6]离子液体分别处理白花葛茎样品,干燥后用电镜扫描进行分析。图8显示,用不同处理液处理后,白花葛茎的细胞结构发生变化,离子液体对植物细胞壁中的纤维素具有降解作用,可能会导致纤维素分子间发生断裂使其溶解,导致细胞内的多糖更容易释放出来。
3讨论
采用离子液体超声辅助提取白花葛茎中的多糖,在单因素试验基础上,采用响应面法优化[BMIm][PF6]离子液体体积、料液比、超声功率、超声时间对白花葛茎中多糖提取率的影响。利用离子液体进行提取,主要是由于离子液体的极性可控,可以对异黄酮进行选择性提取,此方法所需溶剂少,离子液体可重复利用[17]。通过扫描电子显微镜发现离子液体对白花葛茎表面具有较强的破坏能力,这与李明英[18]和安仕豪等[19]的研究结果一致。离子液体添加量过高,会使离子液体的黏度相应增大,导致离子液体难以穿透样品细胞壁,阻碍多糖的溶出[15]。采用[BMIm][PF6]提取,白花葛茎多糖提取率最高,这个主要与阳离子有关,在阴离子均为[PF6]的不同烷基链长的离子液体中,[BMIm]具有合适的碳链,离子液体与白花葛茎中多糖类、黄酮类化合物之间的范德华力较其他离子液体要强很多[20],对多糖类物质的强溶解能力也更好。此外,离子液体是有机阳离子和无机或有机阴离子组成的极性物质,一种环保的“绿色溶剂”和“可设计性溶剂”,可通过改变离子液体阴离子、阳离子的结构,调整离子液体的溶解性、pH、疏水性等性能参数[21]。[BMIm][PF6]离子液体可能与多糖大分子之间形成了氢键,进一步破坏多糖分子内和分子间原本存在的氢键网络结构,从而有利于多糖的溶解,并且多糖在离子液体中的溶解性受其阴阳离子种类、极性和尺寸的影响[22]。
通过分析并考虑实际操作条件得到最终优化参数为:料液比1∶35(g/ml)、6%离子液体[BMIm][PF6]3.00 ml、超声功率630 W、超声时间25 min。在此条件下白花葛茎多糖提取率为22.53 mg/g。扫描电镜观察发现,离子液体超声提取技术对白花葛茎细胞壁结构的破坏更严重。因此,采用离子液体超声辅助提取白花葛茎中的多糖,可获得较多的多糖。
参考文献:
[1]李臻,赖富饶,吴晖.葛根的营养成分分析[J].现代食品科技,2011,12(8):1010-1012.
[2]阮淑明.白花葛的特征特性及栽培技术[J].现代农业科技, 2010(20):153-154.
[3]陈兵兵.葛根多糖的提取分离、理化特性及生物活性研究[D].镇江:江苏大学,2016.
[4]潘俊,匡慕予,田浩,等.粉葛中葛根素提取工艺的优化及其提取物抗氧化活性[J].中成药, 2018,40(11): 2430-2436.
[5]董洲.野葛根多糖的提取、分离纯化、结构鉴定及对小鼠巨噬细胞RAW264.7的免疫调节活性研究[D].广州:华南理工大学,2018.
[6]裴莉昕,纪宝玉,陈随清,等.葛根多糖提取工艺的优化[J].中国现代中药,2017,19(4): 553-556,567.
[7]周丽明,张勇,林国卫.等.葛根多糖提取条件的优化及其抗氧化活性的研究[J].湖北农业科学,2012,51(19):4344-4347.
[8]赵丹,聂波,宋昆,等.离子色谱法测定不同产地葛根多糖中的单糖组成[J].分析试验室,2017,36(7):745-749.
[9]张传海,林志銮,李宝银,等.闽北林下种植多花黄精的总黄酮含量分析及其生物活性评价[J].天然产物研究与开发,2018,30(2):225-231.
[10]李国明,张丽萍,戴余波,等.苯酚-硫酸比色法测定瑞丽白芨多糖含量[J].热带农业科学,2018,38(10):62-67.
[11]刘宝亮,吴一帆,穰小东,等.响应面法优化离子液体双水相提取银杏黄酮的工艺研究[J].中国食品添加剂,2018(12):108-115.
[12]粟敏,陈琳,龙昱,等.离子液体-微波辅助提取多花黄精多糖工艺研究[J].中药材,2016,39(9):2075-2077.
[13]封易成,牟德华.离子液体酶法微波辅助提取山楂有机酸工艺优化及成分分析[J].食品研究与开发,2019,40(10):87-95.
[14]USUKI T, YASUDA N, YOSHIZAWA-FUJITA M, et al. Extraction and isolation of shikimic acid from Ginkgo biloba leaves utilizing an ionic liquid that dissolves cellulose[J]. Chemical Communications, 2011, 47(38): 10560-10562.
[15]TAN T, LAI C J S, OUYANG H, et al. Ionic liquid-based ultrasound assisted extraction and aqueous two phase system for analysis of caffeoylquinic acids from Flos Lonicerae Japonicae [J]. Journal of Pharmaceutical Biomedical Analysis, 2016, 120: 134-141.
[16]徐慧,趙双枝,刘孝永,等.响应面法优化鹿角灵芝产胞内多糖的液体发酵工艺[J].江苏农业科学,2018,46(23) : 215-220.
[17]苏适,赵东江,王喜庆,等.响应面法优化超声辅助离子液体提取黑豆异黄酮及其抗氧化活性研究[J].中国粮油学报,2019,34(11):24-28.
[18]李明英.离子液体在天然活性物质提取中的应用研究进展[J].药学进展,2015,39(6):437-445.
[19]安仕豪,赵芳芳,魏佳,等.响应面法优化超声辅助离子液体提取籽瓜果胶工艺的研究[J].食品工业科技,2019,38(11):270-275.
[20]王刚,黎丹,蒋奉秦,等.离子液体结合微波提取石上柏中穗花杉双黄酮工艺优化[J].现代化工,2018,39(20):141-145.
[21]丁佳,曾珊,潘浪胜,等.响应曲面优化花生壳中木犀草素的提取工艺研究[J].现代化工,2017,37(8):121-126.
[22]白文强,王强,刘丽,等. 以离子液体为介质的修饰改性对多糖结构与理化性质的影响研究进展[J].食品科学,2018,39(17):291-297.
(责任编辑:王妮)
