白杨素固体脂质纳米粒水凝胶骨架缓释片的制备
2020-03-27李宏伟付金芳范明松
李宏伟付金芳范明松
(1.黄河科技学院,河南 郑州450005; 2.郑州澍青医学高等专科学校,河南 郑州450064; 3.上海雷允上药业有限公司技术中心,上海201401)
白杨素主要是从紫葳科植物木蝴蝶Oroxylum indicum(Linn.)Kurz中提取出的一种活性成分,属于黄酮类化合物,具有多种药理活性,比如抗肿瘤、抗炎、抗心律失常、降血压等[1-3],对动脉粥样硬化、高血压等心脑血管疾病有明显的预防、治疗作用[4],但其水溶性较差[5-6],导致生物利用度很低。课题组[7]前期曾采用固体脂质纳米粒技术改善白杨素体内吸收,极大提高了其生物利用度,但血药浓度仍较大[8-9],故有必要联用缓控释技术加以改善。
水凝胶骨架缓释片一般采用亲水性高分子羟丙基甲基纤维素(hydroxypropyl methylcellulose,HPMC)作为骨架材料,制备工艺简单,适合工业化生产,是缓释制剂研究的热点之一[10-11]。本实验首先采用冻干保护剂将白杨素固体脂质纳米粒制备成冻干粉末,然后选择HPMC 作为缓释材料,聚乙二醇(polyethylene glycol,PEG)作为缓释片释药速率调节剂,进一步制成具有缓释特征的水凝胶骨架缓释片,以期为相关制剂革新提供参考。
1 材料
1.1 仪器 安捷伦1100 型高效液相色谱仪(美国安捷伦公司);PB203-N 型电子分析天平[梅特勒-托利多国际贸易(上海)有限公司];TF-86-200-WA 型超低温冰箱(上海田枫实业有限公司);Mastersizer 3000E 型激光粒度仪(英国马尔文仪器有限公司);BP-8170-B 型手摇单冲压片机(河南宝品科技有限公司);LGJ-10 型冷冻干燥机(北京松原华兴科技发展有限公司);ZRS8G 型智能溶出试验仪(上海双旭电子有限公司)。
1.2 试剂与药物 白杨素原料药(批号161018001,纯度>98%,河南莱尔茵科技有限公司);白杨素对照品(批号 20161025,纯度99.3%,上海源叶生物有限公司)。蔗糖(西安悦来医药科技有限公司);淀粉(批号20170620,曲阜市药用辅料有限公司);甘露醇(批号M160525,法国罗盖特公司);乳糖(批号56522108,上海宏运实业有限公司);羟丙基甲基纤维K15M(HPMC K15M,批号SH234187,上海卡乐康公司);泊洛沙姆 188(F68,批号WPMD507C,德国BASF 公司)、Tween-80(国药集团化学试剂有限公司);卵磷脂(批号PC20170510,郑州明欣化工产品有限公司);单硬脂酸甘油酯(批号P20160517,上海金锦乐实业有限公司);硬脂酸镁(批号151026,曲阜市天利药用辅料有限公司)。磷酸为色谱纯(批号C10197679,上海麦克林生化科技有限公司);乙腈为色谱纯(德国Merck 公司)。
2 方法与结果
2.1 白杨素含有量测定
2.1.1 色谱条件 Waters C18色谱柱(250 mm×4.6 mm,5 μm);流动相乙腈-0.15%磷酸(28∶72);体积流量1.0 mL/min;柱温25 ℃;检测波长222 nm;进样量20 μL。
2.1.2 线性关系考察 精密称取白杨素对照品10.44 mg,转移至100 mL 量瓶中,70 mL 乙腈超声处理20 s,静置0.5 h 后定容并混匀,精密量取适量,流动相逐步稀释成0.104、0.52、1.04、5.22、10.44、26.10 μg/mL,在“2.1.1”项色谱条件下进样测定。以溶液质量浓度为横坐标(X),峰面积为纵坐标(Y)进行回归,得方程为Y=15.236 4X+0.923 1(r=0.999 8),在0.104~26.10 μg/mL 范围内线性关系良好。
2.1.3 供试品溶液制备 精密量取固体脂质纳米粒混悬液1.0 mL 于100 mL 量瓶中,乙腈超声处理5 min 进行破乳,放置30 min 后流动相定容混匀,取1 mL 上清液,加入1 mL 流动相混匀,即得。
2.1.4 方法学考察 选择 26.10、10.44、0.104 μg/mL作为白杨素高、中、低质量浓度,日内精密度RSD 分别为0.51%、0.67%、0.86%,日间精密度RSD 分别为0.94%、0.38%、0.55%;供试品溶液在0、1、2、3、4、5 d 内峰面积无明显变化,表明在5 d 内稳定性良好;平均加样回收率分别为99.68%(RSD=0.51%)、100.38%(RSD=0.93%)、100.09%(RSD=0.99%)。
2.2 固体脂质纳米粒制备[7]采用乳化超声-低温固化法,整个操作过程注意避光。称取白杨素30 mg、单硬脂酸甘油酯250 mg、大豆卵磷脂50 mg,置于10 mL 无水乙醇中,水浴加热至(75±1)℃,搅拌溶解,作为油相;称取Tween-80、F68 各80 mg,溶于20 mL 蒸馏水中,水浴加热至(75±1)℃,搅拌溶解,作为水相,将油相缓慢滴入水相中,并继续搅拌使混悬液体积浓缩至约10 mL,作为初乳,继续超声(800 W,每6 s 间隔3 s)处理10 min 后,置于-20 ℃冰箱中固化,0.45 μm 微孔滤膜过滤,即得。
2.3 包封率、载药量、粒径测定 避光条件下精密量取2.0 mL 固体脂质纳米粒混悬液,加到超滤离心管(10 kD)内管中,12 000 r/min 离心60 min,取超滤离心管外管滤液适量,HPLC 法测定游离白杨素含有量(m游离)。取同体积固体脂质纳米粒混悬液,置于10 mL 量瓶中,加入乙腈,超声法破坏纳米粒,定容至刻度,计算纳米粒中白杨素含有量(m总)。然后,根据课题组前期报道的方法[7]测定包封率、载药量,测得两者分别为80.57%、6.04%。
纳米粒混悬液用蒸馏水稀释后,测定其粒径分布情况,结果见图1,可知平均粒径为(215.84±16.38)nm。另外,纳米粒PDI 为0.108±0.025。Zeta 电位为-(21.61±2.34)mV。
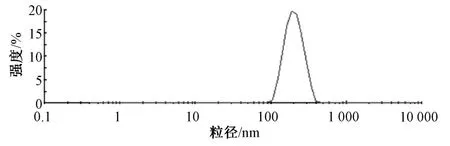
图1 固体脂质纳米粒粒径分布Fig.1 Particle size distribution of solid lipid nanoparticles
2.4 水凝胶骨架缓释片制备 按100 片量进行制备,每片取纳米粒混悬液9.1 mL(含药量2.75 mg/mL),加入冻干保护剂(蔗糖、乳糖、甘露醇)350 mg/片,-80 ℃下预冻后冷冻干燥。取过80 目筛的纳米粒冻干粉末、HPMC 15K、PEG,充分混匀。加入适量6%淀粉浆制软材,20 目筛制粒,45 ℃真空干燥24 h,过20 目筛整粒,加入适量硬脂酸镁,充分混匀后压片[压力(50±10)N],即得。该缓释片直径为1.1 cm,形状为圆形,片重约为0.5 g(辅料用量考察时会发生变化),含药量约为25 mg/片。
2.5 释放度测定 采用转篮法测定。取适量缓释片,以900 mL 经超声波法处理的1.0%SDS 溶液为释放介质,温度(37.0±0.5)℃,转速75 r/min,预定时间点取样3 mL,补加同体积蒸馏水,精密量取2 mL,同时加入1.0 mL 乙腈,称定质量,超声处理30 s,乙腈补充减失的质量,作为供试品溶液,滤过,HPLC 法测定白杨素含有量。计算各取样时间点累积释放度,绘制体外释药曲线。
2.6 单因素试验
2.6.1 冻干保护剂种类 设定HPMC K15M 用量为50 mg/片,PEG 4000 用量为30 mg/片,硬脂酸镁用量为片芯质量的1.0%,考察蔗糖、乳糖、甘露醇对药物释放的影响,结果见图2。由此可知,甘露醇、乳糖作为冻干保护剂时冻干粉外观、色泽、再分散性较优,而蔗糖相对较差;制成缓释片后,片剂外观依次为乳糖>甘露醇>蔗糖,释药速率依次为甘露醇>乳糖>蔗糖,由于释药速率可通过骨架材料及PEG 种类、用量来调节,故选择乳糖作为冻干保护剂。
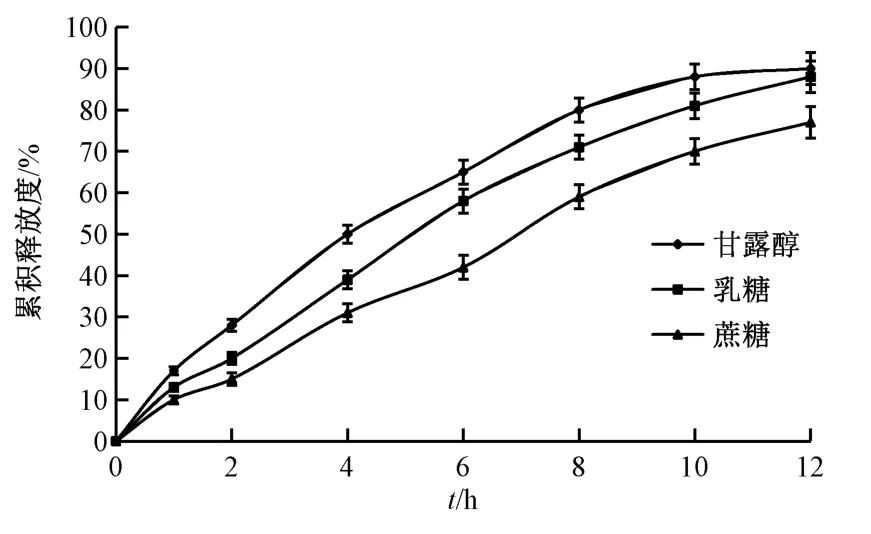
图2 冻干保护剂种类对药物释放的影响Fig.2 Effect of freeze-drying protective agent kind on drug release
然后,取冻干粉约10 mg,加入5 mL 蒸馏水振荡复溶,0.45 μm 微孔滤膜过滤,测定其粒径分布情况,结果见图3,可知平均粒径为(303.76±18.34)nm。另外,冻干粉PDI 为0.152±0.036,Zeta 电位为-(18.17±1.64)mV,与固体脂质纳米粒比较,平均粒径有增大趋势,而Zeta 电位绝对值有减小趋势。
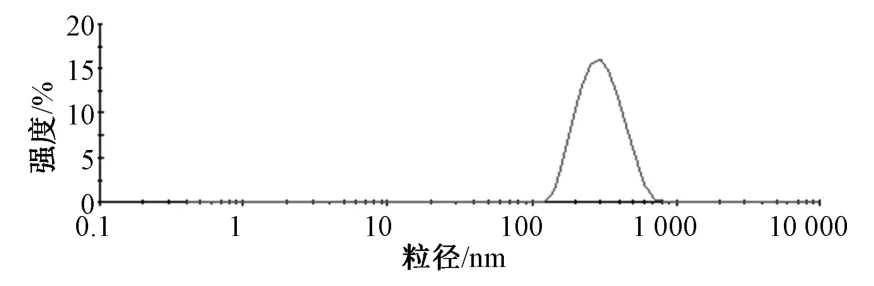
图3 冻干粉粒径分布Fig.3 Particle size distribution of freeze-dried powder
2.6.2 HPMC 15K 用量 选择HPMC 15K 作为缓释材料,乳糖作为冻干保护剂,设定PEG 4000 用量为30 mg/片,硬脂酸镁用量为片芯质量的1.0%,考察HPMC 15K 用量40、50、60 mg/片对药物释放的影响,结果见图4。由此可知,随着HPMC 15K 用量增加,释药速率、12 h 内累积释放度逐渐下降。
2.6.3 PEG 型号 选择乳糖作为冻干保护剂,设定HPMC K15M 用量为50 mg/片,PEG 用量为30 mg/片,硬脂酸镁用量为片芯质量的1.0%,考察PEG 400、PEG 4000、PEG 10000 对药物释放的影响,结果见图5。由此可知,释药速率随着PEG分子量升高而逐渐变慢,故选择PEG 400、PEG 4000联合使用。
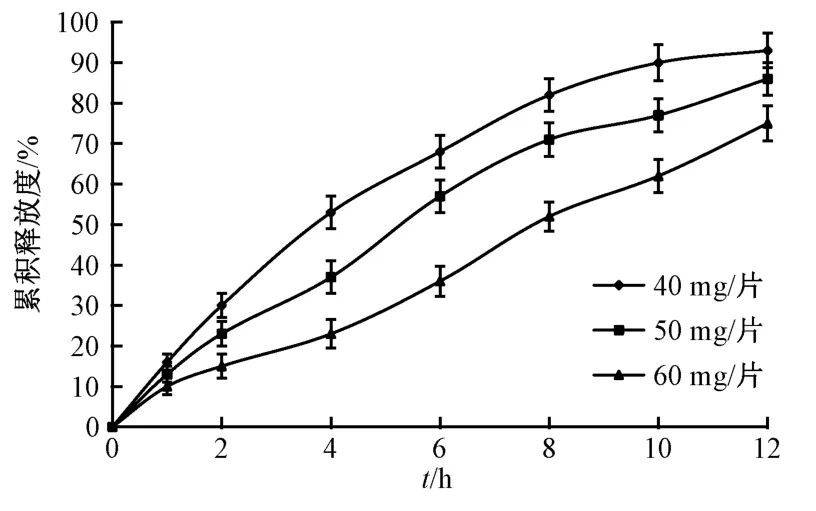
图4 HPMC 15K 用量对药物释放的影响Fig.4 Effect of HPMC 15K consumption on drug release
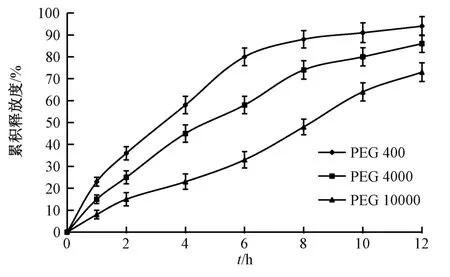
图5 PEG 型号对药物释放的影响Fig.5 Effect of PEG type on drug release
2.6.4 PEG 400 与PEG 4000 比例考察 选择乳糖作为冻干保护剂,设定HPMC K15M 用量为50 mg/片,PEG 用量为30 mg/片,硬脂酸镁用量为片芯质量的1.0%,考察PEG 400 与PEG 4000 比例1∶2、1∶1、2∶1 对药物释放的影响,结果见图6。由此可知,随着两者比例升高,释药速率呈增加趋势。
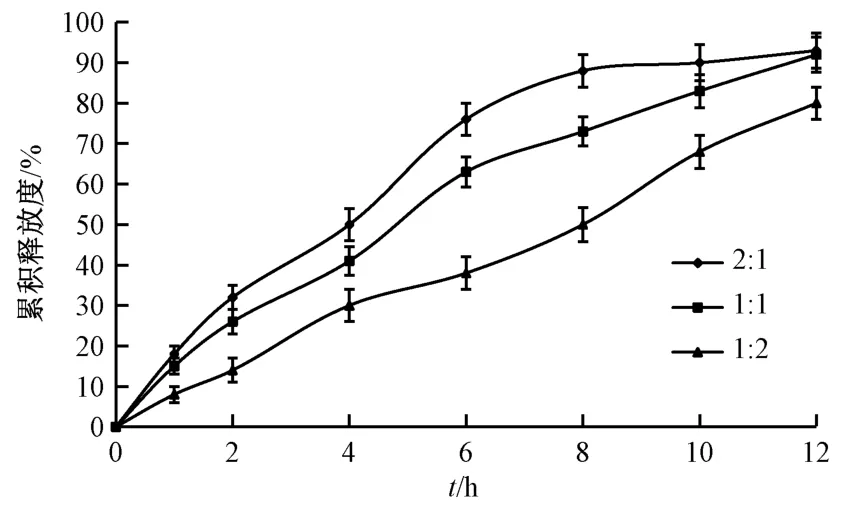
图6 PEG 400 与PEG 4000 比例对药物释放的影响Fig.6 Effect of PEG 400-PEG 4000 ratio on drug release
2.6.5 PEG 用量 选择乳糖作为冻干保护剂,设定HPMC K15M 用量为50 mg/片,硬脂酸镁用量为片芯质量的1.0%,PEG 400 与PEG 4000 比例为2∶1,考察PEG 用量20、25、30 mg 对药物释放的影响,结果见图7。由此可知,随着PEG 用量升高,释药速率逐渐变快。
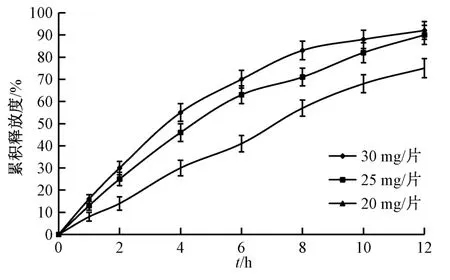
图7 PEG 用量对药物释放的影响Fig.7 Effect of PEG consumption on drug release
2.6.6 硬脂酸镁用量 选择乳糖作为冻干保护剂,设定HPMC K15M 用量为50 mg/片,PEG 400 与PEG 4000 比例为2∶1,PEG 用量为30 mg/片,考察硬脂酸镁用量0.5%、1.0%、1.5% 对药物释放的影响,结果见图8。由此可知,随着硬脂酸镁用量升高,释药速率逐渐下降。
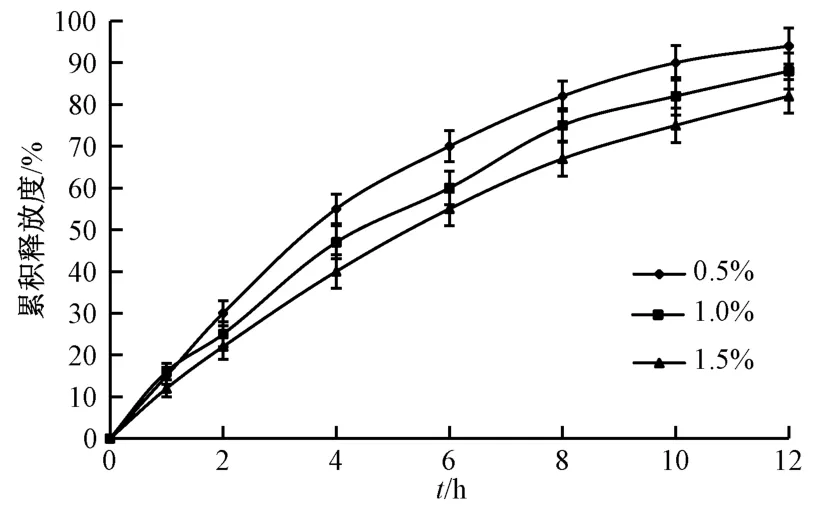
图8 硬脂酸镁用量对药物释放的影响Fig.8 Effect of magnesium stearate consumption on drug release
2.7 正交试验 根据“2.6”项下单因素试验结果,选择HPMC K15M 用量(A)、PEG 400 与PEG 4000 比例(B)、PEG 用量(C)、硬脂酸镁用量(D)作为影响因素,L9(34)正交试验优化处方,因素水平见表1,结果见表2。水凝胶骨架缓释片在初始阶段的累积释放度(L2h)表示是否存在时滞或突释情况,中间阶段的累积释放度(L6h)表示是否存在释放不足或过度释放情况,最后阶段的累积释放度(L12h)表示是否释放完全,综合评分L=|L2h-0.25 | ×100×1 +|L6h-0.60 |×100×1+|L12h-0.95 | ×100×2,以最低者为优。方差分析见表3。
由此可知,各因素影响程度依次为A>C>B>D,其中因素A有明显影响(P<0.05);最优处方为A2B1C3D1,即HPMC K15M 用量50 mg,PEG 400与PEG 4000 比例2∶1,PEG 用量30 mg,硬脂酸镁用量0.5%。
然后,取缓释片体外释放样品,0.45 μm 微孔滤膜过滤后测得平均粒径为(553.44±25.96)nm,PDI 为0.318±0.067,其中前者变大,可能与压片过程中纳米粒受到挤压而发生形变有关;Zeta 电位为-(17.36±1.92)mV,略低于冻干粉,表明制成缓释片后仍有部分药物以纳米粒形式从中释放。

表1 因素水平Tab.1 Factors and levels
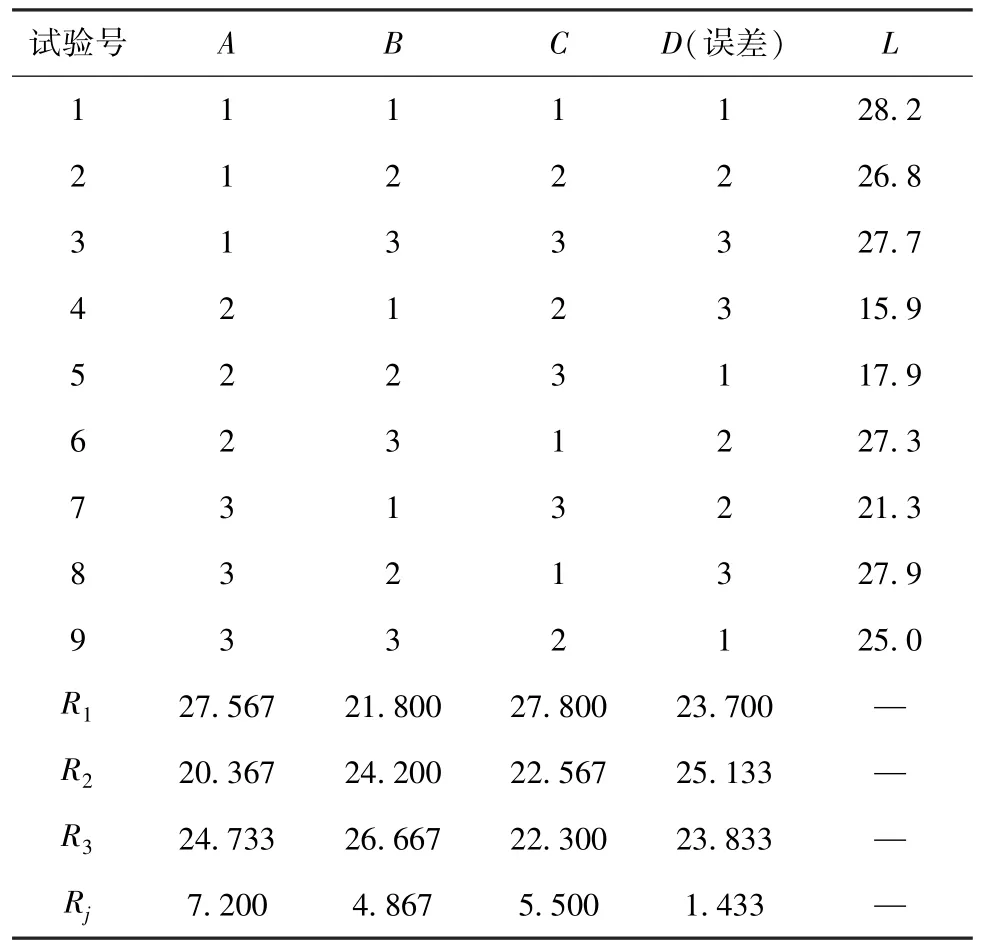
表2 试验设计与结果Tab.2 Design and results of tests
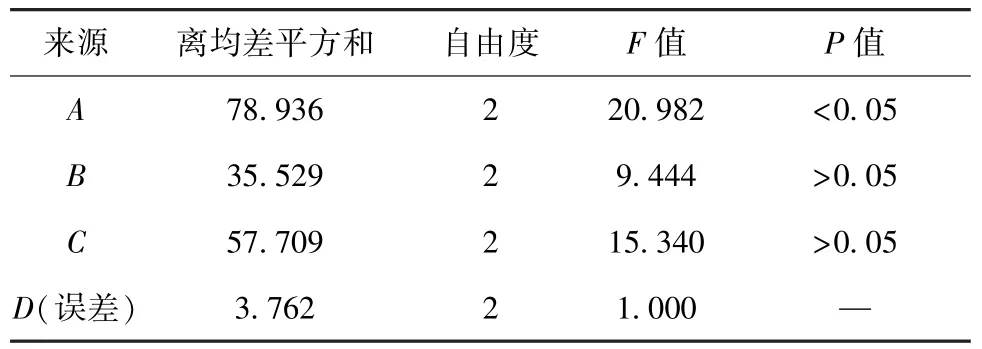
表3 方差分析Tab.3 Analysis of variance
2.8 验证试验及释药机制研究 按“2.7”项下最优处方制备3 批缓释片。按“2.5”项下方法测定释放度,结果见图9。由此可知,该工艺重复性良好,水凝胶骨架缓释片12 h 内累积释放度为93.19%。
然后,对水凝胶骨架缓释片释药情况进行拟合,结果 见表4,可知其符合一级方程(r=0.994 1),而且机制可由Ritger-Pepps 方程描述。对于圆柱形片剂而言,0.45<n<0.89 时为扩散与溶蚀协同作用,而本实验测得n为0.782 6,可知水凝胶骨架缓释片体外释药与上述作用一致。
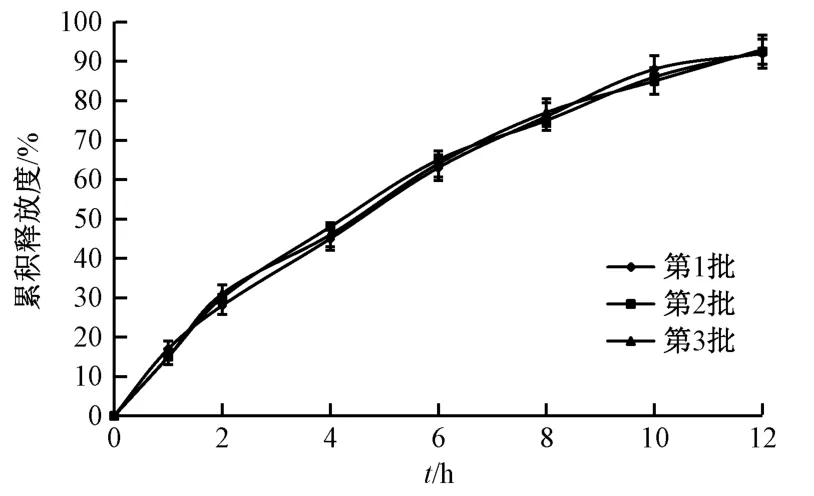
图9 水凝胶骨架缓释片体外释药曲线Fig.9 In vitro drug release curves for hydrogel matrix sustained-release tablets

表4 模型拟合结果Tab.4 Results of model fitting
3 讨论
纳米制剂在促进药物吸收的同时,容易导致血药浓度波动较大,故控制纳米粒在体内缓释越来越受到相关学者的关注[10-11]。前期报道[12],双层渗透泵制剂技术可有效控制纳米粒缓慢释放,但它包有含药层、助推层、包衣膜等,制备工艺复杂;水凝胶骨架缓释片制备工艺简单[13-15],容易实现工业化生产,因此本研究采用该技术将白杨素固体脂质纳米粒制成缓释片,而且并未除去混悬液中的游离药物,故缓释片中大部分是以纳米粒状态存在,少部分以游离状态存在。研究表明[16],胶体溶液中游离药物可不采取分离措施,它与纳米粒中药物处于动态平衡,若分离前者可能会导致纳米粒中药物释放出来;胶体溶液制备冻干粉时可使游离药物吸附于纳米粒,有助于增加后者负载量;缓释片释放度的测定方法并未区分游离药物和纳米药物,而是针对各时间点两者总释放度,由于两者体内吸收情况差别较大,故本实验所得缓释片的体内药动学还需进一步结合动物实验研究。
目前,白杨素市售品大多为保健品,比如白杨素胶囊、蜂胶软胶囊、蜂胶葛根软胶囊等[17-18],每天剂量一般在14.4~50.0 mg 之间,而本实验制备的缓释片剂量约为25 mg/片。另外,缓释片剂量调整可通过改变骨架材料、PEG 用量来实现,今后将研究该剂量是否合适、在比格犬体内药动学等,以期为相关新型保健品或制剂的开发提供借鉴。
