弓形虫SAG1纳米抗体噬菌体文库的构建与鉴定分析*
2020-03-25赵宇豪薛杨继丁豪杰丁建祖卓洵辉孔庆明陆绍红
赵宇豪 薛杨继 丁豪杰 丁建祖 郑 斌 卓洵辉 楼 涤 陈 睿 孔庆明 陆绍红
(杭州医学院寄生虫病研究所,杭州 310013)
刚地弓形虫Toxoplasmagondii,是一种广泛分布的机会性致病原虫,其感染已成为严重的世界性公共卫生问题(Limetal., 2012; Tianetal., 2012; Andiappanetal., 2014; Heddergottetal., 2018)。据统计,世界上约有三分之一的人口弓形虫抗体呈阳性(Robert-Gangneuxetal., 2012)。弓形虫感染可使孕妇流产、死产,影响胎儿发育、严重致畸甚至死亡(Bladeretal., 2015)。目前,弓形虫的诊断已列为我国孕妇优生五项(TORCH)检测指标之一。另外,弓形虫感染与多种恶性肿瘤以及神经精神疾病的发生相关,对人类健康造成较大威胁(Bladeretal., 2015)。弓形虫循环抗原(Circulating antigen, CAg)检测能反映感染虫荷,是早期、现症感染和疗效考核的指标(Wangetal., 2016)。然而,由于一般患者体内CAg的含量非常低,尤其在感染2周后,CAg含量会快速下降至低水平(Lykinsetal., 2018),常规CAg检测方法对于轻度和慢性患者的检出率低、特异性差,无法满足需求(Liuetal., 2015; Gashoutetal., 2016; Rahimi-Esboeietal., 2018)。弓形虫表面抗原蛋白1(Surface antigen 1, SAG1)是CAg中的主要成分,与虫体的入侵与毒力密切相关(Khanalihaetal., 2014; Abdizadehetal., 2015)。
骆驼体内存在一种天然轻链缺失的功能性重链抗体(Heavy chain antibodies,HCAb),克隆该重链抗体的可变区得到最小的抗原结合片段,即纳米抗体(Nanobody,Nb)(Hamers-Castermanetal., 1993)(图1)。纳米抗体相较于普通抗体,具有体积小、溶解度高、稳定性好、体内组织渗透性好等优点(Kunzetal., 2018),其分子量只有15 kDa左右,不足传统抗体(160 kDa)的十分之一,并且很容易通过基因工程技术获得(Bannasetal., 2017)。纳米抗体在抗原结合界面上具有独特的灵活性,能结合到普通抗体无法触及的抗原表位,较小个体使其能够以高密度牢固地结合于固相载体捕捉微量抗原,提高了检测敏感度,具有现症感染和早期诊断价值,在生物医学领域显示出广阔的应用前景(De Meyeretal., 2014; Salvadoretal., 2019)。本研究拟构建弓形虫RH株SAG1蛋白的纳米抗体库,淘选并鉴定SAG1特异的纳米抗体,为弓形虫感染的早期检测试剂研制奠定基础。
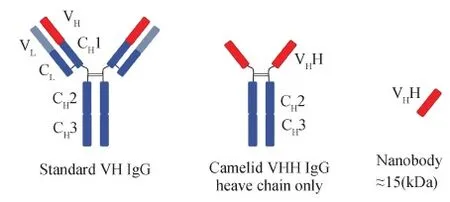
图1 纳米抗体示意图
1 材料与方法
1.1 实验材料
1.1.1虫株、菌株与质粒: 刚地弓形虫RH株、菌株E.coliBL21(DE3)、TG1、WK6和载体pET-28a、pHEN4、pMECS均由本实验室保存。
1.1.2主要试剂: Taq DNA聚合酶、dNTPs、限制性内切酶、T4 DNA连接酶及DNA marker购自Takara 宝生物工程(大连)有限公司,质粒小剂量提取试剂盒、胶回收试剂盒购自天根生化科技(北京)有限公司,蛋白Marker、IPTG、Ni-NTA购自生工生物工程(上海)股份有限公司。
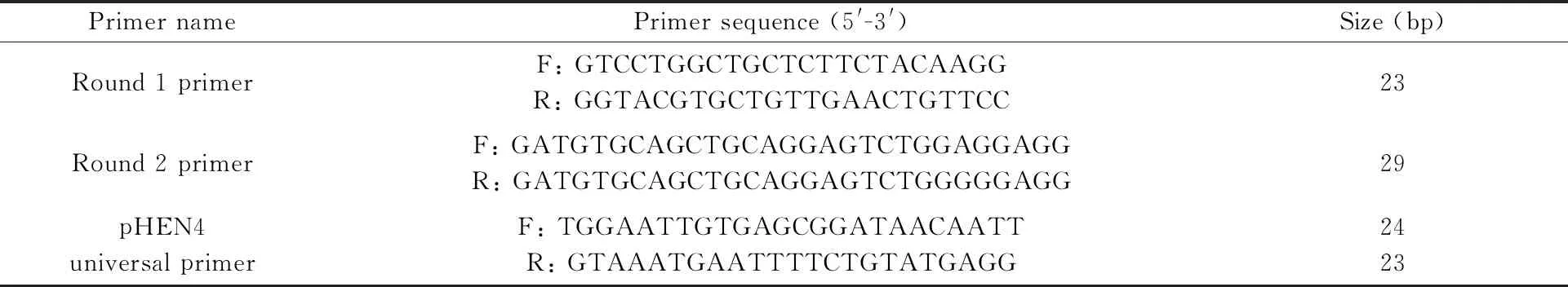
表1 纳米抗体文库构建引物列表
1.2 弓形虫SAG1抗原的制备
根据NCBI上获得的弓形虫RH虫株的SAG1基因序列(HM776940.1)设计特异性引物,PCR扩增基因序列得到片段大小约为780 bp的SAG1目的基因片段,连接pMD19-simple质粒并测序。将测序正确的序列和pET-28a质粒用限制性内切酶BamH I和XhoI酶切,酶切产物经琼脂糖凝胶电泳后,切胶回收,16℃连接过夜,将连接产物转化E.coliBL21(DE3)。将测序正确的阳性克隆接种于2YT (100 μ/mL Ampicillin,2% Glucose)培养基中,培养至OD600值为0.6,加入IPTG(1 mmol/L)进行原核表达,将表达过夜的菌液超声破裂菌体,并以8 mol/L尿素溶解包涵体,离心后,收集上清。SDS-PAGE鉴定后Ni-NTA柱纯化获得重组SAG1(Recombinant SAG1, rSAG1)。
1.3 骆驼免疫及淋巴细胞的分离
将600 μL rSAG1蛋白(1 mg/mL)与弗氏佐剂等体积混合,乳化后颈部皮下注射免疫一只双峰驼Camelusbactrianus,观察注射后包块的吸收状况,以确保免疫效果。初次免疫后每隔两周进行加强免疫,连续3~5次免疫后采血,ELISA检测血清中抗体效价。效价合格后颈静脉取400 mL抗凝血,密度梯度离心法纯化外周血中淋巴单核细胞。
1.4 骆驼免疫抗体文库的构建
使用TRIzol LS Reagent 提取单核细胞总RNA,琼脂糖凝胶电泳鉴定RNA的质与量。反转录后获得cDNA,以cDNA为模板通过巢式PCR进行VHH片段的扩增。限制性内切酶对巢式PCR的终产物和噬菌粒载体pHEN4进行双酶切鉴定,按照目的片段与载体的分子摩尔比3∶1在16℃连接过夜,转化TG1,在辅助噬菌体的作用下形成噬菌体纳米抗体文库,PCR(引物序列见表1)鉴定阳性率并计算抗体库容。
1.5 噬菌体的扩增与分离
取冻存在-80℃中的VHH纳米抗体库TG1菌液,接种至100 mL的YT培养基中,200 r/min、37℃的条件下培养至OD600达到0.45左右,加入1012的辅助噬菌体M13K07,在37℃的恒温培养箱中静置30 min使噬菌体感染TG1菌,静置后4 000 r/min、4℃离心10 min,并将沉淀于300 mL的YT培养基中重悬,37℃、200 r/min 培养过夜。将培养过夜的菌液8 000 r/min、4℃离心30 min,转移上清液至新的离心管中加入1/6的PEG 8000/NaCl溶液,混匀后冰浴30 min。4 000 r/min、4℃离心30 min后,弃上清,将所得的噬菌体用1 mL PBS溶解,13 000 r/min短暂离心5 min后4℃保存。
1.6 抗SAG1纳米抗体文库的淘选
将rSAG1蛋白稀释至30 μg/mL,加入96孔ELISA板中,每孔100 μL,4℃包被过夜。使用含有2% BSA的PBS缓冲液37℃封闭1.5 h。每孔加入100 μL滴度为 2.0×1011cfu/mL的噬菌体展示文库,37℃孵育2 h,使用PBST洗板20次以去除非特异性结合的噬菌体。每孔加入100 μL Gly-HCl(pH 2.2)洗脱液洗脱噬菌体,反复吹打10 min,调节pH至最终为7.0。加入10 mL处于对数期生长的TG1菌和洗脱产物,于37℃中静置感染30 min。分别取20、40、60、80、100 μL菌液涂布于2YT固体培养基中,计算菌落数,按每毫升所含的克隆数目计算滴度。4 000 r/min离心剩余的菌液,使其重悬于2YT培养基中并加入200 μL/mL的甘油,混合均匀后保存于-20℃以备下一轮淘选。第2轮淘选包被浓度为5 μg/mL的SAG1蛋白,同时设置未包被蛋白的阴性对照。
1.7 抗SAG1纳米抗体的phage-ELISA以及序列多态性分析
从上述淘选后的噬菌体平板中随机挑选60个噬菌体进行phage-ELISA,并从phage-ELISA结果中挑选抗原结合能力强的阳性克隆株进行测序,根据测序结果进行阳性克隆株VHH序列多态性分析。

表2 抗SAG1纳米抗体引物
1.8 抗SAG1 VHH纳米抗体的原核表达、纯化和Western-blot鉴定
根据筛选后测序获得的抗SAG1纳米抗体(Anti-SAG1-Nb)基因序列设计引物(表2),扩增出纳米抗体基因片段后连接至表达载体pMECS并测序验证。将构建好的重组载体pMECS-Nb电转化至表达菌株WK6中,以TB培养基(100 μg/mL Ampicillin,0.1% Glucose,2 mmol/L MgCl2),37℃、220 r/min培养至OD600于0.6~0.9,加入IPTG诱导表达,28℃培养16 h。随后,4℃、4 000 r/min离心10 min收集菌液并以渗透压变化法裂解菌体,收集上清,以Ni-NTA纯化Anti-SAG1-Nb,收集纯化后的纳米抗体-20℃保存。
将1.2制备的rSAG1稀释至0.4 mg/mL,SDS-PAGE电泳后以纯化获得的8个Anti-SAG1-Nb系列纳米抗体为一抗(稀释至终浓度5 μg/mL),HRP抗HA标签鼠单抗IgG(CWbio)作为二抗(终浓度为:3 μg/mL),进行Western-Blot检测,设置阴性对照为弓形虫MIC重组蛋白进行SDS-PAGE凝胶电泳,一抗为Nb-Anti-SAG1-Nb-5二抗浓度同上;阳性对照采用自制rSAG1(0.4 mg/mL)上样后以抗SAG1单抗(Thermo Fisher)作为一抗(稀释比例为1∶10, 终浓度为10 μg /mL),HRP羊抗鼠IgG(CWbio)作为二抗(浓度稀释至3 μg/mL)。
弓形虫感染小鼠7 d后收集腹水,纯化获得弓形虫天然膜抗原以及胞质抗原,将膜抗原、胞质抗原以及rSAG1重组抗原稀释至1 mg/mL,SDS-PAGE凝胶电泳后,以纳米抗体Nb-SAG1-5为一抗(稀释至终浓度为5 μg/mL),HRP抗HA标签鼠单抗IgG(CWbio)作为二抗(浓度同上),进行Western-Blot检测。
1.9 抗SAG1纳米抗体亲和性测定分析
制备好的rSAG1抗原稀释后进行生物素标记。用脱盐柱脱去未结合的生物素后,将SA传感器末端润湿后置于处理好的上述SAG1抗原中进行固化。将待测抗SAG1纳米抗体用PBS稀释至浓度为6.25、12.5、25、50、100 nmol/L,每组样品总体积200 μL。将稀释后的待测纳米抗体样品和空白对照置于96孔板中,采用ForteBio Octet Red 生物分子互作仪对待检样品进行检测。利用Octet数据分析软件CFR Part 11 Version 6.x对得到的数据进行分析,经过数据拟合后得到纳米抗体的结合常数Kon值、解离常数Kdis值以及亲和常数KD值。
2 结果
2.1 SAG1噬菌体纳米抗体免疫文库的构建
弓形虫rSAG1抗原表达纯化后经SDS-PAGE鉴定,蛋白分子量约为28 kDa。以rSAG1免疫骆驼,第4次免疫后检测效价,结果显示抗血清稀释比为1∶51 200时,OD490为0.2左右(P/N≥2.1),符合建库要求。巢式PCR扩增获得大小约400 bp的VHH目的片段(图2-A)。平板计数测得文库库容为3.6×109cfu/mL,滴度为1.99×1013pfu/mL。为鉴定VHH基因的插入率,随机挑选20个单菌落并PCR鉴定,(图2-B-1/2)有18个扩增出大小约为500~750 bp目的条带,由此推断阳性率为90%。因此,构建的噬菌体展示文库实际库容为3.24×109cfu/mL。

表3 各轮淘选噬菌体滴度和富集度

表4 阳性克隆phage-ELISA结果
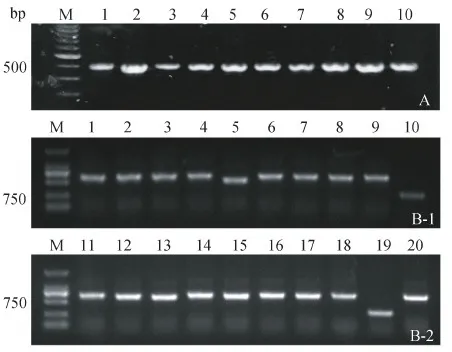
图2 SAG1噬菌体展示纳米抗体免疫文库的构建
2.2 特异性纳米抗体库的淘选与鉴定
使用rSAG1淘选后,特异性噬菌体得到有效富集,富集度达到3.75×103(表3)。随机挑选40个阳性克隆进行测序,将基因序列翻译成氨基酸序列并进行Blast比对,超变区CDR1、CDR2和CDR3序列相同的株视为同一克隆株,结合噬菌体ELISA结果,1、2、5、7、14、15、38、40号8个代表克隆株归属为3个不同分支(图3),其中1、5、15号3个克隆株与抗原结合能力较强(表4)。
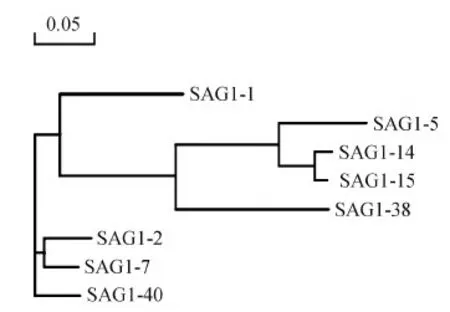
图3 抗SAG1纳米抗体同源性比对分析
2.3 抗弓形虫SAG1系列纳米抗体的诱导表达、纯化以及Western-blot鉴定
将以上8个阳性克隆的VHH基因亚克隆至表达载体pMECS,诱导表达纯化后SDS-PAGE鉴定分子量大小与纯度,以Nb-SAG1-5为例(图4-A),所得抗SAG1系列纳米抗体大小约为17 kDa。Western-blot鉴定结果表明以上表达的8个纳米抗体均可与重组蛋白rSAG1发生反应(图4-B-1/2),其中Nb-SAG1-5、Nb-SAG1-14、Nb-SAG1-38以及Nb-SAG1-40对于rSAG1的WB结果较其他4个抗体均有更明显且单一的条带。后续采用刚地弓形虫RH株免疫小鼠后获得的天然膜抗原以及胞质抗原进行WB实验,结果显示:Nb-SAG1-5能够与弓形虫免疫小鼠获得的天然抗原发生特异性结合反应产生明显且单一的目的条带(图4-C)。
2.4 抗SAG1纳米抗体Nb-SAG1-5的亲和力测定
采用生物膜干涉技术对表达的Nb-SAG1-5纳米抗体进行亲和力检测,利用Octet数据分析软件CFR Part 11 Version 6.x 对结合动力学结果数据拟合获得Anti-SAG1-Nb-5的结合常数Kon值、解离常数Kdis值以及亲和常数KD值。其中,Anti-SAG1-Nb-5与rSAG1的KD值为1.66 nmol/L。
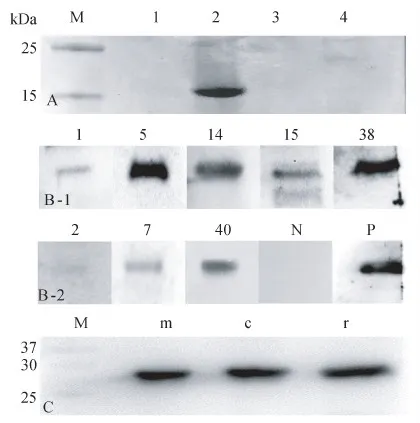
图4 抗弓形虫SAG1纳米抗体的表达、纯化以及Western-blot鉴定
3 讨论
近年来,新型基因工程抗体不断出现,抗体小型化是抗体基因工程的主要研究方向之一(Robert-Gangneuxetal., 2012; Bannasetal., 2017; Salvadoretal., 2019)。纳米抗体是克隆骆驼体内功能性重链抗体的可变区得到的最小抗原结合片段,具有常规单域抗体无法比拟的水溶性和构象稳定性,能高特异性、高亲和力地结合抗原。纳米抗体能够以高密度牢固地结合于固相载体捕捉微量抗原,已用于前列腺特异膜抗原(Zareetal., 2014; Hassanietal., 2019)、中毒性休克综合征毒素-1(Adamsetal., 2009; Kongetal., 2014;)等在临床体外检测中较难检出的靶点、毒素等。在寄生虫学领域,关于锥虫(Odongoetal., 2016; Stijlemansetal., 2017; Pinto Torresetal., 2018)、犬弓蛔虫(Morales-Yanezetal., 2019a; Morales-Yanezetal., 2019b)、日本血吸虫(郑斌等,2016; 丁豪杰等,2017)等相关的纳米抗体制备与应用也已有报道。
本研究首次成功构建了弓形虫SAG1纳米抗体噬菌体文库,其实际库容约为3.24×109cfu/mL,与已报到的纳米抗体文库数据比较后证实具有较高的库容(Xuetal., 2018; Bannasetal., 2017)。本研究首次成功构建了弓形虫SAG1的纳米抗体文库,淘选制备了8个抗弓形虫SAG1纳米抗体,分子量为17 kDa左右,大小约为分子量为30 kDa的单链抗体(scFv)的1/2,并且易表达,经NI-NTA亲和层次和AKTA系统纯化产量可达到5~10 mg/mL。本研究中所筛选获得的纳米抗体均能与重组SAG1蛋白发生特异性反应,其中Anti-SAG1-Nb-5能够与小鼠免疫弓形虫RH株后提纯获得的天然抗原特异性反应,且Anti-SAG1-Nb-5与弓形虫rSAG1重组抗原亲和常数为1.66×10-9mol/L,达到纳摩尔级的亲和力。与已报道的纳米抗体亲和常数(10-7~10-8mol/L)(孙庆明等, 2014; 李日飞等, 2018)比较后证实,本研究所制备的纳米抗体Anti-SAG1-Nb-5与抗原的结合活性较高。分析认为,在本研究免疫骆驼与淘选文库的过程中使用的是原核表达的SAG1,其构象与天然SAG1存在差异,故针对筛选出来的纳米抗体个数较少且部分纳米抗体无法与弓形虫天然抗原特异性识别的问题,后期可以尝试真核表达系统制备SAG1进行骆驼免疫和纳米抗体文库的淘选,或通过构建双价或多价的纳米抗体以提升其亲和力(Beirnaertetal., 2017; Sadeghietal., 2019),有望找到更多高亲和力、高特异性的纳米抗体。
目前弓形虫病的临床诊断需要合并临床症状与流行病史,同时符合病原学分离阳性、核酸阳性或循环抗原(CAg)阳性中的任一条。传统的直接镜检、动物接种等病原学检查方法费时费力、检出率低,易漏检,无法满足早期诊断要求。分子生物学诊断如以弓形虫基因组中SAG1、B1和529 bp重复序列等为靶基因建立的PCR和环介导等温扩增(loop-mediated isothermal amplification, LAMP)等核酸快速检测技术具有准确率以及灵敏度高等优点(Holec-Gasior, 2013),但核酸检测的方法并不适用于弓形虫隐形感染、产前诊断以及免疫缺陷患者的诊断(Mengetal., 2012),并且分子诊断技术容易形成气溶胶污染,加之目前国内大多是实验室不能做到严格分区,存在一定的假阳性。我国目前经过国家食品药品监督管理总局批准的弓形虫检测试剂只包含IgG和IgM抗体的检测,IgM抗体阳性具有弓形虫感染早期诊断价值,不能作为急性感染的诊断依据(Abdizadehetal., 2015);IgG阳性则可作为有感染发生的参考依据但不能确定感染时间,不能区分是过往感染还是现症感染(Holec-Gasioretal., 2012)。免疫学诊断方法建立在抗原抗体之间的免疫学反应,通过特异性结合的抗原或是抗体实现彼此检测识别与检测的目的。虽然免疫诊断法是弓形虫病实验诊断的主要手段,但目前仍以弓形虫抗体检测为主,对弓形虫抗原的检测迄今未取得突破性进展。本研究成功制备的弓形虫纳米抗体在免疫反应中具有良好的敏感性,下一步我们将继续对已经构建的弓形虫纳米抗体文库进行限制性条件筛选,同时也会对所获得的弓形虫纳米抗体进行适当的改造,以期实现弓形虫早期感染的体外快速诊断试剂的研制。
