高脂饮食对法尼醇受体(FXR)敲除小鼠糖脂代谢及肝脏脂肪变性的影响研究*
2020-03-24李进鹏王效聪秦珍珍郑鹏远
李进鹏 梅 璐 王效聪 秦珍珍 张 晗 郑鹏远
(郑州大学第五附属医院消化内科,郑州大学马歇尔医学研究中心,郑州 450000)
在世界范围内,非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)的患病率正在上升,2018年全球平均发病率大约为25%[1]。它是一种复杂的疾病,包括单纯性脂肪肝、非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)和相关的肝硬化[1-2]。其中,NASH是NAFLD危及生命的阶段的转折点[3]。NASH发生肝纤维化的风险增加,肝纤维化可发展为肝硬化、肝细胞癌和终末期肝病[4]。值得注意的是,目前NASH的患病率已高达全球人口的5%,但仍缺乏有效的治疗手段[3]。因此,积极防治NAFLD具有重要的临床意义。
FXR是一种可被胆汁酸激活的受体,主要存在于肠道、肝脏、肾脏等器官中[5],其在糖类、脂肪、蛋白质、胆汁酸等代谢中起重要作用[6-7]。正如Amano等[8]和Schmitt 等[9]报道一样,FXR被拮抗或者缺失,将会加重糖脂代谢紊乱,引起肝脏脂肪变性,甚至纤维化。目前FXR激动剂已应用于临床中NAFLD的治疗,表现出一定的效果[10]。
目前许多关于NAFLD的相关研究仍需要依赖于动物模型,以往研究关于NAFLD的常见动物模型有ob/ob小鼠、LDLr-/-小鼠、ApoE-/-小鼠等[11]。本实验以高脂饮食诱导FXR-/-小鼠建立NAFLD,为本课题组下一步研究联合益生菌靶向激动肠道FXR以改善高脂饮食小鼠的NAFLD提供了必备条件。
1 材料与方法
1.1 材料
1.1.1实验动物:6只(3雄3雌)FXR+/-小鼠购买于赛业(苏州)生物科技有限公司,实验动物生产许可证号:SCXK(苏)2018-0003,品系名C57BL/6-Nr1h4 tm1cyagen。经过3代繁殖,第3代得到FXR-/-小鼠30只(17雄13雌)。20只6周龄C57BL/6野生型雄鼠购买于北京维通利华实验动物技术有限公司,实验动物生产许可证号:SCXK(京)2016-0006。实验经郑州大学伦理委员会批准。
1.1.2试剂和仪器:辐照灭菌维持饲料和辐照灭菌杨木刨花垫料,江苏协同医药生物工程有限责任公司,苏饲证(2014)01008;45%高脂饲料(蛋白质20kcal%,碳水化合物35 kcal%,脂肪45 kcal%),北京华阜康生物科技股份有限公司[许可证号SCXK(京)2014-0004;胰岛素溶液,江苏万邦生物医药集团有限责任公司[国药准字:H10890001];血清指标(TC、TG、HDL-C、LDL-C、ALT、AST、TBA)试剂检测盒(深圳库贝尔生物科技股份有限公司);引物(苏州金唯智生物科技有限公司);总RNA抽提试剂TRIzol试剂(宝日医生物技术有限公司);逆转录试剂盒ReverTra Ace© qPCR RT Kit(东洋纺生物科技有限公司);RT-PCR试剂盒QuantiNova SYBR Green PCR Kit(凯杰生物技术有限公司);HE染色试剂盒(生工生物工程股份有限公司);自动生化分析仪(深圳库贝尔生物科技股份有限公司);血糖仪和LightCycler 480Ⅱ实时荧光定量PCR仪(Roche,瑞士);全自动脱水机、组织石蜡包埋机、轮转式切片机、摊片机、烘片机(Leica,德国)。
1.2 方法
1.2.1实验动物分组:实验动物适应性饲养1周后开始实验。从20只6周龄C57BL/6雄鼠中随机选取12只,分为2组,每组6只,记为ND(WT)组和HFD(WT)组。从17只6周龄FXR-/-雄鼠中随机选取12只,分为2组,每组6只,记为ND(FXR-/-)组和HFD(FXR-/-)组。
1.2.2建立实验模型: ND组给予辐照灭菌维持饲料喂养12周,HFD组给予45%高脂饲料喂养12周。实验小鼠均饲养于SPF级环境中,温度22~24 ℃,湿度65%~70%,自由饮水和进食,白昼-黑夜12 h循环。喂养过程中注意观察小鼠毛发、精神状态等一般情况有无异常,每周记录一次小鼠体质量变化。小鼠处死前1周行腹腔注射胰岛素耐量试验(insulin tolerance test, ITT)和腹腔注射葡萄糖耐量试验(intraperitoneal glucose tolerance test, IPGTT)。处死后留取标本。
1.2.3实验操作
ITT:实验前小鼠禁食12 h。胰岛素溶液按照75U/kg体质量剂量进行腹腔注射。血糖仪分别于0、15、30、60、90、120 min检测小鼠血糖。
IPGTT:实验前小鼠禁食12 h。20%葡萄糖溶液按照10 mL/kg剂量进行腹腔注射。血糖仪分别检测0、15、30、60、90、120 min时间点血糖。
血清指标检测:采用自动生化分析仪和检测试剂盒测定血清中TC、TG、HDL-C、LDL-C、ALT、AST、TBA等指标。
实时荧光定量PCR:TRIzol试剂提取小鼠肝脏总RNA,通过逆转录试剂盒获得cDNA。以GAPDH为内参,通过2-ΔΔCt法计算mRNA相对表达量。

表1 引物序列Table 1 Primer sequences
HE染色:取适量4%多聚甲醛固定好的小鼠肝脏,经脱水、包埋、切片、摊片、捞片、烘片等步骤依次处理后,采用HE染色试剂盒进行染色。显微镜下观察肝脏脂肪变性程度。
肝脏脂滴的平均数量和平均大小:HE染色完成后,电子显微镜拍照。利用Image J软件处理HE图片,导出数据进一步分析。具体如参考文献所示[12]。
1.3 统计方法
利用SPSS 22.0软件进行数据分析,采用ANOVA统计方法。其中P<0.05,P<0.01。作图采用GraphPad Prism 8.0软件。
2 结果
2.1 小鼠体质量、ITT、IPGTT、IPGTT曲线下面积及肝脏指数水平改变
与ND(WT)组相比,ND(FXR-/-)组小鼠体质量变化无差异。HFD(WT)组和HFD(FXR-/-)组小鼠体质量自第3周开始,体质量出现显著增加(P<0.01)(图1A箭头所指),而HFD(WT)组和HFD(FXR-/-)组小鼠体质量无差异(图1A)。在ITT中,ND组小鼠血糖下降最低值出现在30 min左右,HFD(WT)组和HFD(FXR-/-)组小鼠表现出明显胰岛素抵抗,注射胰岛素后,其血糖下降最低值出现在60~75 min左右,其中HFD(FXR-/-)组小鼠各时间点血糖均高于HFD(WT)组(P<0.05)(图1B)。在IPGTT中,HFD(FXR-/-)组小鼠表现出极其严重的糖耐量受损,IPGTT曲线下面积提示HFD(FXR-/-)小鼠曲线下面积高于HFD(WT)组(P<0.01)(图1C和图1D)。为了观察小鼠肝脏大小变化情况,我们计算了小鼠肝脏指数(肝脏质量/小鼠体质量),各组之间无统计学差异(图1E)。
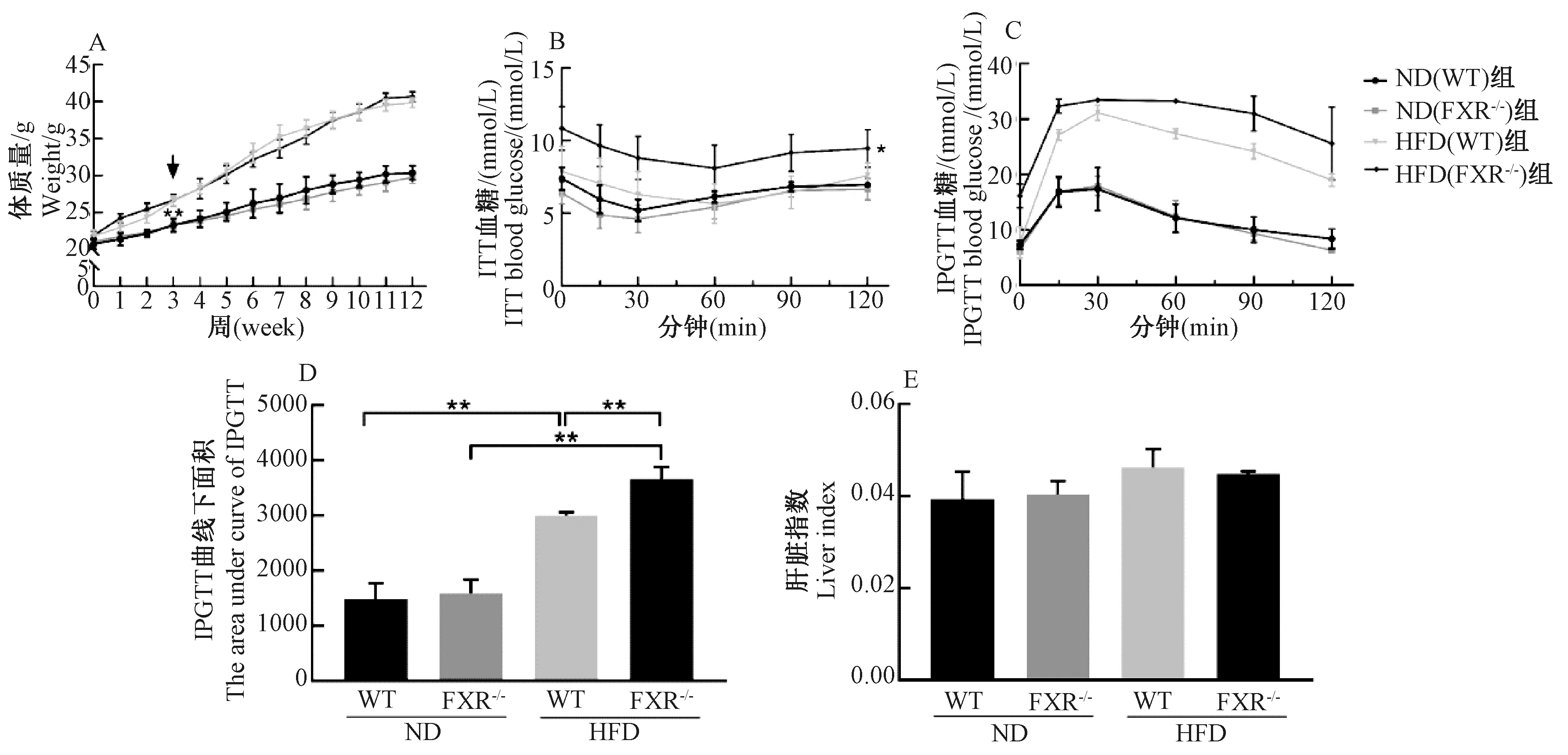
图1 各组小鼠体质量、ITT、IPGTT、IPGTT曲线下面积及肝脏指数水平注:ITT,胰岛素耐量试验;IPGTT,腹腔注射葡萄糖耐量试验。*P<0.05,**P<0.01Fig.1 Body weight, ITT, IPGTT, the area under curve of IPGTT and liver index in the different groups of miceNote:ITT, insulin tolerance test; IPGTT, intraperitoneal glucose tolerance test. *P<0.05, **P<0.01
2.2 小鼠血清血脂水平及肝功能变化
与ND(WT)组相比,HFD(WT)组小鼠血清TC、TG和LDL-C含量均明显增加(P<0.01)。相比HFD(WT)组,HFD(FXR-/-)组小鼠血清TC、TG和LDL-C含量出现显著性升高(P<0.01)(图2 A、图2B和图2C)。与ND(WT)组相比,ND(FXR-/-)组小鼠HDL-C含量无差异,HFD(WT)组小鼠血清HDL-C含量降低(P<0.05)。与HFD(WT)组相比,HFD(FXR-/-)组小鼠血清HDL-C含量显著性升高(P<0.01)(图2D)。与ND(WT)组相比,ND(FXR-/-)组和HFD(WT)组小鼠血清ALT含量无变化,HFD(FXR-/-)组小鼠血清ALT含量约为HFD(WT)组2倍(P<0.01)(图2E)。ND(WT)组和HFD(WT)组小鼠血清AST含量无差异。相比HFD(WT)组,HFD(FXR-/-)组小鼠血清AST含量上升(P<0.05)(图2F)。
2.3 小鼠肝脏炎症因子、FXR下游基因及清道夫受体B族1型(scavenger receptor type-B1, SR-B1)表达水平
与ND(WT)组相比,HFD(WT)组小鼠肝脏炎症因子TNF-α和TLR4相对表达量无差异。与HFD(WT)组小鼠相比,HFD(FXR-/-)组小鼠TNF-α和TLR4相对表达量明显增加,分别约为HFD(WT)组的2.5倍和15倍(P<0.01)(图3A和图3B)。与ND(WT)组相比,ND(FXR-/-)组小鼠肝脏SHP表达量明显下降,而HFD(WT)组小鼠肝脏SHP表达量增加(P<0.01)。和HFD(WT)组相比,HFD(FXR-/-)组小鼠肝脏SHP表达量下降更明显(P<0.01)(图3C)。与ND(WT)组相比,ND(FXR-/-)组小鼠肝脏CYP7A1表达量明显增加(P<0.01),HFD(WT)组小鼠肝脏CYP7A1表达量无变化。同样的,HFD(FXR-/-)组小鼠肝脏CYP7A1表达量为HFD(WT)组的5倍(图3D)。检测血清中胆汁酸含量,与ND(WT)组相比,HFD(WT)组小鼠血清胆汁酸含量无差异。ND(FXR-/-)组小鼠血清胆汁酸含量约为ND(WT)组的9倍,HFD(FXR-/-)组小鼠血清胆汁酸含量约为HFD(WT)组的27倍(P<0.01)(图3E)。与HFD(WT)组相比,HFD(FXR-/-)组小鼠肝脏SR-B1相对表达量下降,约为HFD(WT)组的1/4(P<0.01)(图3F)。
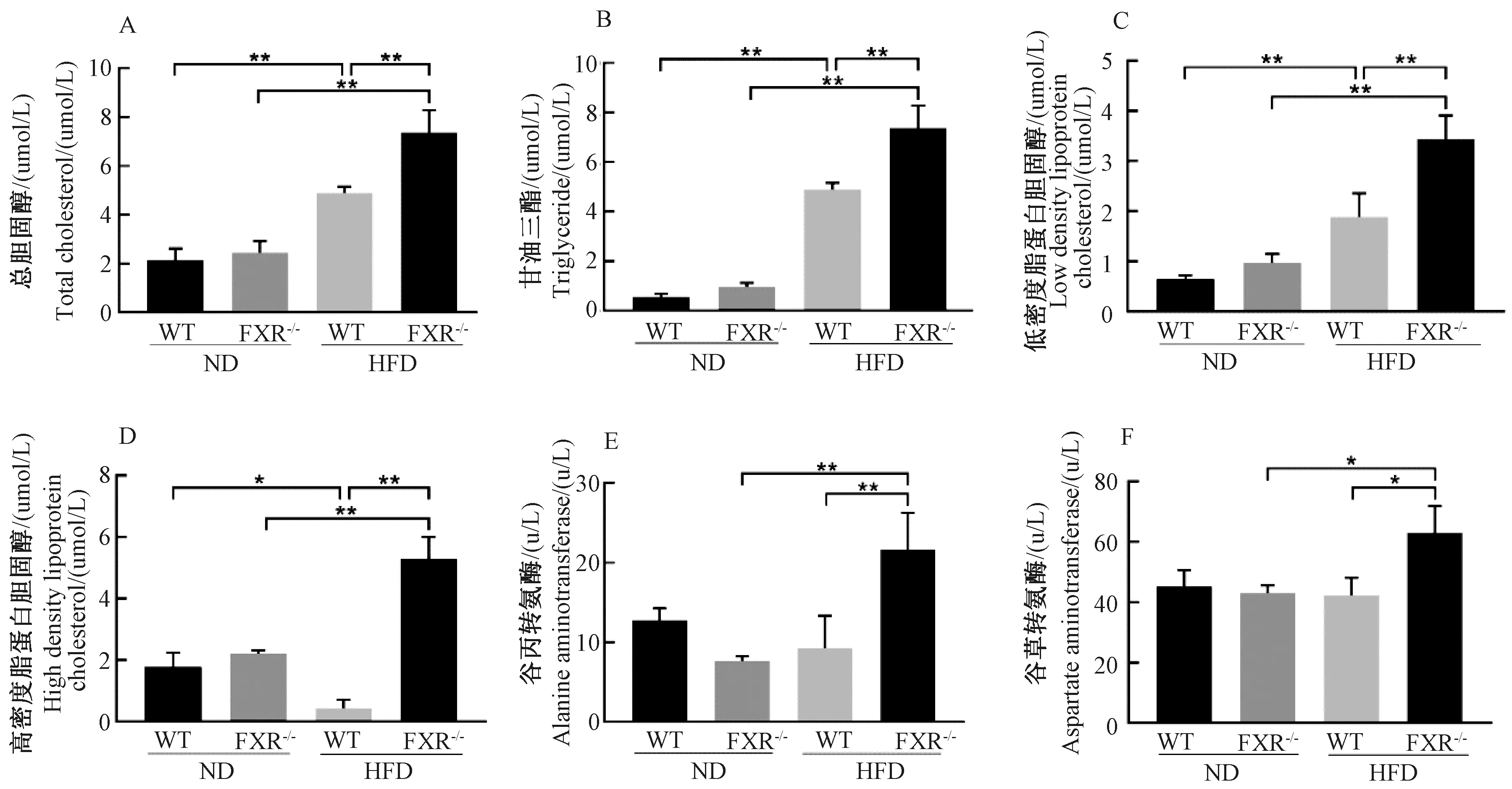
图2 各组小鼠血清指标水平注:*P<0.05,**P<0.01Fig.2 The levels of serum index in the different groups of miceNote:*P<0.05, **P<0.01
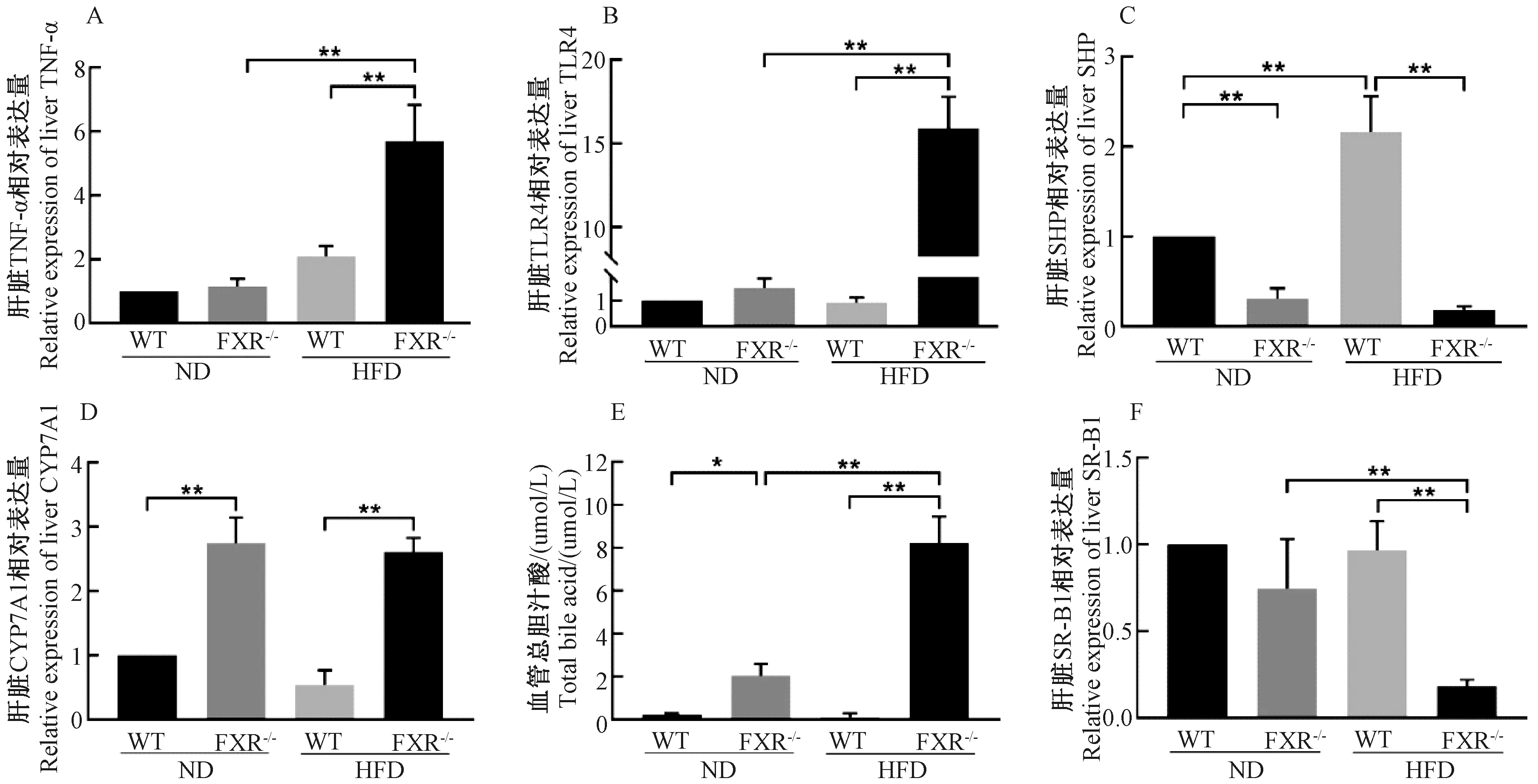
图3 各组小鼠肝脏炎症因子、FXR下游基因及清道夫受体B族1型(SR-B1)表达水平注:TNF-α,肿瘤坏死因子α;TLR4,Toll样受体4;SHP,小分子异源二聚体;CYP7A1,胆固醇7α-羟化酶;SR-B1,清道夫受体B族1型。*P<0.05,**P<0.01Fig.3 Expression of liver inflammatory factors, downstream genes of FXR and scavenger receptor B group 1 (SR-B1) in the different groups of miceNote: TNF-α, tumor necrosis factor α; TLR4, Toll-like receptor 4; SHP, small heterodimer partner; CYP7A1, cholesterol 7α-hydroxylase; SR-B1, scavenger receptor B family type 1.*P<0.05, **P<0.01
2.4 小鼠肝脏HE染色病理和脂滴分析
ND(WT)组和ND(FXR-/-)组小鼠镜下肝脏结构正常。 HFD(WT)组小鼠镜下肝索结构排列紊乱,整个肝小叶散在出现脂肪空泡,并胞内空泡变性程度近中央静脉处较轻,未见炎细胞浸润。HFD(FXR-/-)组小鼠镜下肝索排列紊乱,肝细胞混浊肿胀,视野内出现大量脂肪空泡,并空泡变性程度近中央静脉处越明显,偶见炎细胞浸润(图4)。利用Image J软件,我们对HE图片进行了量化处理,计算了相同视野下脂滴的平均数量和平均大小,并对数据进一步处理。结果表明,在相同视野下,HFD(FXR-/-)组小鼠脂滴数量明显多于HFD(WT)组(P<0.01)(表2和图5A)。HFD(WT)组小鼠脂滴中以200~400大小范围为主,而HFD(FXR-/-)组小鼠>800大小范围的脂滴占据了60%左右(图5B)。这些结果表明,在相同高脂饮食条件下,FXR-/-小鼠肝脏脂肪病变更为严重,脂滴以大泡病变为主。
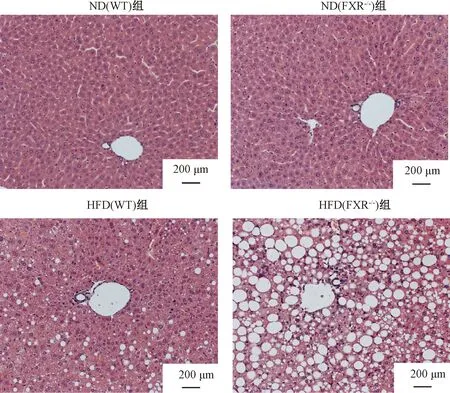
图4 小鼠肝脏HE染色注:放大倍数 ×200Fig.4 Mice liver HE stainingNote:magnification ×200
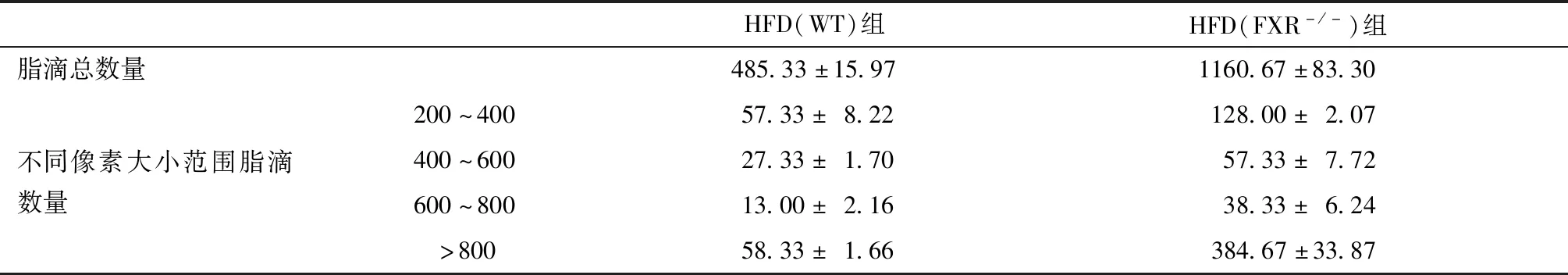
表2 肝脏脂滴平均数量Table 2 The average number of liver lipid droplets
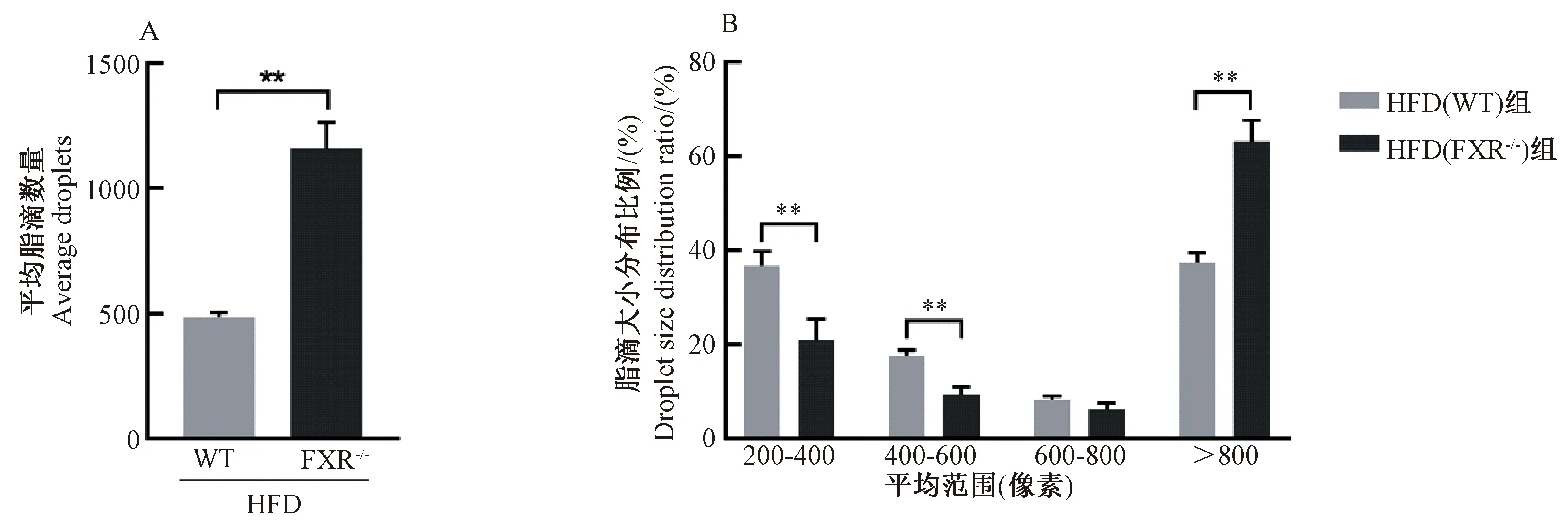
图5 肝脏脂滴数量和不同大小脂滴所占比例注:数据来源于Image J软件分析处理肝脏HE图片结果Fig.5 Calculation of the average number of liver lipid droplets and average droplet sizeNote: The data comes from the analysis results of liver HE images by Image J software
3 讨论
FXR在体内主导胆汁酸代谢,同时也是糖类、脂肪、蛋白质等代谢的关键因素[13-14]。早在2000年,Sinal等[15]已经证实FXR-/-小鼠能够诱导肝脏胆汁酸水平升高和肝脏损伤,进而引起肝脏脂肪变性、炎症和纤维化。本文引文中提到的ob/ob小鼠,是作为饱食模型,促进小鼠形成NAFLD。LDLr-/-小鼠和ApoE-/-小鼠是通过影响脂蛋白合成或者分泌以诱导NAFLD的形成[11]。这些模型都是通过某一方面因素干预NAFLD的形成。而本实验选取FXR-/-小鼠,是因为FXR的缺失能够导致糖脂代谢紊乱、胆汁酸升高、肝脏脂肪变性形成[13-15]。换句话说,小鼠体内FXR被激动之后,可以缓解这些代谢紊乱,进而减轻NAFLD。
在Cariou等[16]和Ma等[17]实验中,通过高胰岛素-正葡萄糖钳夹技术实验证实,FXR-/-小鼠出现严重的糖耐量受损和外周胰岛素抵抗,反映为对外周葡萄糖处理能力减弱。我们研究发现,HFD(FXR-/-)组小鼠表现出极其明显的胰岛素抵抗及糖耐量受损,ITT中血糖下降缓慢且不明显。IPGTT中各时间点血糖明显升高且血糖峰值后移,IPGTT曲线下面积明显高于其他组小鼠。HFD(WT)组小鼠虽也表现出胰岛素抵抗及糖耐量受损,但程度远不如HFD(FXR-/-)组。
同时我们也检测了血脂谱及肝功能变化,TC、TG、LDL-C、AST及ALT变化和预期相符,HFD(FXR-/-)组小鼠含量均高于其他组,表现出明显的脂质代谢紊乱和肝功能受损。值得关注的是HDL-C含量的变化,HDL-C通常被认为是一种保护性因子,可将胆固醇从肝外组织转运到肝脏进行代谢,再由胆汁排出体外,被称为“好胆固醇”[18-19]。但在本实验中,HFD(FXR-/-)组小鼠的HDL-C反而明显增加。有研究表明,高脂饮食的FXR-/-小鼠肝脏清道夫受体B族1型(SR-B1)水平降低,而SR-B1在HDL-C转运中起重要作用[15,19-20]。我们考虑在FXR-/-小鼠中观察到的血浆HDL-C水平升高是由于肝脏对HDL-C的选择性摄取减少,并非HDL-C产生增多,这可能与SR-B1的表达下降有关。为此我们检测了各组小鼠肝脏SR-B1表达情况,结果表明HFD(FXR-/-)组小鼠肝脏SR-B1相对表达量明显下降,约为HFD(WT)组的1/5。
我们进一步检测了肝脏炎症因子指标,HFD(FXR-/-)组小鼠中TNF-α和TLR4相对表达量均明显增加,肝脏炎症明显。值得注意的是,相比普通饮食,高脂饮食条件下C57BL/6小鼠肝脏炎症水平并未增加。FXR在胆汁酸代谢中起主导作用,在肝脏中主要通过FXR→SHP→CYP7A1轴调节胆汁酸代谢[21],因此我们检测了肝脏SHP、CYP7A1的表达水平。ND(FXR-/-)组和HFD(FXR-/-)组小鼠中SHP表达量均出现下降,是因为在FXR-/-小鼠中SHP失去了上游靶基因FXR的激动。但HFD(FXR-/-)组小鼠SHP表达量下降更明显,我们推测高脂饮食会进一步减弱FXR轴功能。CYP7A1受其上游靶基因FXR、SHP的负反馈调节,它是胆汁酸经典合成通路的关键酶,调节机体胆汁酸合成[21-22]。CYP7A1变化趋势与SHP相反。血清中胆汁酸含量也如预期结果,在FXR-/-小鼠中CYP7A1失去了上游靶基因控制后含量明显增加,促进肝脏胆汁酸的合成,ND(FXR-/-)组和HFD(FXR-/-)组小鼠血清胆汁酸含量均明显增加,但HFD(FXR-/-)组小鼠血清胆汁酸含量为ND(FXR-/-)组4倍,进一步证实高脂饮食对FXR轴功能的影响。
肝脏HE染色及脂滴分析结果显示HFD(FXR-/-)组小鼠肝脏出现弥漫大泡性脂肪空泡,同时可观察到间质偶有炎症细胞浸润。这些变化与前文提到的糖脂代谢紊乱、肝脏炎症、肝功能受损一起表明,高脂饮食诱导FXR-/-小鼠可引起糖脂代谢紊乱和肝脏脂肪变性。
虽然高脂饮食诱导FXR-/-小鼠表现出极其明显的代谢紊乱和肝脏大空泡脂肪变性,符合NAFLD疾病特征。但仍存一定缺陷,比如FXR+/-小鼠的制备过程长(4~6个月)、花费较高(约3000~4000元/只)、FXR-/-小鼠繁殖周期长(本课题组繁殖长达8个月)。但FXR-/-小鼠的应用,为进一步研究评价FXR激动剂对小鼠NAFLD的治疗效果提供基础。
综上所述,高脂饮食诱导FXR-/-小鼠可导致其产生明显的糖脂代谢紊乱、胆汁酸代谢异常、肝功能异常及肝脏脂肪变性。
