实验小鼠细小病毒(MMV)抗体的实验室检测能力验证结果评价*
2020-03-24李晓波王淑菁冯育芳王莎莎岳秉飞
王 吉 李晓波 王 洪 付 瑞 李 威 王淑菁 冯育芳 王莎莎 岳秉飞
(中国食品药品检定研究院,北京 102629)
小鼠细小病毒(MMV)属细小病毒科的细小病毒属。核酸型为单股线状DNA。对外界环境因素抵抗力强,极耐干燥。实验小鼠和野生小鼠是MMV的自然宿主,实验条件下可感染大鼠和仓鼠[1]。可在生长旺盛的大鼠胚细胞和小鼠胚细胞中生长,并产生血凝素。MMV具有高度传染性,主要通过粪便和尿液传播,易感小鼠通过直接或间接接触而感染,也可经胎盘垂直传播。MMV广泛存在于实验小鼠和野生小鼠中,在世界范围内广泛存在[1-3]。在我国小鼠群中也监测到MMV的感染[4-6]。MMV不仅是白血病病毒种毒、连续移植小鼠肿瘤的一种极常见的污染物,同时MMV污染也是仓鼠卵巢细胞(CHO)生物制药生产过程中的一大难题[1,7]。MMV是我国SPF等级实验动物必须排除的病原微生物之一[8],同时也是ICLAS、FELASA等实验动物检测标准中要求排除的病原微生物之一[9]。
为促进我国实验动物质量检测相关机构检测水平的整体提高,2018年由中国合格评定国家认可委员会(CNAS)组织,中国食品药品检定研究院依据ISO/IEC17043∶2010《合格评定能力验证的通用要求》运作实施全国范围内实验动物检测机构实验小鼠细小病毒(MMV)抗体检测能力验证计划[10-12]。目的是通过组织实施能力验证了解我国目前实验动物检测机构在实验小鼠细小病毒(MMV)抗体检测方面的技术水平和能力。通过对各检测机构提交检测结果的比较分析,来弥补我国实验动物检验中存在的不足、完善检验检测体系,达到促进我国实验动物质量检测机构检测技术水平的整体提高[11]。
1 材料与方法
1.1 能力验证计划开展
开展验证的项目:实验小鼠细小病毒(MMV)抗体检测;开展时间:2018年4月;验证代码:NIFDC-PT-172;组织单位:中国合格评定国家认可委员会(CNAS);计划实施单位:中国食品药品检定研究院(以下简称中检院)[14-15]。
1.2 能力验证计划的发布
本次能力验证计划实施前6个月在全国实验动物检测网络公开,面向全国实验动物检测机构。国内具备实验动物检测能力和资质的所有实验动物检测机构相关实验室均可报名参加。并规定了能力验证时间及检测结果反馈截至时间[14-15]。
1.3 能力验证主要实验材料
实验小鼠细小病毒(MMV)抗体阳性血清、实验小鼠细小病毒(MMV)抗体阴性血清:本室冻存;小鼠细小病毒(MMV)抗原包被板:本室制备;羊抗小鼠IgG-HRP:KPL公司;商品化实验小鼠细小病毒(MMV)抗体ELISA试剂盒:国外某公司产品。
1.4 能力验证比对样本的检测及标定
1.4.1此次比对实验需要3个样本,编号分别为样本1、样本2、样本3。3个样本肉眼观察性状均应为澄清、透明、无絮状物的淡黄色液体[11,14-15]。
1.4.23个样本按国标ELISA方法测定后,用商品化ELISA检测试剂盒进行标定。要求样本1和样本2为已知MMV抗体阳性样本,样本3为已知MMV抗体阴性样本。ELISA按国标要求进行操作[8],商品化试剂盒按说明书进行操作[14-15]。
1.5 能力验证比对样本的分装及编号
取3个经过标定的样本,各分装100支,100 μL/支。外包装均一致,样本性状颜色均一致。由实施单位将所有样本进行随机编号,并记录每支样本编号和相对应的结果[11,14]。
1.6 能力验证比对样本的均一性测定
将2个阳性样本(样本1和样本2)和1个阴性样本(样本3)分别分装成100份,随机各取15份用国标ELISA方法进行检测,要求样本1小鼠细小病毒抗体A492≥0.6,样本2小鼠细小病毒抗体0.6>A492≥0.2,样本3小鼠细小病毒抗体A492<0.2。通过考察3个样本的A值变化范围和15支样本的A492值的变异系数(相对偏差)来评价样本的均一性[11,13-16]。
1.7 能力验证比对样本的稳定性测定
1)37 ℃稳定性试验
3个比对样本随机各抽取15支,放置于37 ℃孵育箱,连续15 d,每天各取1支,冻存于-70 ℃,作为37 ℃稳定性样品[11,13-14,16]。
2)4 ℃稳定性试验
3个比对样本随机各抽取15支,放置于4 ℃孵育箱,连续15 d,每天各取1支,冻存于-70 ℃,作为4 ℃稳定性样品[14]。
2组样本均采用国标ELISA方法测定各样本A492值,通过考察3个样本A492值变化范围或计算3个样本在2个不同温度环境分别放置15 d 的A492值变异系数(相对偏差),以评价样本的稳定性。
1.8 能力验证比对样本的运输稳定性测定[11]
将3个比对样本,随机各取3份于运输冷藏箱中存放,连续放置7 d,每天记录箱内温度。第7天将样品取出进行检测,样本1小鼠细小病毒抗体A值应为A492≥0.6,样本2小鼠细小病毒抗体A值应为0.6>A492≥0.2,样本3小鼠细小病毒抗体A值应为A492<0.2。
1.9 能力验证比对样本的分发
将经过均一性、稳定性和运输稳定性检测均符合要求的比对样本,分发给各报名参加比对单位。每个单位分发3个样本。并由实施单位记录不同单位相对应的样本编号,通过冷链保持低温运输[14]。
1.10 本次能力验证检测方法为ELISA方法[8]
1.11 结果评价标准
此次能力验证为定性检测,样本检测结果以阴性(-)或阳性(+)来表示[13-16]。比对单位在规定截至日期内反馈结果,并且3个样本的检测结果与实施单位分发样本的预期结果均相符,判为满意;比对单位未在截至日期内反馈结果,或者比对样本中有一个结果与预期结果不相符,则判为不满意[12-21]。
2 结果
2.1 33个实验动物检测机构参加此次能力验证计划
由中检院给每个机构以“NIFDC-PT-172-编号”表示的1个代码,对其说明反馈的结果及其评价均以代码表示。
2.2 比对样本的标定
经ELISA检测的3个样本通过商品化小鼠细小病毒(MMV)抗体ELISA检测试剂盒检测,符合率为100%。样本1和样本2为阳性,样本3为阴性,结果见表1。

表1 比对样本标定结果Table 1 The calibration results of samples
2.3 能力验证比对样本的均一性测定
样本1和样本2两个阳性样本A值范围分别为0.673~0.819和0.374~0.511,其变异系数(相对偏差)分别为6.93%和9.46%。阴性样本3的A值范围为-0.008~0.007。3个样本均符合能力验证样本均一性要求。3个样本A值结果见表2。
2.4 样本的稳定性测定[12]
结果显示37 ℃稳定性实验样本1和样本2两个阳性样本A值范围分别为0.612~0.792和0.376~0.508,其变异系数(相对偏差)分别为7.78%和10.24%。阴性样本3的A值范围为-0.005~0.003,均符合样本稳定性要求。
4 ℃稳定性实验样本1和样本2两个阳性样本A值范围分别为0.657~0.866和0.376~0.508,其
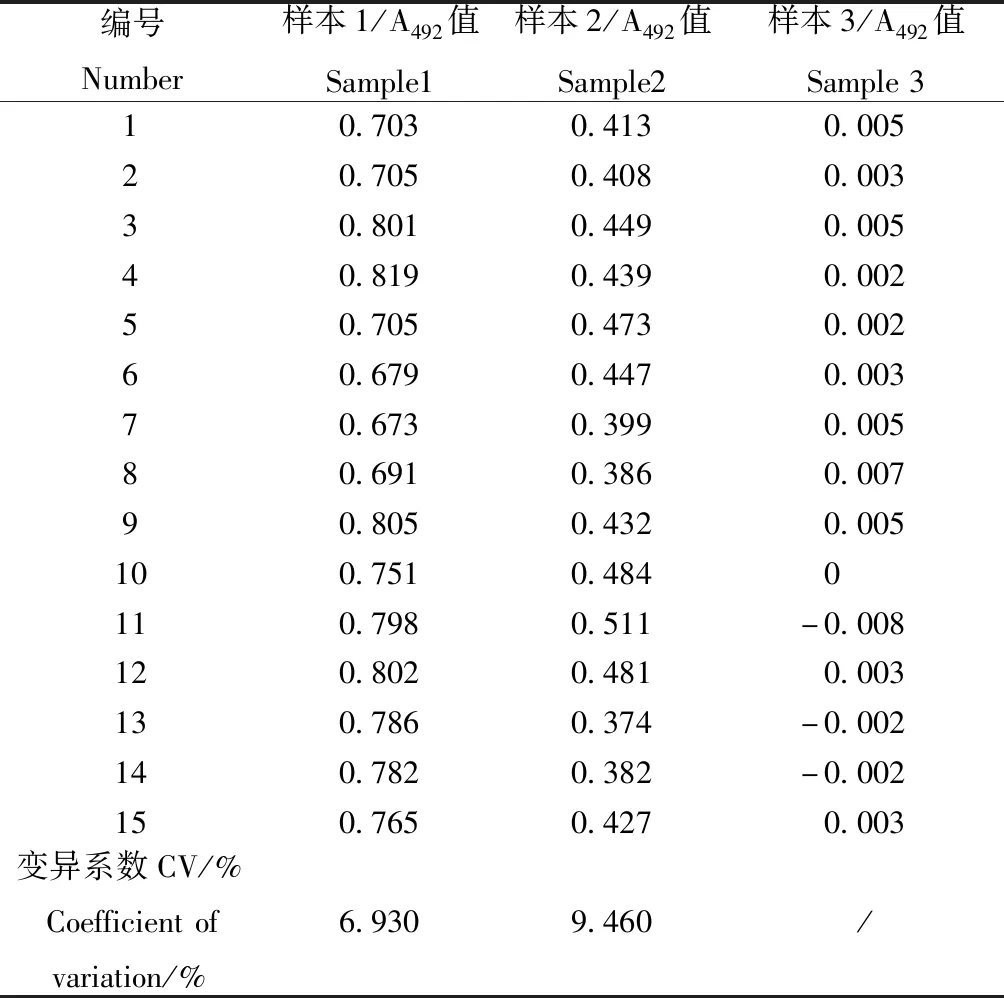
表2 样本均一性测定结果Table 2 The uniformity results of samples
变异系数(相对偏差)分别为7.78%和10.24%。阴性样本3的A值范围为-0.001~0.009,均符合样本稳定性要求。
3个样本A值结果见表3。
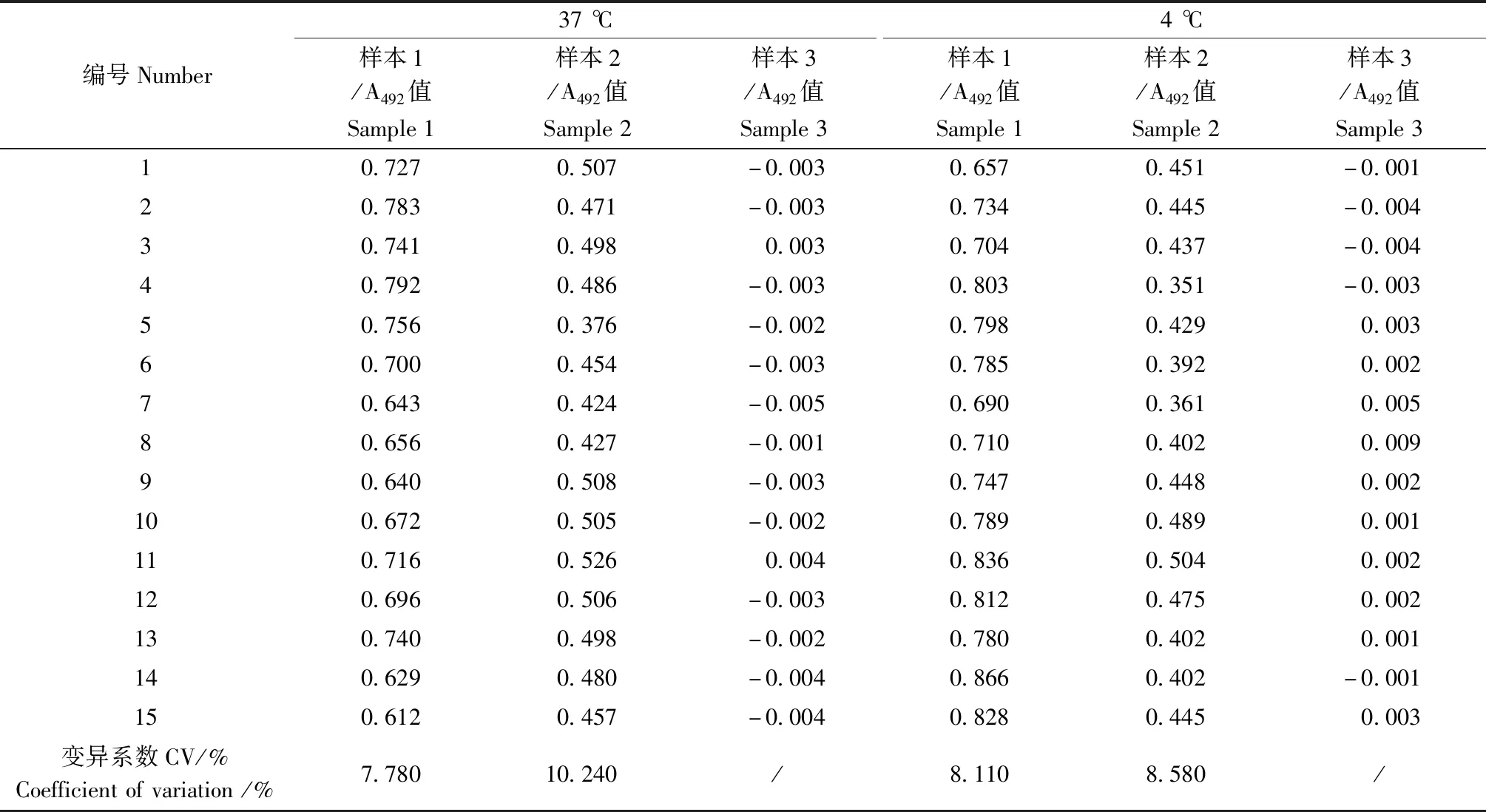
表3 样本稳定性测定结果Table 3 The stability results of samples
2.5 样本的运输稳定性测定
连续7 d监测比对样本存放于运输冷藏箱温度记录结果及温度变化曲线见表4及图1。运输稳定性样本检测结果见表5。
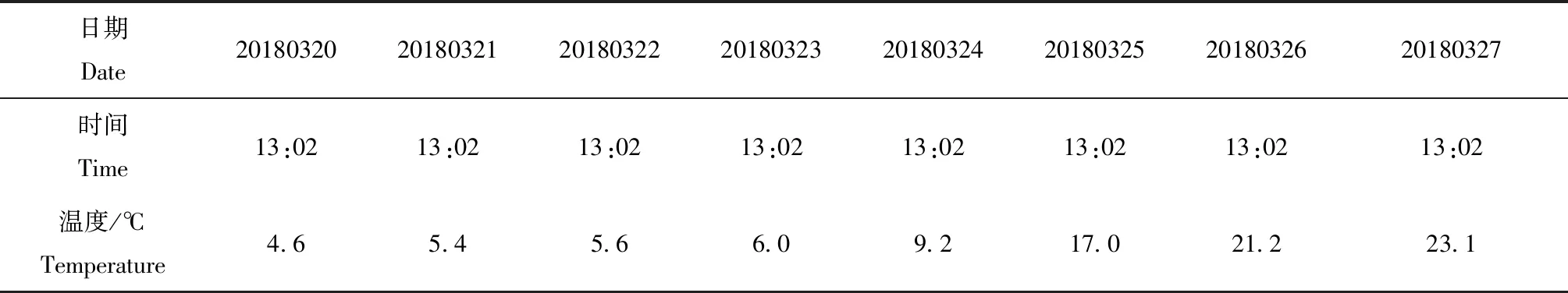
表4 运输稳定性实验温度记录结果Table 4 The temperature record results of transport stability test
图1 运输稳定性实验温度记录曲线图Fig.1 The temperature graph of transport stability test
表5 运输稳定性实验结果Table 5 The results of transport stability test
结果显示3份样本1的A492值均>0.6,3份样本2的A值均为0.6>A492>0.2,3份样本3的A492值均<0.2。3个样本均符合样本运输稳定性要求。
2.6 参加能力验证实验室行业分布统计[12]
参加本次能力验证的有国家及省部级科学研究院,省、市级实验动物检测质量中心、疾病预防控制中心等共33家检测机构,具体统计结果见表6。

表6 参加实验室行业分布Table 6 The industry distribution of participating laboratory
2.7 参加能力验证实验室地区分布统计[12]
参加本次能力验证的33个检测机构覆盖了国内19个省/市/自治区。具体统计结果见表7。
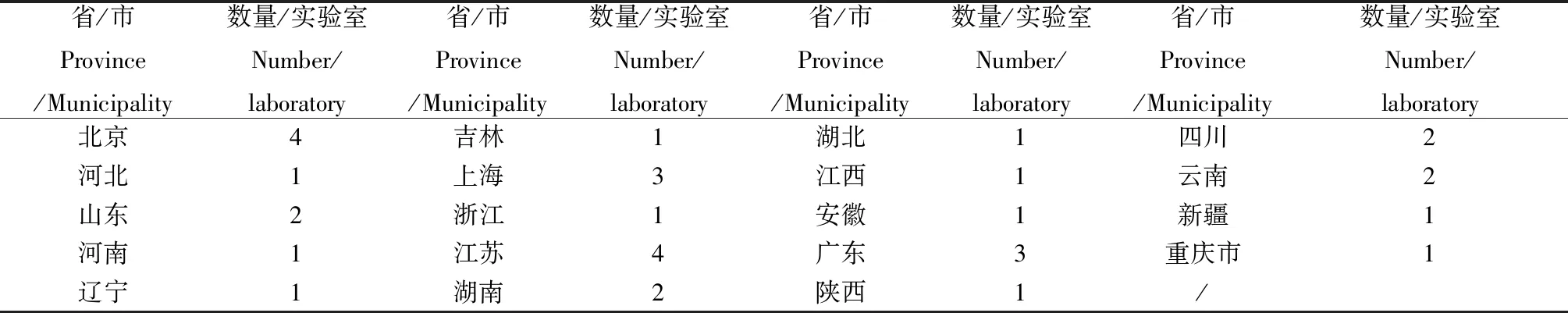
表7 参加实验室所在地区分布Table 7 The regional distribution of participating laboratory
2.8 能力验证比对样本检测结果分析[12]
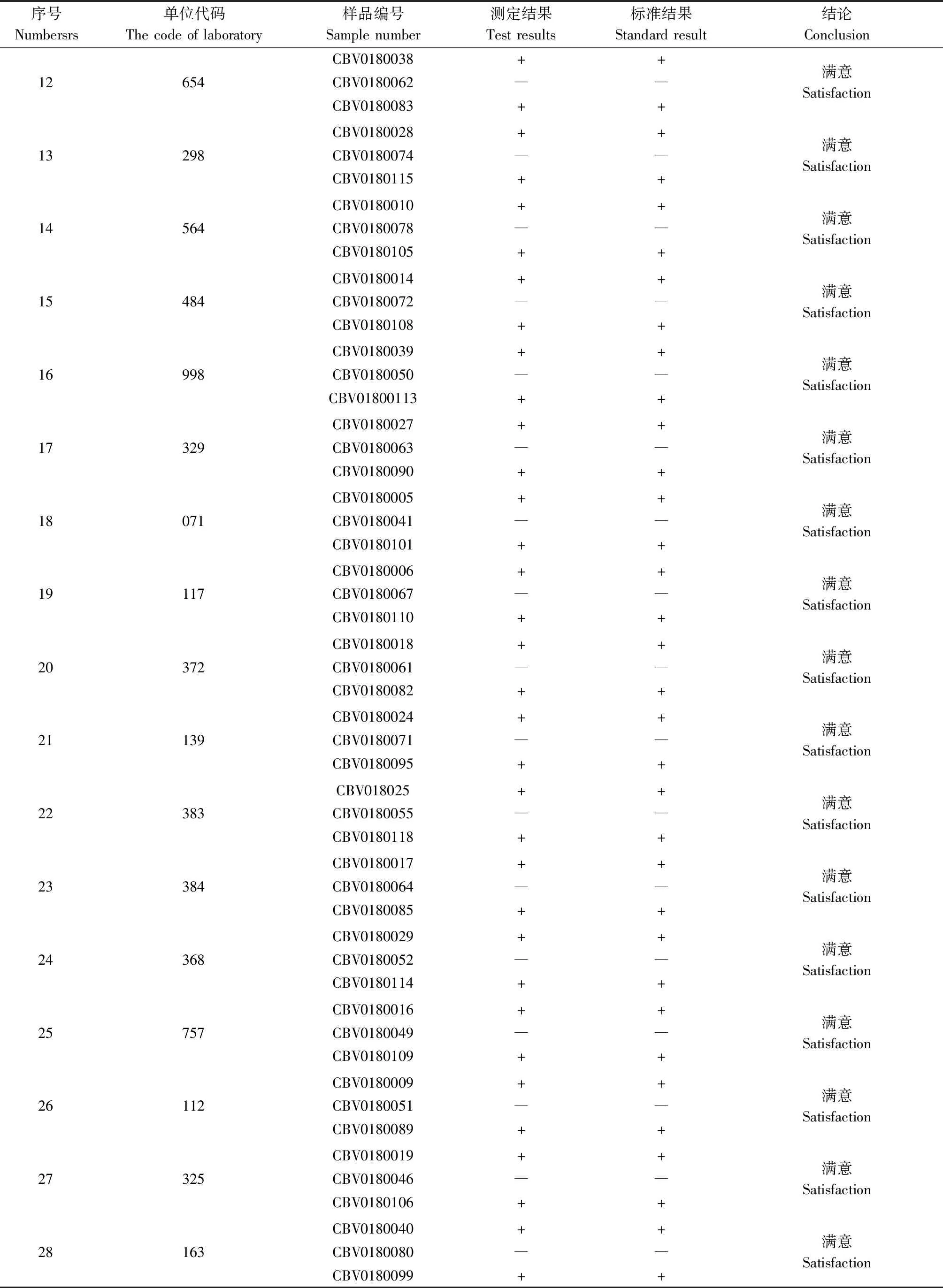
33个实验室在规定时限内均提交了样本的检测结果。实验室代码及其相对应的样本编号及其检测结果见表8。
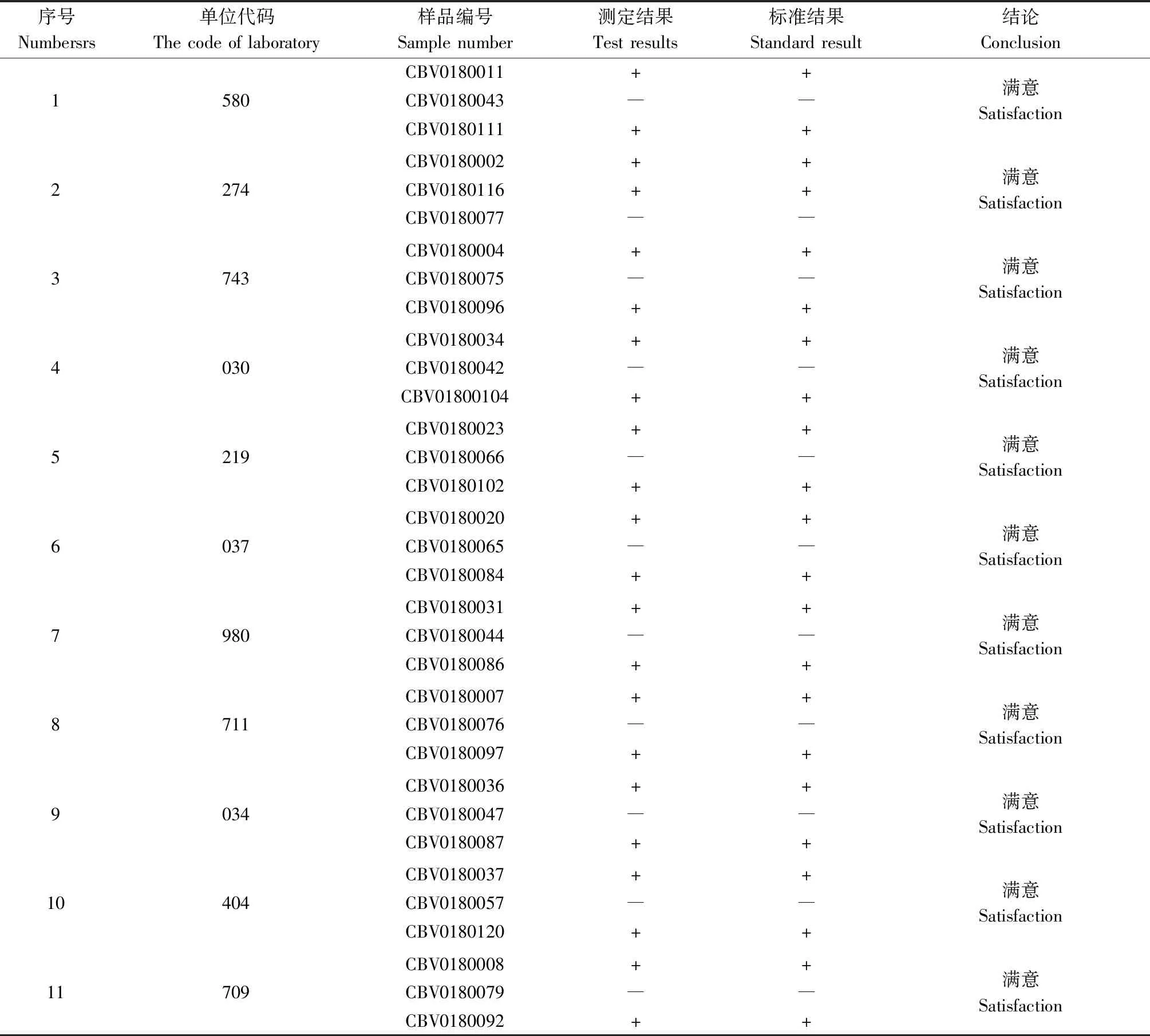
表8 33家单位反馈检测结果一览表Table 8 The list of test results from 33 units
续表8-1
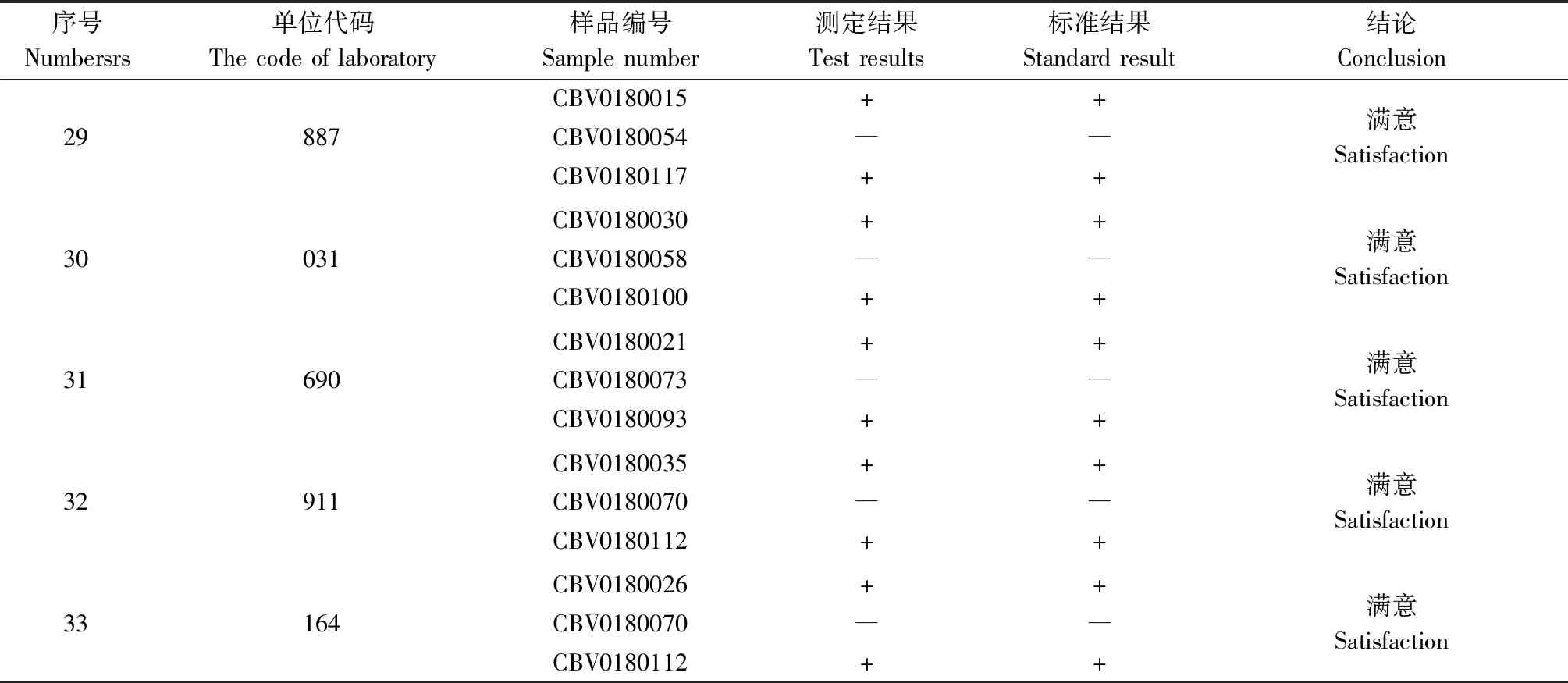
续表8-2
从汇总结果看,33个实验室及检测结果均为满意,满意率为100%。
3 讨论
3.1 检测方法的要求
实验动物国家标准(GB/T14926.28-2001实验动物小鼠细小病毒检测方法)[8]规定的检测方法包括酶联免疫吸附试验(ELISA)、免疫酶试验(IEA)、免疫荧光试验(IFA)[8],与以往的能力验证计划不同的是,考虑到不同检测方法可能出现不同的结果,本次能力验证要求所有参加单位均采用ELISA方法进行检测[8]。从反馈的结果来看,提交结果的33家实验室均采用了ELISA检测方法[8],有1家单位同时还采用IFA方法进行了结果验证,2种方法的检测结果均为满意。通过此单位采用ELISA和IFA 2种方法检测均可得到满意结果,同时结合2016年及2017年此单位也均采用上述两种方法对其他两种病毒抗体进行检测并均得到满意结果看:1)证明其中一种方法可以作为验证另一种方法的可靠技术手段;2)此家实验室两种方法技术应用均较成熟;3)此家实验室在实验动物检测技术能力方面较强。
3.2 检测试剂的选择
从检测试剂看,提交材料的33家单位中,有21家采用商品化ELISA试剂进行检测,并说明了试剂盒来源及批号。其中有2家实验室同时采用国产和进口两种试剂进行检测,其余8家单位未表明试剂盒来源。不管是使用国内检测试剂,还是国外检测试剂,或是未表明试剂来源的检测试剂,反馈的结果看均为满意。说明商品化检测试剂质量可靠,为我国实验动物质量控制提供可靠的技术保障,同时也说明参加能力验证各实验室检测能力可靠。同时从反馈的信息看,大家更倾向于选择国外检测试剂,但2018年从检测结果看,国内国外检测试剂均能达到满意结果。结合近几年检测结果看,不满意结果中用国外检测试剂的和用国内检测试剂单位占百分比相当,所以从近几年使用试剂和反馈结果看,检测结果是否达到满意,实验室检测技术能力至关重要。
3.3 反馈结果分析
本次能力验证同样加入了弱阳性样本,并且采用随机编号形式进行随机发放。每个实验室发放阳性、弱阳性和阴性样本各1个[13-16,20]。弱阳性样本的增加无疑增加了检测难度,也更能检验出各单位的检验水平。从整个反馈结果看,各单位均能检出弱阳性样本,说明各单位在小鼠细小病毒检测方面具备很强的检测能力。
33家提交材料的单位中,有23家提交了报告,有29家提交了原始记录,有19家同时提交了报告和原始记录。从报告和原始记录信息看,大部分原始记录里体现了使用仪器及仪器编号、检验依据等信息的记录,而且部分实验室原始记录记述相当详细完整。有6家实验室在报告及原始记录里没有提到检验依据,有5家实验室没有使用相关仪器信息。提示部分实验室需要完善报告及原始记录的完整性。
按照国标的要求,检测为阳性的样品需要用同一方法或不同方法进行复检,尤其是ELISA试验,影响结果因素较多,进行复检或平行样本检测很有必要,本次提供材料的33家实验室,有9家实验室做的较好,对实验结果采用不同方法、不同的实验人员或不同来源试剂进行了复检,有的实验室用同一方法进行了复检,还有的实验室每个检测样本做了多个重复孔进行检测;但多数实验室通过对样本的单次检验即判定了结果。虽然从提交检测结果看,与预期结果一致。但是,从实验室的检测程序来看,存在缺陷。因此建议没有对阳性样本进行复核或者复检的实验室在今后的实验过程,要做到对阳性检测样本进行验证或复核,以保证检测结果的可靠性。部分单位使用的检测试剂未写明来源或来源不清,检测报告中应写明检测试剂的来源及批号等信息,以保证检测结果的溯源性。
从本次能力验证结果,并结合近年开展的实验动物病毒检测项目能力验证结果可以看出,通过开展能力验证活动[13-16,20],不仅促进了我国实验动物检测实验室检测能力和检测水平的整体提高,而且对于完善实验动物检验检测体系具有重要意义。
