重组短小芽孢杆菌CotA 漆酶的酶学性质及发酵优化研究
2020-03-22许开忠王雅静蔡宇杰廖祥儒管政兵
许开忠, 王雅静, 马 慧, 蔡宇杰, 廖祥儒, 管政兵*
(1. 江南大学 生物工程学院, 江苏 无锡214122;2. 江南大学 工业生物技术教育部重点实验室, 江苏 无锡214122)
漆酶(EC 1.10.3.2)是一种多铜氧化酶,因其能够催化多种酚类、芳香族有机物氧化,并且以氧原子为最终电子受体,最终生成水,并且没有其他有害的副产物生成[1],被称为一种绿色、环保、环境友好的生物催化剂。 漆酶在印染废水的处理、药物合成、食品能源等领域具有广泛的应用前景。 其中细菌漆酶又因其具有更宽广的底物范围和热稳定性,能够耐受碱性环境等特点,可以适用于工业染料废水的处理。
目前已有报道表明,许多细菌漆酶被筛选出来并克隆表达, 如2015 年Liu 等从嗜热栖热菌(Thermus thermophilus) 中克隆了漆酶基因LacTT,再应用于工业染料刚果红和活性黑的脱色降解[2]。2018 年,Gaur 和Nisha 等分离并克隆了新型肺炎克雷伯菌(Klebsiella pneumoniae)漆酶lac用于从大米和小麦麸生物质生产乙醇[3]。 作者以所在实验室从五倍子原蜜中筛选出的短小芽孢杆菌W3(Bacillus pumilusW3) 中分离的CotA 漆酶基因(GenBank:AGO57931.1)为出发点,通过分子克隆的手段,将其克隆到具有信号肽的pet-22b 质粒上, 并在大肠杆菌中得到了表达。 在适宜的发酵环境下,重组CotA漆酶的表达量为1 915.3 U/L。 想要提高CotA 漆酶的表达量,优化发酵培养基无疑是最直接有效的方法。
传统的微生物培养基优化方法主要用正交设计、响应面等方法。 然后微生物发酵是一个多因素影响、非线性的黑箱系统,如果用传统的优化方法不仅工作量大而且难以准确地预测。 而BP 神经网络模型(Back propagation neural network)是一种按照误差逆向传播来达到训练效果的多层前馈神经网络[4]。 使用神经网络建模无须事先知道输入与输出之间的数学关系,而且通过自身的训练,学习某种规则来达到最接近期望输出值的结果。 其核心思想是利用梯度下降的搜索方法来达到网络实际输出和期望的误差均方差最小。 因此BP 神经网络在拟合非线性关系上具有良好的适应性,适合于多变量多因素的过程建模。 该建模方式已经被广泛地应用到生物发酵领域。
萤火虫算法(Firefly algorithm)是一种来源于萤火虫的闪烁行为的仿生群智能优化算法[5]。 该算法模拟萤火虫在空间移动时,发光弱的萤火虫会被发光强的萤火虫吸引的这一特点建立的数学模型。 在搜索过程中,所有萤火虫互相吸引,吸引能力只跟发光强度和距离相关, 当亮度一样时则做随机运动,最终发光最亮的萤火虫就是函数的最优解。
本研究中首次组合运用BP 神经网络和萤火虫算法对重组大肠杆菌发酵产CotA 漆酶培养基进行优化, 运用16 组实验数据作为样本数据进行神经网络的训练和拟合,完成优化任务。
1 材料与方法
1.1 菌种和质粒载体
短小芽孢杆菌W3:作者所在实验室保存;克隆和表达载体pET-22b:购自TaKaRa(大连)公司;大肠杆菌JM109 和BL21(DE3):购自TransGen(北京)公司。
1.2 主要试剂和仪器
高保真酶PrimeSTAR、限制性内切酶、氨苄青霉 素(Amp)、异丙基硫代半乳糖苷(IPTG):购自TaKaRa(大连)公司;2′-联氨-双-3-乙基苯并噻唑啉-6-磺酸(ABTS):购自Sigma-Aldrich (中国上海)公司;本实验中所用的化学试剂全部为分析纯。
梯度PCR 仪: 杭州博日科技有限公司产品;凝胶核酸电泳仪:北京六一仪器厂制造;高速冷冻离心机: 湖南湘仪实验室仪器开发有限公司产品;恒温水浴锅:常州中诚仪器制造有限公司产品;组合式摇床: 太仓市强乐实验设备有限公司产品;UV-6000 紫外可见分光光度计:上海元析仪器有限公司产品;全自动蛋白电泳仪:生工生物工程(上海)股份有限公司产品。
1.3 培养基
LB 液体培养基:蛋白胨1 g/dL,酵母粉0.5 g/dL,NaCl 1 g/dL;pH 7.0。 固体培养基添加2~3 g/dL 的琼脂。
发酵培养基:蛋白胨0.6~1.2 g/dL,酵母粉0.3~0.6 g/dL,NaCl 0.6~1.2 g/dL,CuSO40.15~0.30 mmol/L,甘油0.6%~1.2%(体积分数)。
所有培养基都经过1×105Pa 灭菌30 min。
1.4 实验方法
1.4.1 CotA 漆酶基因的克隆表达 根据W3 全基因组信息设计引物,上游引物为:5′-CCGGAATTCG ATGAACCTAGAAAAATTTG-3′, 下游引物为:5′-CCCAAGCTTGTACTGGATGATATCCATCGGCC-3′,酶切位点用下划线表示(EcoRⅠ和HindⅢ)。 提取短小芽孢杆菌W3 的全基因组作为模板, 使用高保真酶PrimeSTAR 进行PCR 扩增目的条带。 PCR 体系:PrimeSTAR 缓冲液10 μL,dNTPs 4 μL, 上游引物1 μL, 下游引物1 μL, 模板1 μL,DNA 聚合酶0.5 μL,双蒸无菌水32.5 μL。 扩增条件为:95 ℃预变性10 s;57 ℃退火10 s;72 ℃延伸90 s; 循环20次。 对PCR 产物和质粒进行双酶切并产物回收,使用T4 连接酶于16 ℃连接4 h, 然后转化大肠杆菌JM109,挑取阳性克隆进行测序验证。 对于测序验证正确的质粒,转入大肠杆菌BL21 (DE3)进行表达。
1.4.2 重组菌株的诱导表达及蛋白质纯化 诱导方法: 接种体积分数1%的新鲜菌液到50 mL 的发酵培养基。 37 ℃、200 r/min 条件下培养到OD600=0.3~0.6。 将IPTG(0.4 mmol/L)加到培养基中,然后在25 ℃、200 r/min 条件下继续培养8 h 进行粗酶制备。
粗酶制备:4 ℃、5 000g离心15 min 然后收获菌体。使用pH 7.0 的Na2HPO4-NaH2PO4缓冲液洗涤菌体。 加入等体积pH 7.0 的渗透压缓冲液(20 mmol/L的Na2HPO4-NaH2PO4,36%(体积分数)蔗糖,2.5 mmol/L EDTA),然后在25 ℃下,充分搅拌20 min。 马上加入5 倍体积的预冷超纯水,引发渗透压冲击[6],平衡后离心收集上清液。
蛋白质纯化方法: 使用HisTrap HP 纯化CotA漆酶, 采用高浓度咪唑线性洗脱的方法获得CotA漆酶纯化蛋白质。 并用HiTrapTM进行脱盐处理。 并通过SDS-PAGE 检验蛋白质的表达水平[7]。
1.4.3 CotA 漆酶的酶活测定及SDS-PAGE 分析酶活力单位(U):1 min 内氧化1 μmol ABTS 所需的漆酶量。
酶反应体系: 预先将2.4 mL 的磷酸氢二钠-柠檬酸缓冲液和500 μL 的3 mmol/L 的ABTS 充分混匀,并于50 ℃条件下水浴5 min。 紧接着迅速加入100 μL 稀释好的CotA 漆酶溶液。 用分光光度计记录420 nm 波长下的读数[8]。
漆酶酶活的计算公式如下:
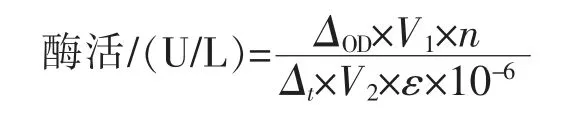
式中,ΔOD为起始和结束时的吸光度差值;V1为反应体系的总体积 (mL);n为酶液的稀释倍数;Δt为反应时间(min);V2为体系中酶液的体积(mL);ε 为摩尔消光系数(L/(mol·cm))。
1.4.4 酶学性质分析 最适pH:在50 ℃下,将反应体系放置在不同pH(2.0~11.0)的缓冲液中,测定酶活,以最高酶活为100%,比较获得最适反应pH。
最适温度:在最适反应pH 条件下,将反应体系分别在不同的温度(30、40、50、60、70、80、90、100 ℃)条件下测酶活,以最高酶活为100%,得到漆酶的最适反应温度。
pH 稳定性: 将酶液放置在不同pH 的缓冲液中,4 ℃孵育5 h,以最高酶活为100%,测定其剩余酶活。
热稳定性测定:在最适反应pH 条件下,将漆酶置于不同的温度梯度(30~90 ℃)条件下孵育2 h,以最高酶活为100%,测定CotA 漆酶的剩余酶活。
动力学参数的测定:在上述的最适pH 和50 ℃条件下,以ABTS 作为底物检测漆酶酶活。配置不同浓度的ABTS(浓度为0.02~0.50 mmol/L)研究反应动力学。 动力学参数Km和Kcat利用Michaelis-Menten equation 计算[9]。
1.4.5 BP 神经网络模型建立及萤火虫算法寻优以发酵培养基中的蛋白胨、酵母粉、NaCl、CuSO4、甘油这5 个因素作为BP 神经网络模型的输入单元,以重组CotA 漆酶的酶活作为输出单元建立神经网络。 同时利用萤火虫算法寻优确定神经网络的权值。 本实验中BP 神经网络的建立及萤火虫寻优算法使用MATLAB 2014a 软件进行。
1.4.6 染料脱色应用 使用纯化后的漆酶对甲基红(λmax=410 nm),孔雀石绿(λmax=619 nm),溴百里香酚蓝(λmax=420 nm),酸性蓝129(λmax=629 nm)进行染料脱色研究。 脱色体系:10 U 的CotA 漆酶,0.5 mL乙酰丁香酮(10 mmol/L),染料1 mL(0.025 mg/mL),3.5 mL 磷酸氢二钠-柠檬酸缓冲液(100 mmol/L,pH 3.5)。 将脱色体系(以不加酶的体系作为对照)置于50 ℃水浴摇床上脱色5 h,然后计算脱色率。脱色率计算公式如下:
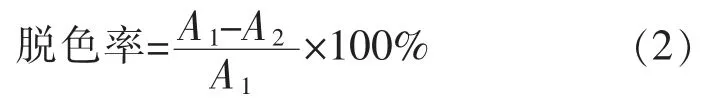
式中,A1为对照组的吸光度值;A2为实验组的吸光度值。
2 结果与分析
2.1 CotA 漆酶重组大肠杆菌构建
通过PCR 扩增获得短小芽孢杆菌W3 的CotA基因,然后通过双酶切构建重组质粒并转化大肠杆菌。测序验证得到重组菌株pET-22b-CotA 构建成功。
2.2 诱导表达及蛋白质纯化结果
按照1.3.2 的方法诱导表达CotA 漆酶,经镍柱纯化,脱盐柱脱盐和SDS-PAGE 分析,结果如图1所示,泳道1 为纯化后的CotA 漆酶蛋白质,大小约6.5×104,与ExPASy 软件预测的蛋白质大小一致。
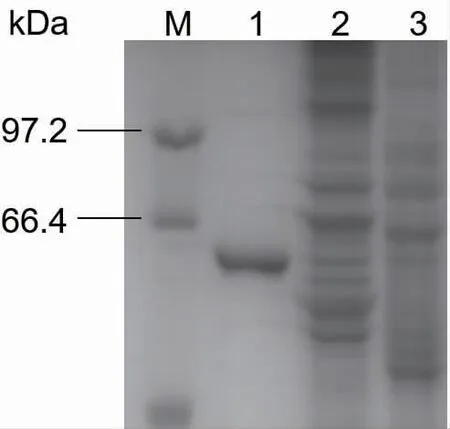
图1 CotA 漆酶的SDS-PAGE 分析Fig. 1 SDS-PAGE analysis of CotA-laccase
2.3 CotA 漆酶酶学性质分析
经一系列的酶活测定, 重组表达的CotA 漆酶最适pH 值在3.5 左右,能够耐受pH 6~12 的环境,保持50%以上的酶活(见图2(a)(b))。 重组表达的CotA 漆酶最适温度为80 ℃,在80 ℃下孵育2 h 后依然可以检测到40%的酶活性(见图2(c)(d))。 以ABTS 作为底物时,经计算得到Km为0.247 mmol/L,Kcat为41.32 s-1, 说明重组表达的CotA 漆酶具有耐高温和耐碱性环境的特点,具有适合工业染料脱色应用的潜力。
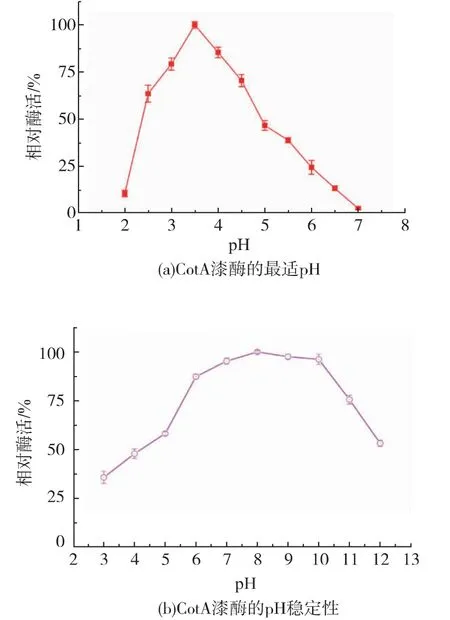
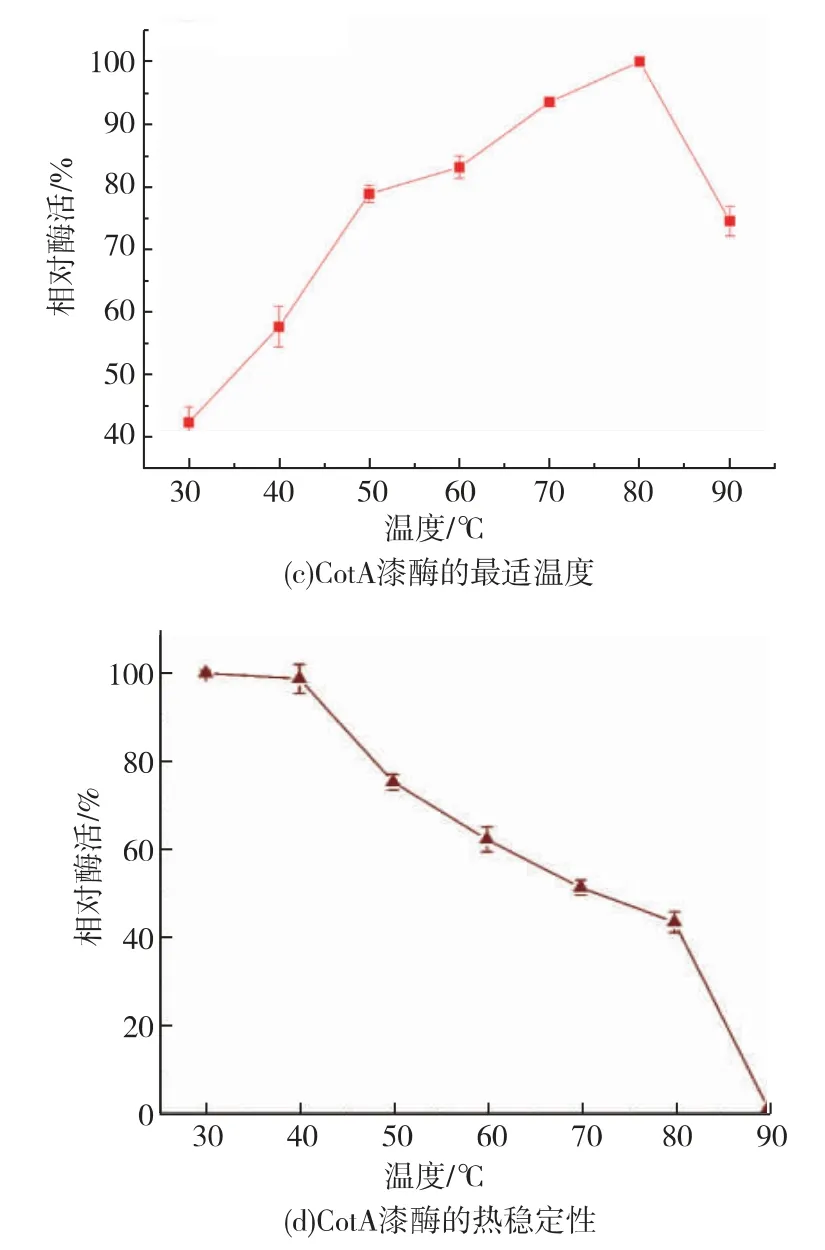
图2 酶学性质分析Fig. 2 Enzymatic properties of CotA-laccase
2.4 BP 神经网络的建模
以16 组重组大肠杆菌发酵CotA 漆酶的五因素四水平正交实验数据结果进行BP 神经网络建模。 选取12 组数据作为训练集,选取其余4 组数据作为测试集来检验模型。BP 神经网络的输入为发酵培养基中的蛋白胨、酵母粉、NaCl、CuSO4和甘油,输出为重组CotA 漆酶的酶活。 经训练比较后确定了隐含层神经元个数为3。 确定了神经拓扑结构为5-3-1 的模型,见图3。
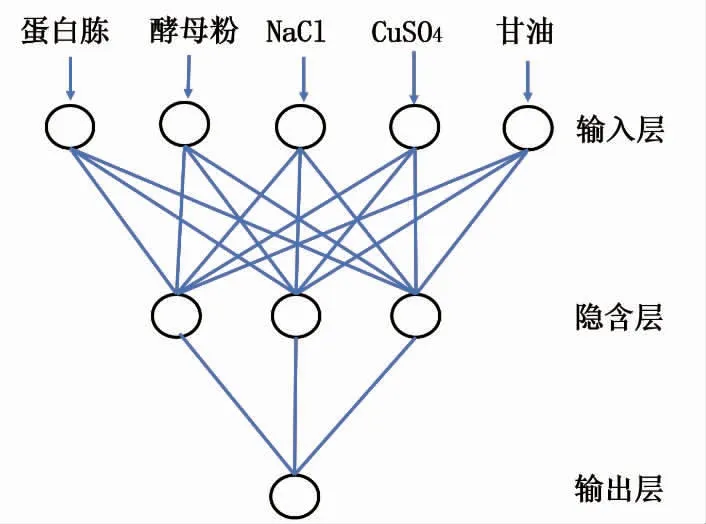
图3 BP 神经网络拓扑图Fig. 3 BP neural network topology
经过12 次迭代后神经网络模型的最佳验证性能达到了0.000 403 34 (见图4)。 决定系数R2为0.973 41,说明该神经网络模型模拟效果良好,模拟效果见表1、图5。
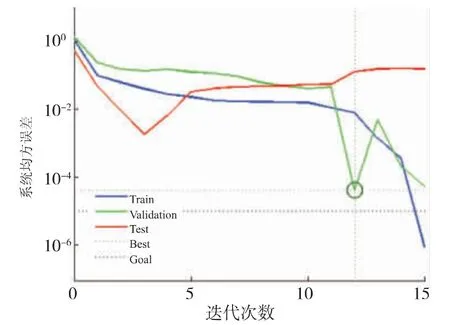
图4 BP 神经网络最佳验证性能Fig. 4 Optimal verification performance of BP neural network
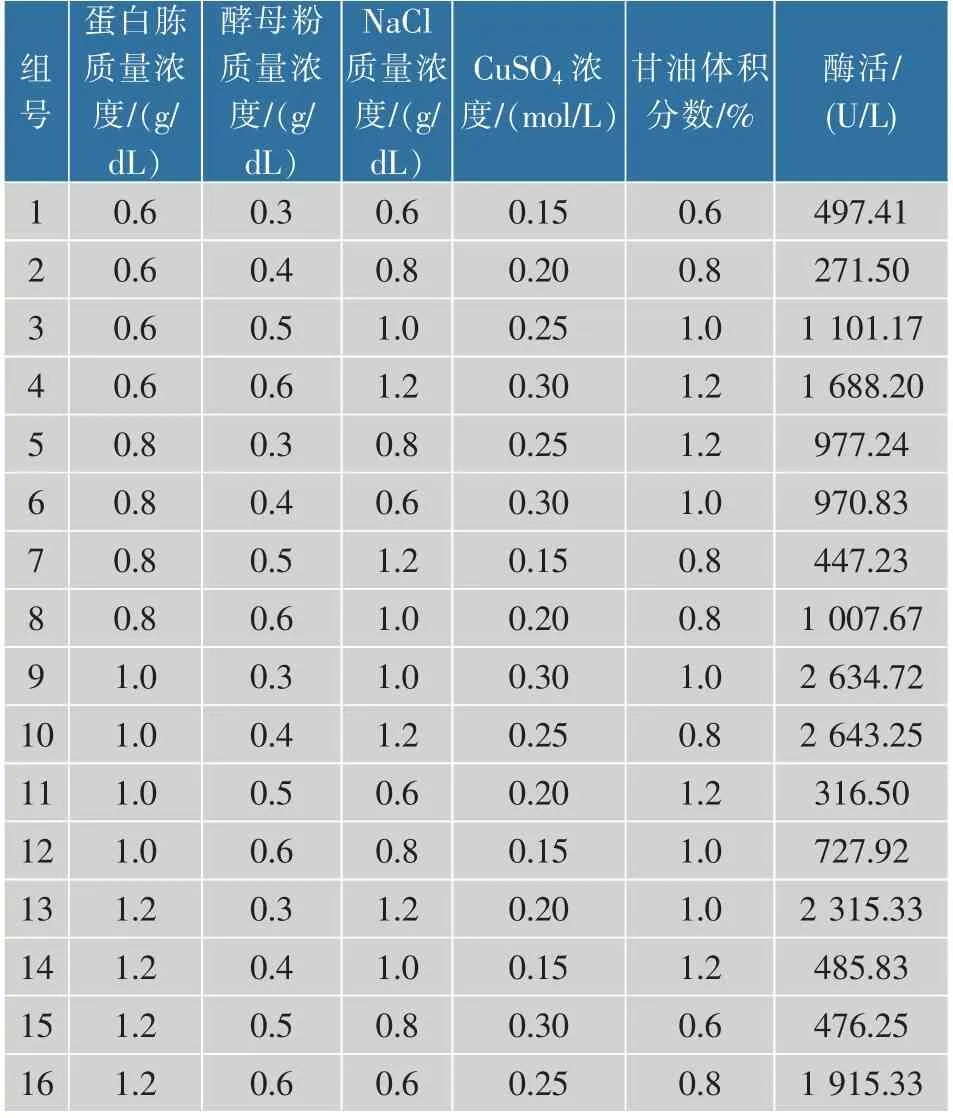
表1 BP 神经网络拟合结果Table 1 Fitting results of BP neural network
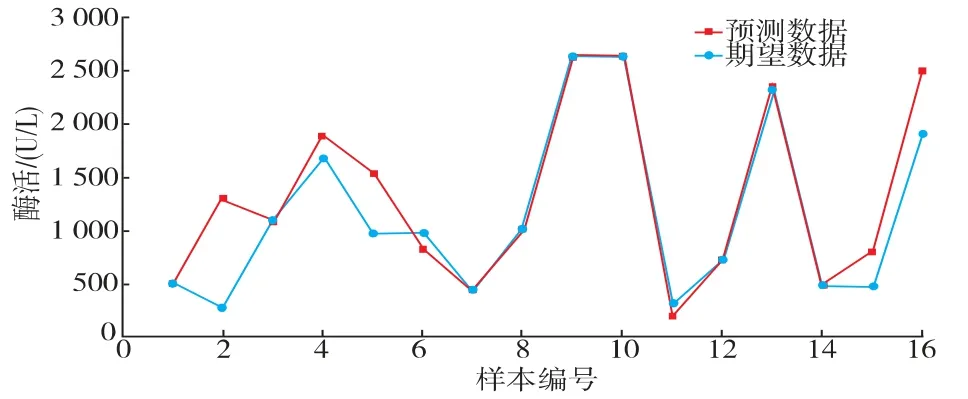
图5 BP 神经网络拟合结果Fig. 5 Fitting results of BP neural network
2.5 萤火虫算法寻优
经过萤火虫算法寻优获得,重组大肠杆菌发酵产CotA 漆酶培养基中的蛋白胨、 酵母粉、NaCl、CuSO4和甘油分别为1.16 g/dL、0.428 g/dL、1.06 g/dL、0.274 mol/L 和0.931%(体积分数) 时, 预测重组CotA 漆酶的酶活达到了最大(2 830.23 U/L)。
2.6 模拟效果验证
以BP 神经网络和萤火虫算法寻优获得的最佳培养基组成进行重组大肠杆菌发酵,重复3 次获得实际发酵生产的重组CotA 漆酶酶活达到了3 088.68 U/L,相比未优化前提高了61.26%。
2.7 染料脱色应用
CotA 漆酶对4 种染料的脱色效果如图6 所示。CotA 漆酶对4 种染料都具有不同程度的脱色能力,其中对孔雀石绿和酸性蓝脱色效果尤其明显,脱色效果接近90%。
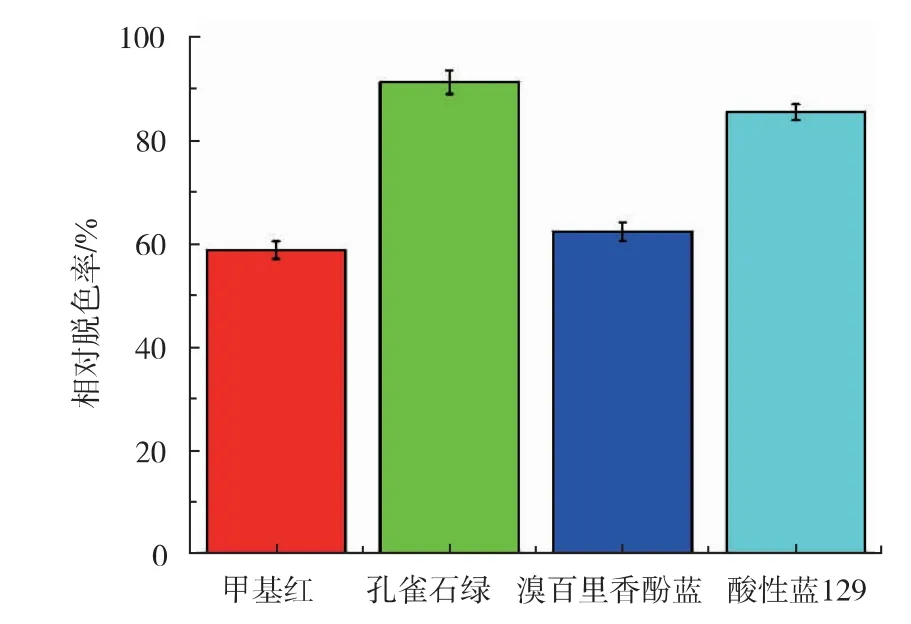
图6 染料脱色效果Fig. 6 Dye decolorization
2.8 讨论
细菌漆酶由于具有良好的热稳定性和耐受碱性环境的能力而在工业废水处理和有毒物质的降解中具有良好的应用前景[10]。 S.Basheer 等从芽孢杆菌R5 菌株中筛选到了高热稳定性的漆酶[11]。 Wang等成功克隆了芽孢杆菌WD23 来源的CotA 漆酶并用于染料的脱色[12]。 M.Kumar 等克隆表达了来自Pandoraeasp. ISTKB 来源的新型嗜热漆酶[13]。 各种新的细菌漆酶正在不断地被人们挖掘和利用。 同时,关于漆酶发酵的优化也是当前研究的一个重要内容。 培养基的成分优化是发酵过程优化的第一步也是关键的一步。 传统的培养基优化方法都是通过响应面分析,但是响应面分析采用多元二次回归方程作为拟合的基础, 这就意味着如果影响因素在3个以上的话就必须通过其他方法进行降维。 同时,响应面也会带来巨大的工作量,例如五因素三水平的响应面分析就需要46 组实验, 而本实验中只使用了16 组就达到了良好的拟合效果, 说明人工神经网络在生物建模和非线性拟合方面具有减少工作量的优点。 近年来也有越来越多的人工神经网络优化发酵的相关报道,如Peng 等通过BP 神经网络和遗传算法优化了类胡萝卜素发酵培养基,使类胡萝卜素产量提高了95.9%[14]。Ting 等利用BP 神经网络优化了毕赤酵母发酵培养基高效表达β-葡萄糖苷酶[15]。 王强等通过BP 神经网络偶联遗传算法优化三孢布拉霉发酵培养基,使番茄红素产量提高了31.6%[16]。
3 结 语
综上所述,本实验中通过分子克隆的手段将短小芽孢杆菌CotA 漆酶克隆到了pET-22b 质粒上并构建了重组大肠杆菌, 重组表达的CotA 漆酶相对分子质量大约6.5×104,以ABTS 作为底物测得反应的最适pH 值为3.5,最适温度为80 ℃。 重组表达的CotA 漆酶在pH 3.5 和50 ℃的条件下对4 种工业染料具有明显的脱色效果,其中对孔雀石绿和酸性蓝129 脱色率达到了90%左右。 在实际的印染工艺中,酸性蓝等酸性染料应用的pH 值为4 左右[17]。 而酸性蓝染料废水的处理一般需要花费大量的碱性物质将pH 值调到6 左右[18]。 本实验中的重组CotA漆酶能够直接在酸性条件下直接对酸性蓝脱色,因此重组CotA 漆酶在酸性染料废水的处理方面具有应用潜力。 本实验中利用BP 神经网络组合萤火虫算法寻优得到最佳产重组CotA 漆酶的发酵培养基成分为:蛋白胨1.16 g/dL、酵母粉0.428 g/dL、NaCl 1.06 g/dL、CuSO40.274 mol/L 和甘油 (体积分数)0.931%。 优化过的培养基产CotA 漆酶酶活为3 088.68 U/L,相比未优化之前提高了61.26%。本研究中优化后的CotA 漆酶产量明显高于已报道的重组短小芽孢杆菌LC01 漆酶产量[19]。 与报道的枯草芽孢杆菌漆酶cjp3 的最大酶活仍有差距[20],但是这只是摇瓶实验所得产量,仍然具有很大的潜力。 可见利用BP 神经网络建模结合萤火虫算法来优化CotA 漆酶发酵培养基是一种可行的手段。
