阿托伐他汀对急性心肌梗死大鼠心肌炎症及纤维化反应Notch1 信号通路、转化生长因子-β 的影响
2020-03-21李晓琳刘永欣
李晓琳,刘永欣
在急性心肌梗死(AMI)病人发病过程中,炎症反应发挥着重要作用,冠状动脉斑块纤维帽破裂后,坏死的组织会释放炎性因子,引发炎症反应,致使血小板聚集,导致血栓发生,最终引发AMI[1-2]。AMI 发生后,心肌细胞缺氧、坏死,导致心肌发生纤维化改变,进而引发心肌重构[3]。此外,AMI 发生后,冠状动脉处于阻塞状态,心肌细胞缺氧、缺血而坏死,并释放出细胞内物质,导致炎症反应发生,引发心肌纤维化改变。心肌发生纤维化改变后,室壁张力增大,可加速心功能受损[4-5]。因此,对于AMI病人,临床通常会予以抗炎症反应、心肌纤维化改变方面的干预,其中,他汀类药物被广泛应用,以往研究多侧重他汀类药物对心肌炎症的作用,关于他汀类药物抗纤维化、抗炎纤维化方面机制的研究则相对较少。为进一步探讨阿托伐他汀对AMI 大鼠模型心肌炎症、纤维化改变的影响及可能机制,本研究于2017年6月至2018年1月以大鼠为对象,分为三组展开研究,现报告如下。
1 资料与方法
1.1 一般资料 (1)大鼠。选取雄性大鼠70只,购于北京维通利化实验动物技术有限公司,医学实验动物合格证号为SCXK(京)2008—0003。级别为SPF级,体质量范围为(210.23±25.76)g,圈养,饲料、水定时添加,饲养室温度控制为22~24 ℃,湿度控制为45%~55%。本研究符合一般动物试验伦理学要求。
(2)试剂与设备。阿托伐他汀购于辉瑞制药有限公司,产品批号为20160402。Masson 混合染色液:1.0 g 丽春红,0.5 g 酸性复红,150.0 mL 冰醋酸(0.25%),1.0 g 橙黄,混匀。甲苯胺蓝染色液:0.2 g甲苯胺蓝,于200.0 mL醋酸(0.2%)中溶入。苏木精-伊红(HE)染色:苏木素,A 液,于10.0 mL 无水乙醇中溶入1.0 g 苏木素;B 液,于200.0 mL 蒸馏水中溶入20.0 g硫酸铝钾;混合A液、B液,置入水浴锅中加热至沸腾,将0.5 g黄色氧化汞加入,混匀,可见溶液为深紫色后,迅速于冷水中置入,以纱布过滤,弃沉渣。使用前,于其中加入冰醋酸4.0 mL。伊红:于100.0 mL乙醇(95%)中加入1.0 g伊红,混匀,通过纱布过滤,弃沉渣。甲醛编号为100100008,甲醇编号1000141108,无水乙醇编号是10009218,均由上海国药集团化学试剂有限公司提供。1%的盐酸乙醇由100.0 mL乙醇(75%)中加入1.0 mL盐酸制取。甲醛溶液购于湖南尔康制药股份有限公司,产品批号为1 326064;Notch1 单克隆抗体购于美国CST 公司,转化生长因子-β(TGF-β)单克隆抗体购于美国abcom公司。
1.2 研究方法
1.2.1 建模方法 实验前12 h,大鼠均禁食,麻醉后,于颈部、胸前进行备皮,固定大鼠头部、四肢,使其腹部朝上,消毒处理手术区域。通过镊子将颈部正中的皮肤提起,剪开,注意避开甲状腺,对颈部的肌肉展开钝性分离处理,牵拉使气管暴露,牵拉大鼠舌头使声门暴露,行气管插管予以辅助呼吸。对大鼠胸前手术区域实施消毒处理,作一横切口于左侧胸部第3、4 肋间,分离肌肉层,撑开胸腔,确定心脏位置,撕开心包膜,暴露心脏,确定左冠状动脉前降支位置,经左心耳下2~3 mm 处置入6-0 带针线穿过前降支,对前降支进行结扎,处理胸腔,缝合切口,将气管插管拔出,等待大鼠结扎。本研究共对70只大鼠进行建模,死亡4只,成功率为94.29%(66/70),最终选择较为成功的60只进行研究。
1.2.2 大鼠分组 按随机数字表法将60只大鼠分为三组。对照组:建模时仅为前降支进行分离,未结扎;AMI组:对前降支进行分离与结扎;治疗组:对前降支进行分离与结扎后,予以阿托伐他汀,10 mg/d[6]。
1.2.3 观测指标 观测指标为 (1)炎性因子:肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β),(2)超声心动图检查结果,(3)病理学诊断结果,(4)Notch1蛋白、TGF-β水平。方法分别为:
(1)炎性因子及Notch1蛋白、TGF-β水平。实验后5 d,于大鼠内眦处采集血液1.0 mL,置入试管,通过离心机实施离心处理,4 000 r/min,吸取1.0 μL上层血清,保存于-80 ℃环境中。取250.0 μL 大鼠炎性因子标准品,加入等量稀释液。将250.0 μL 标准品稀释液加入EP管内,通过高浓度的标准品实施1∶1 稀释,15 min 内,分别将50.0 μL 检测缓冲液、样本加入,并于每个样本孔中加入50.0 μL的稀释液,于室温内孵育2 h,并进行6次洗涤。对辣根过氧化物酶标记的链酶亲和素进行稀释后,分别加入至每个样本孔内,100.0 μL,于室温下进行45 min 孵育,洗涤6次。分别于每个样本孔中加入100.0 μL显色底物,于室温下孵育30 min,依据显色情况加入终止液,100.0 μL,30 min 内,于450 nm 波长上对吸光度(OD)值进行检测。
(2)超声心动图检查。通过Vevo2100超高分辨小动物超声影响系统实施检查,主要观察心脏形态,并测定左室射血分数(LVEF)、左室短轴短缩率(LVFS)。
(3)病理学检查。安乐死处理大鼠,取出其心脏组织,置入10%的甲醛溶液中,30 d,通过石蜡包埋处理。①HE 染色。取4 μm 的切片,通过二甲苯实施两次脱蜡处理,每次5 min,以100%的乙醇进行2 min 清洗,再分别以95%乙醇、80%乙醇清洗1 min,采用蒸馏水清洗2 min。通过苏木素进行5 min的染色处理,以自来水冲洗,于盐酸乙醇中提插30 s,置入59 ℃温水中,5 min 后取出,吸干水,置入伊红液中,2 min,于95%乙醇中浸泡2 次,每次5 min,置入100%乙醇中,浸泡1 min,置入3∶1的二甲苯石碳酸中浸泡1 min,于二甲苯中浸泡2 次,每次1 min,取出,以中性树脂进行封固。②Masson 染色。取切片4 μm,分别以自来水、蒸馏水清洗,置入Masson复合染液中,15 min,采用0.2%的醋酸进行1 min清洗,通过0.1%磷坞酸进行4 min 分化处理,以0.2%冰醋酸清洗2 次,共1 min,浸入甲苯蓝染染液中,10 s,取出以清水冲洗,以0.2%冰醋酸清洗2次,共1 min,分别以95%乙醇、无水乙醇冲洗,以二甲苯实施透明处理,采用中性的树胶进行封固。
1.3 统计学方法 本研究所涉及数据均通过SPSS 20.0 软件处理。以表示计量资料,多组间比较为单因素方差分析+多重比较LSD-t 检验。P<0.05表示差异有统计学意义。
2 结果
2.1 三组炎性因子及超声心动图检查结果比较整体分析(单因素方差分析)和多重比较(LSD-t 检验)知:各指标整体差异有统计学意义(P<0.05)。AMI组、治疗组大鼠TNF-α、IL-1β水平高于对照组,治疗组大鼠TNF-α、IL-1β 低于AMI 组,差异有统计学意义(P<0.05)。AMI组、治疗组大鼠LVEF、LVFS均低于对照组,且治疗组高于AMI组。详见表1。实验后,AMI 组、治疗组大鼠左室室壁均较对照组变薄、运动减弱,见图1。
2.2 对比三组病理学检查结果 (1)HE 染色。HE染色下,对照组大鼠心肌细胞排列整齐,可见清晰的闰盘结构;AMI 组梗死区显著较薄,心肌细胞减少,可见纤维细胞,细胞排列紊乱;治疗组介于对照组、AMI组之间。见图2。
表1 三组大鼠炎性因子及超声心动图检查结果比较/
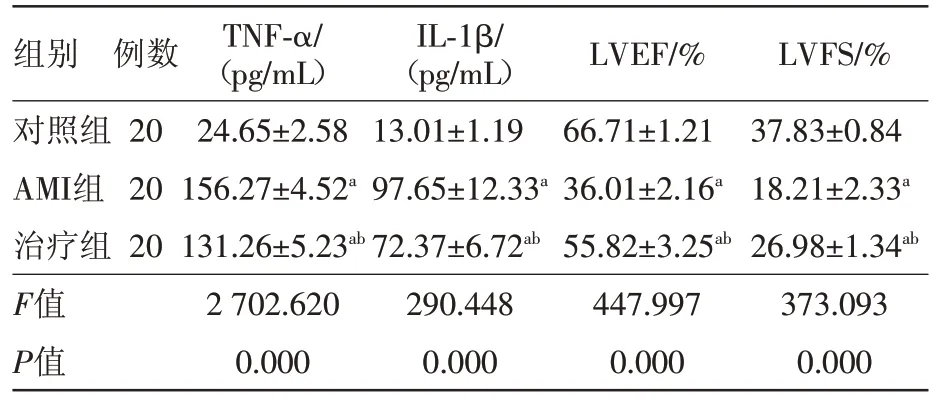
表1 三组大鼠炎性因子及超声心动图检查结果比较/
注:TNF-α为肿瘤坏死因子-α,IL-1β为白细胞介素-1β,LVEF为左室射血分数,LVFS为左室短轴短缩率。a、b分别为与对照组、AMI组相比,P<0.05
(2)Masson 染色。对照组大鼠可见心肌组织正常,胶原纤维分布不明显;AMI组梗死区可见大量胶原纤维组织,室壁较薄;治疗组可见少量胶原纤维分布。见图3。
2.3 对比三组Notch1蛋白、TGF-β水平 AMI组、治疗组Notch1蛋白、TGF-β水平较对照组高,治疗组Notch1蛋白、TGF-β水平低于AMI组,见图4。
3 讨论
既往临床上多将AMI 归类为代谢类疾病,甚少考虑炎症病变,但在AMI病情发生、发展的整个过程中,心肌炎症反应均有参与[7]。正常情况下,心脏中有定居型、聚集型的巨噬细胞存在,AMI 发生后,定居型的巨噬细胞会增多,脾脏对聚集型巨噬细胞的释放增多,导致炎症细胞、中性粒细胞、单核细胞于梗死区聚集,引发炎症反应,导致心肌损伤速度加快[8-9]。因此,对于AMI的干预,需注重抗炎、抗心肌纤维化等方面。研究指出,AMI发生48 h后,病人血液中单核细胞会大量分泌TNF-α、IL-1β,TNF-α、IL-1β由巨噬细胞合成,可对内皮细胞黏附分子产生诱导作用,使其合成增多,致使大量炎症细胞渗入心肌梗死部位,加重心肌损伤[10]。另有研究指出,TNF-α、IL-1β过度表达可导致细胞毒性产生,导致心肌细胞重构,致使大量胶原蛋白聚集于细胞外,即发生心肌纤维化改变,进而导致心室变薄,心功能下降[11]。
本研究,AMI组、治疗组大鼠TNF-α、IL-1β水平高于对照组。提示,急性AMI 伴有心肌炎症反应。本研究AMI组、治疗组大鼠LVEF、LVFS均较对照组低。对照组大鼠心肌细胞排列整齐,心肌组织分布正常,AMI组大鼠心肌细胞减少、梗死区可见大量胶原纤维组织。本研究对大鼠进行建模时,对AMI组、治疗组大鼠前降支实施结扎处理,使前降支的血流被阻断,导致前壁发生心肌梗死,因此行超声心动图检查时,可见AMI 组、治疗组大鼠左心室的前壁变薄,心腔增大,心功能显著下降。AMI发生后3~5 d即可发生心肌纤维化改变,其改变主要经历三个过程:其一,急性期,梗死的心肌区域内大量中性粒细胞、单核细胞聚集,可清除坏死心肌细胞,巨噬细胞吞噬死亡的中性粒细胞,巨噬细胞分泌抗炎因子开抑制炎症;其二,增生阶段,受损区域有大量成纤维、血管内皮细胞迁移,可形成瘢痕;其三,瘢痕形阶段,细胞成分不断凋亡,剩余的胶原基质形成瘢痕[12-13]。因此,在病理学检查中,AMI建模后大鼠梗死区显著较薄,心肌细胞减少,可见纤维细胞,细胞排列紊乱,梗死区可见大量胶原纤维组织。进一步提示,AMI发生后,大鼠心肌会发生纤维化改变,心功能下降。
本研究予以治疗组大鼠阿托伐他汀后,治疗组TNF-α、IL-1β 均低于AMI 组。提示,阿托伐他汀可对AMI大鼠心肌炎症反应、纤维化改变产生抑制作用。托伐他汀是一种临床常用的他汀类药物,而大量临床研究表明,他汀类药物不仅具有调脂、降血压等作用,而且具有降低炎症反应、氧化应激反应、改善血管内皮细胞功能、抑制左心室重构等多方面的作用[14-15]。本研究,AMI组、治疗组Notch1蛋白、TGF-β水平较对照组高,治疗组Notch1蛋白、TGF-β水平低于AMI 组。可见,AMI 发生后,大鼠Notch1 蛋白、TGF-β水平上升,经予以阿托伐他汀干预后,Notch1蛋白、TGF-β水平下降,表明阿托伐他汀可降低水平Notch1蛋白、TGF-β水平。进一步表明,在抑制AMI大鼠心肌炎症反应、心肌纤维化改变方面,阿托伐他汀可能通过以下两个方面发挥机制:(1)阻断Notch1信号通路。炎症反应的发生与notch1信号通路紧密相关,巨噬细胞分化过程中,Notch1导致大量M1 型巨噬细胞分化,促使炎症细胞因子释放,引发炎症反应[16-17]。而阿托伐他汀可将Notch1信号通路阻断,达到抑制炎症反应的效果,从而使心肌重构减轻。(2)抑制TGF-β。TGF-β 在心肌重构、心肌纤维化改变中有重要作用,可诱导心脏成纤维细胞迁移,激活促纤维化程序,阿托伐他汀可降低TGF-β水平,达到抑制心肌重构反应、纤维化改变的作用。在AMI大鼠中,通过上述两方面的机制,阿托伐他汀可有效抑制炎症,使纤维化改变减轻,进而有效改善心功能。而阿托伐他汀抑制Notch1 信号通路、TGF-β的表达的机制可能为抑制Notch-1-TGF-β-smads 通路,使炎症、纤维化指标表达减少。
综上,AMI伴有心肌炎症反应,且心肌会发生纤维化改变,而阿托伐他汀可对心肌炎症反应基纤维化改变产生抑制作用。但本研究所选大鼠样本量不大,仍需进一步增加样本量展开研究。
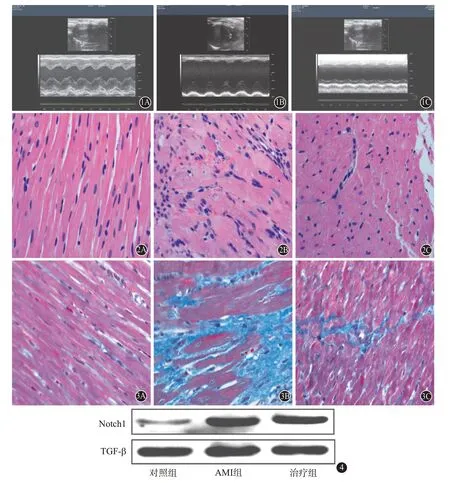
图1 三组大鼠超声心动图检查结果:A为对照组;B为AMI组;C为治疗组图2 三组大鼠HE染色结果(×200):A为对照组;B为AMI组;C为治疗组图3 三组大鼠Masson染色结果(×200):A为对照组;B为AMI组;C为治疗组图4 三组Notch1蛋白、转化生长因子-β(TGF-β)水平(蛋白质印迹法)
