盐度调节方式对培养海水养殖生物絮凝系统的影响
2020-03-20吴慧芳罗国芝谭洪新蒙浩焱
吴慧芳 ,罗国芝,2,3,谭洪新,2,3,蒙浩焱
( 1.上海水产养殖工程技术研究中心,上海 201306; 2.上海海洋大学,水产科学国家级实验教学示范中心, 上海 201306; 3.水产动物遗传育种中心上海市协同创新中心,上海 201306 )
随着人们对水产品需求的不断增长,海水养殖迅猛发展[1],取得了较高经济产值,也带来了环境污染等问题。生物絮凝技术是解决水产养殖产业发展所面临的环境污染和降低饲料成本的有效替代技术[2]。该技术是基于城市污水处理的活性污泥法,利用细菌的同化将养殖水体的颗粒有机物、溶解有机物和无机氮转化为细菌生物量的处理技术,主要通过调控养殖水体的碳氮比、溶解氧、pH等建立絮凝剂所适宜的生长环境,将有机废物同化为微生物[3-4]。该技术可应用在封闭式循环水养殖模式,以减少投喂量和养殖尾水的排放,降低周边水域环境污染。
相对于淡水生物絮凝系统,海水生物絮凝系统主要受盐度的影响。盐度使絮团成熟的时间明显滞后,一般淡水生物絮团成熟需约1个月时间[5],而高盐度的海水生物絮团培养往往需要约2个月时间[6],所需时间比淡水长。面对高盐环境,微生物会出现单细胞聚集以及内源性呼吸加速的现象,通过分泌和细胞自溶释放细胞有机组成成分,严重影响其生理功能[7-9]。在海水生物絮团培养期间,常出现亚硝酸盐氮累积现象[10-12]。在好氧颗粒序批式反应器中,Cl-由0.2 g/L逐渐增至20 g/L时,对氨氧化进程无明显作用,但明显抑制亚硝酸盐氮氧化进程[13]。面对海水生物絮团培养过程中盐胁迫造成的培养时间过长,尤其是亚硝酸盐氮长期积累的现象,需探索出合理的盐度调节方式,以缩短海水生物絮团的培养周期。
面对盐度造成海水生物絮团构建耗时较长的问题,笔者采取了3种不同的盐度调节方式构建海水养殖生物絮凝系统,首先采用了盐度直接调节的方式和盐度缓慢调节的方式培养生物絮凝系统,其次由于淡水生物絮团构建时间明显较海水生物絮团构建所需时间短,故以先培养淡水生物絮团,再缓慢调节盐度驯化成海水絮团的淡水驯化的方式培养生物絮凝系统,旨在探索出海水生物絮团培养的最佳盐添加策略,以缩短培养周期。
1 材料与方法
1.1 试验装置及材料
本试验共用9个容积为100 L的圆柱形养殖水桶,每3个桶用两台充气泵。培养絮体所用的原料为鳗鱼饲料(水分≤10.0%,粗蛋白≥48.0%,赖氨酸≥2.5%,粗脂肪≥4.0%,粗纤维≤3.0%,粗灰分≤17.0%,1.0%≥总磷≥2.8%)。
1.2 试验设计
将9个桶分为盐度直接调节组、盐度缓慢调节组、淡水驯化组3组,每组设3个平行,每个桶加70 L自来水,曝气3 d后每个桶加35 g鳗鱼饲料,将温度控制在约25 ℃,随后进行3组盐度30的生物絮凝系统的启动,试验进行到3个系统成熟为止。盐度直接调节组是试验初期一次性直接加盐使盐度为30,闷曝(絮体培养前3 d闷曝72 h:曝气8 h、停止曝气16 h,依次循环3 d为止)结束后进行絮体培养。盐度缓慢调节组是闷曝结束后,每日盐度增加5(9:00开始,每隔3 h增加1),至盐度30为止。淡水驯化组是在闷曝后先进行淡水絮体培养,待淡水絮体培养好后,按盐度缓慢调节组的方式调控盐度。生物絮团启动阶段,通过添加碳酸氢钠使碱度保持在约250 mg/L(以碳酸钙计)[14],用葡萄糖(古阜丰生物科技有限公司,内蒙古)补充所需碳源,使碳氮比(氮为氨氮形式)为15,通过测盐度来添加因蒸发而损失的水分。启动完成后,监测3个处理组对10 mg/L的氨氮(10 mg/L的氨氮采用每升絮体中加3.82 mg氯化铵来调控)的去除效果。
1.3 试验指标与测定方法
1.3.1 水质指标的测定
每隔1 d检测水体的温度、pH、溶解氧(WTW Multi 3430,德国)并测定总氮、氨氮、亚硝酸盐氮、硝酸盐氮、溶解性有机碳和碱度[15]。总氮采用过硫酸钾氧化—紫外分光光度法(型号UV20上海尤尼柯)测定。水样经0.45 μm滤膜抽滤后测定三态氮及溶解性有机碳,其中亚硝酸盐氮、硝酸盐氮和氨氮含量分别采用重氮—偶氮法、锌镉还原法和次溴酸钠氧化法测定,溶解性有机碳含量使用多功能碳氮比分析仪(Multi N/C 2100,德国)测定,碱度采用酸碱滴定指示法测定。
1.3.2 絮体成分指标的测定
每20 d进行生物絮体指标测定。总固体悬浮颗粒物采用称量质量法测定,5 min和15 min的絮体沉降体积用英霍夫式锥形管测定。
1.3.3 生物絮体微生物样品的采集与测序
生物絮体菌样的采集:盐度直接调节组和盐度缓慢调节组在75 d取样,淡水驯化组在75 d和39 d分别取样。每次取50 mL水样经0.22 μm的滤膜抽滤后,冰箱-80 ℃保存,送至上海美吉生物医药科技有限公司进行高通量测序。
1.4 数据分析
试验数值用平均值±标准差形式表示,用Excel 软件统计结果并绘制相关图表。用SPSS 19.0统计软件进行单因素方差分析,用 LSD 进行多重比较,P<0.05为差异显著。
2 结果与分析
2.1 反应系统启动阶段
2.1.1 三态氮的动态变化
试验期间,3个处理组中pH、溶解氧、温度、溶解性有机碳等水质指标见表1,均无显著性差异(P>0.05)。盐度直接调节组、盐度缓慢调节组、淡水驯化组的碱度均值分别为(250.18±27.74) mg/L、(224.40±20.07) mg/L和(188.19±54.54) mg/L,有明显差异(P<0.05),淡水驯化组碱度明显低于其他两组。

表1 启动阶段3个处理组中各水质指标的平均值、最小值和最大值Tab.1 Mean,min and max values of water quality parameters in three different treatment groups during start-up phase
(续表1)

指标Index组别 Group直接盐度调节组Direct salinity regulation group盐度缓慢调节组Salinity slowly regulated group淡水驯化组Freshwater domestication group亚硝酸盐氮/mg·L-1NO2--N平均值 Mean11.97±13.93a4.97±5.99b3.67±6.54b最大值 Max34.17±2.3516.33±0.4622.83±0.85最小值 Min0.01±0.010.02±0.000.01±0.01硝酸盐氮/mg·L-1NO3--N平均值 Mean9.19±13.92b13.82±0.14.68ab19.72±16.77a最大值 Max38.22±1.2338.99±0.2440.54±0.71最小值 Min0.00±0.000.00±0.000.00±0.00总氨氮/mg·L-1NH4+-N平均值 Mean2.76±3.83a2.67±4.16a2.81±4.47a最大值 Max10.83±1.5315.16±1.4517.89±2.74最小值 Min0.01±0.000.00±0.000.00±0.00总氮/mg·L-1TN平均值 Mean57.01±3.00a55.01±4.14a58.50±5.43a最大值 Max62.34±0.5567.08±0.9967.67±3.64最小值 Min49.38±1.1947.83±0.6147.87±0.46溶解性有机碳/mg·L-1DOC平均值 Mean22.29±8.47a19.25±7.14a20.54±6.84a最大值 Max45.38±2.6837.81±4.1438.89±9.14最小值 Min7.41±1.143.61±1.1310.55±2.29碱度/mg·L-1Alk平均值 Mean250.18±27.74a224.40±20.07b188.19±54.54c最大值 Max281.67± 1.11261.66±9.63264.80±5.08最小值 Min194.97±5.87181.42±5.4781.59±6.39
注:同行数据上标不同字母的平均值间存在显著差异(P<0.05).
Note: means with different superscripts in the same line are significantly different (P<0.05).
3个处理组中,三态氮和总氮含量随盐度添加方式的动态变化见图1。3个处理组中氨氮含量的变化无显著差异(P>0.05),均先升后降,其中盐度直接调节组氨氮含量在第9 d达峰值(10.83±1.53) mg/L,第39 d降至(0.01±0.00) mg/L;盐度缓慢调节组在第9 d达峰值(15.16±1.45) mg/L,第19 d降至(0.30±0.36) mg/L;淡水驯化组在第5 d达到峰值(17.90±2.74) mg/L,第23 d降至(0.45±0.26) mg/L(图1a)。虽然淡水驯化组氨氮含量先升高至峰值,但盐度缓慢调节组先于盐度直接调节组和淡水驯化组降至低含量水平。后期淡水驯化组氨氮含量有所波动,第55 d时升至(1.18±0.87) mg/L。3个处理组中亚硝酸盐氮的变化趋势随氨氮含量的降低均先升后降(图1b)。其中盐度缓慢调节组分别在第13、17 d开始上升,盐度直接调节组第23 d才开始上升。盐度直接调节组亚硝酸盐氮含量峰值达(34.17±2.35) mg/L,盐度缓慢调节组、淡水驯化组峰值分别为(16.33±0.45) mg/L、(22.83±0.85) mg/L,盐度直接调节组峰值显著高于盐度缓慢调节组、淡水驯化组两组(P<0.05)。虽然盐度缓慢调节组亚硝酸盐氮含量先升高,但淡水驯化组先于盐度缓慢调节组在第37 d降至(0.20±0.14) mg/L,盐度缓慢调节组在第49 d时降至(0.10±0.06) mg/L,盐度直接调节组直到63 d时降至(0.02±0.01) mg/L。后期除淡水驯化组亚硝酸盐氮含量在57 d升至(4.04±0.31) mg/L,有所波动外,3个处理组亚硝酸盐氮含量均低于0.50 mg/L。3个处理组中硝酸盐氮含量的变化总趋势是先维持较低含量水平,后期逐渐升高(图1c)。淡水驯化组在25 d时开始上升,在41 d时达到(37.99±1.57) mg/L,盐度直接调节组硝酸盐氮含量的变化与淡水驯化组有显著差异(P<0.05),第49 d时才开始上升,第61 d达到(34.75±0.54) mg/L。盐度缓慢调节组硝酸盐氮含量变化与盐度直接调节组、淡水驯化组无显著差异(P>0.05),第33 d开始上升,在55 d达到(30.94±0.85) mg/L。3个处理组中总氮含量差异不显著(P>0.05),在(47.83±0.61) mg/L和(67.67±3.64) mg/L之间波动(图1d)。

图1 3个处理组中氨氮(a)、亚硝酸盐氮(b)、硝酸盐氮(c)及总氮(d)的动态变化Fig.1 Dynamics of total ammonia-N(a), nitrite-N(b), nitrate-N(c) and total nitrogen(d) in the three different groups
2.1.2 絮体沉降体积与总固体悬浮物含量
3个处理组中5 min的絮体沉降体积波动幅度较大且差异显著(P<0.05)。盐度直接调节组第7 d 时,5 min的絮体沉降体积达到最大值(60.00±0.00) mL/L,第9 d开始降至(0.00±0.00) mL/L,第43 d开始上升,至最高值(12.33±1.25) mL/L;盐度缓慢调节组5 min的絮体沉降体积在前57 d先上升后,维持在40.00~65.00 mL/L,在第59 d时突降至(0.00±0.00) mL/L,而第65 d时又升至(80.67±14.82) mL/L,最后维持在约60.00 mL/L;淡水驯化组5 min的絮体沉降体积先升高,第15 d达到最大值(106.67±36.82) mL/L,后又降低,在第47 d时降至(2.00±0.00) mL/L,后期在(6.00±1.63) mL/L至(44.00±9.09) mL/L之间波动(图2a)。3个处理组15 min的絮体沉降体积变化趋势中,盐度缓慢调节组、淡水驯化组较为一致,盐度直接调节组和盐度缓调节组差异显著(P<0.05)。其中盐度直接调节组和淡水驯化组15 min的絮体沉降体积先升高,分别在第19 d和13 d达峰值(103.33±1.63) mL/L和(76.67±12.47) mL/L,后逐渐降低,分别在第45 d和47 d后维持在2.00~18.00 mL/L和18.00~53.00 mL/L。盐度缓慢调节组试验期间15 min的絮体沉降体积变化不大,自试验开始后升至(30.33±5.56) mL/L,维持在30.00~50.00 mL/L,试验后期稍上升,但上升幅度不大(图2b)。
盐度直接调节组和盐度缓慢调节组总固体悬浮颗粒物含量变化一致,无明显差别(P>0.05),其中盐度直接调节组总固体悬浮颗粒物含量为1400~2000 mg/L;盐度缓慢调节组总固体悬浮颗粒物含量为950~2000 mg/L;淡水驯化组总固体悬浮颗粒物含量先维持在350~550 mg/L,后迅速升至1300~1800 mg/L,较盐度直接调节组和盐度缓慢调节组有显著性差异(P<0.05)(图3)。
2.1.3 3个处理组生物絮凝系统中微生物多样性
对3个处理组淡水组(淡水驯化组前期淡水启动完成组)和海水启动完成组(盐度直接调节组、盐度缓慢调节组、淡水驯化组)4组生物絮团进行了以下方面的多样性分析。
2.1.3.1 微生物多样性及丰度
对样本序列在97 %的相似水平下进行聚类分析,得到微生物运算分类单元水平的物种韦恩图(图4)。盐度直接调节组、盐度缓慢调节组、淡水驯化组、淡水组中运算分类单元分别为421、459、505和436个,4组共有的运算分类单元为93个,占4组总数的11.44%,盐度直接调节组、盐度缓慢调节组和淡水驯化组共有的运算分类单元为256个,占3组总数的44.83%,淡水组独有的运算分类单元为242个,占淡水组的55.51%,淡水组和淡水驯化组共有的运算分类单元为62个,明显较淡水组和盐度直接调节组以及淡水组和盐度缓慢调节组共有的运算分类单元多(淡水组与盐度直接调节组和淡水组与盐度缓慢调节组分别共有的运算分类单元分别为4个和9个)。上述试验结果表明,盐度直接调节组、盐度缓慢调节组、淡水驯化组3组的物种运算分类单元无明显差异,但是,淡水组与其他3组运算分类单元有显著性差异。

图2 3个处理组中絮体沉降体积5 min(a)和15 min(b)的动态变化Fig. 2 Dynamic changes in flocs volume of FV-5 min(a) and FV-15 min(b) in the three different groups

图3 3个处理组中总固体悬浮物含量的动态变化Fig.3 Dynamics of total suspended solids in the three different groups
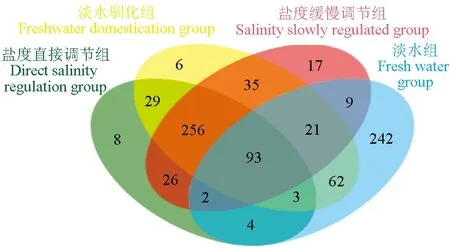
图4 3个处理组的物种韦恩图Fig.4 Species Venn diagram of the three different groups
通过对单样本的Alpha多样性分析可以反映微生物群落的多样性和丰度。反映群落多样性的常用指数有:香农指数(香农指数值越大,群落多样性越高)和辛普森指数(辛普森指数值越大,群落多样性越低)。反映群落丰度的常用指数有Chao和Ace指数。除淡水组多样性略高于其他3组,盐度直接调节组和盐度缓慢调节组多样性无明显差异;结合各组的运算分类单元值,以及Chao、Ace指数,发现盐度直接调节组、盐度缓慢调节组和淡水组微生物物种的丰度均低于淡水驯化组(表2)。
2.1.3.2 微生物门水平和纲水平的群落结构
在门水平上,盐度直接调节组和盐度缓慢调节组的主要优势菌群为拟杆菌门和变形菌门,前者占盐度直接调节组和盐度缓慢调节组菌群的37.77%和38.77%,后者占27.34%和27.23%,放线菌门丰度也较高,分别占盐度直接调节组和盐度缓慢调节组的15.18%和14.55%;放线菌门为淡水驯化组和淡水组的主要优势菌群,丰度分别为33.22%和 34.18%。除放线菌门外,淡水驯化组主要优势菌群还有拟杆菌门和变形菌门,丰度分别为36.37%和17.51%,淡水组主要优势菌群还有变形菌门,丰度占淡水组菌群的40.71%(图5a)。盐度直接调节组、盐度缓慢调节组、淡水驯化组3组拟杆菌门的丰度明显高于淡水组(P<0.05),淡水驯化组、淡水组放线菌门明显较盐度直接调节组、盐度缓慢调节组高(P<0.05),淡水组变形菌门明显高于其他3组(P<0.05)。绿弯菌门、浮霉菌门和Parcubacteria在4组中丰度也较高,但差异不显著(P>0.05)(图6a)。

表2 3个处理组物种的丰度和多样性Tab.2 The abundance and diversity of species in three different groups
在纲水平上,盐度直接调节组和盐度缓慢调节组中优势菌群有黄杆菌纲(其丰度分别占盐度直接调节组和盐度缓慢调节组的25.13%和21.91%)、放线菌纲(15.18%、14.55%)、α-变形菌纲(14.36%、17.56%)和鞘脂杆菌纲(11.25%、15.69%),其中γ-变形菌纲和暖绳菌纲丰度也较高;淡水驯化组主要优势菌群有黄杆菌纲(31.69%)和放线菌纲(33.22%)(图5b)。α-变形菌纲在淡水驯化组中也有较高丰度,占12.12%;淡水组主要优势菌纲为放线菌纲(34.18%)和α-变形菌纲(27.05%),此外γ-变形菌纲和暖绳菌纲在淡水组中丰度所占比例也较高(图5b)。淡水驯化组、淡水组中放线菌纲丰度明显较盐度直接调节组和盐度缓慢调节组高(P<0.05),淡水组黄杆菌纲和α-变形菌纲丰度与其他3组有明显差异(P<0.05),淡水组γ-变形菌纲和暖绳菌纲的丰度明显较淡水驯化组高(图6b)。


图5 3个处理组优势菌群在门水平(a)和纲水平(b)上的分布Fig.5 Predominant bacterial community at phylum level(a)and class level(b)in the three different groups


图6 3个处理组中优势菌群在门水平(a)和纲水平(b)分布的差异性Fig.6 The differences in predominant bacterial community at phylum level(a) and class level(b) in the three different groups
2.1.3.3 微生物属水平上物种的组成
对4组样本的菌群进行了群落属水平物种组成heatmap图和样本聚类树分析(图7)。淡水组优势菌属与盐度直接调节组、盐度缓慢调节组、淡水驯化组3组优势菌属组成存在显著差异,而盐度直接调节组、盐度缓慢调节组和淡水驯化组3组优势菌属组成及丰度差异不显著。盐度直接调节组、盐度缓慢调节组、淡水驯化组3组的主要优势菌属为Leptobactrium(在盐度直接调节组、盐度缓慢调节组、淡水驯化组3组中丰度分别占27.00%、24.00%和34.00%,)、norank_f_Segniliparacea(9.00%、13.00%、32.00%)、Amaricoccus(4.00%、9.00%和7.00%,),盐度直接调节组优势菌属还有norank_f_Saprospiraceae(10.00%)、norank_f_Caldilineaceae(6.00%)、副球菌属(Paracoccus)(5.00%)、红球菌属(Rhodococcus)(5.00%),盐度缓慢调节组优势菌属还有Phaeodactylibacter(9.00%)和Norank_f_Anaerolineaceae(5.00%);淡水组优势菌属主要有中村氏菌属(Nabamurella)(18.00%)、norank_f_Caldilineaceae(12.00%)、norank_f_Segniliparacea(10%)、Woodsholea(9.00%)、溶杆菌属(Lysobacter)(8.00%)、剑菌属(Ensifer)(6.00%)、副球菌属(6.00%)、Paenarthrobacter(5.00%)。
2.2 启动完成后氨氮的转化效果
在10 mg/L的氨氮处理过程中,3组氨氮含量逐渐降低后,维持在低含量水平,3组间无显著性差异(P>0.05)(图8a)。其中盐度直接调节组最先在5 h时降至(0.41±0.14) mg/L,后降至低于0.04 mg/L;淡水驯化组在第6 h降至(0.33±0.06) mg/L,后降至低于0.04 mg/L;盐度缓慢调节组在第7 h降至0.23±0.04 mg/L,较盐度直接调节组和淡水驯化组慢,后降至低于0.07 mg/L。
随着氨氮含量的降低,3个处理组中亚硝酸盐氮含量先升后降,其中盐度直接调节组最先在第5 h升高至峰值(0.99±0.16) mg/L,在第9 h降至(0.05±0.01) mg/L;淡水驯化组在第6 h升至峰值(0.80±0.02) mg/L,在第12 h降至(0.05±0.01) mg/L;盐度缓慢调节组在第6 h升至峰值(1.27±0.08) mg/L,在第13 h降至(0.03±0.04) mg/L。

图7 物种属水平的相对丰度Fig.7 Relative abundance of batterial clusters at genus level in the three groups
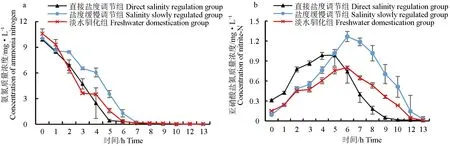

图8 3个处理组中氨氮(a),亚硝酸盐氮(b),硝酸盐氮(c)及总氮(d)的动态变化Fig.8 Dynamics of total ammonia-N(a),nitrite-N(b),nitrate-N (c)and total nitrogen(d) in the water in the three different groups
3组间亚硝酸盐氮的变化无显著性差异(P>0.05)(图8b)。
盐度直接调节组硝酸盐氮质量浓度由最初的(38.69±2.30) mg/L降至最终的(36.57±2.32) mg/L;盐度缓慢调节组和淡水驯化组硝酸盐氮含量始终无明显变化(P>0.05)(图8c)。
3个处理组中,总氮含量均有所升高。盐度直接调节组由(77.44±4.76) mg/L升至(82.55±2.19) mg/L;盐度缓慢调节组由(86.28±5.54) mg/L升至(89.33±3.52) mg/L;淡水驯化组由(79.24±1.51) mg/L升至(81.20±2.24) mg/L。盐度直接调节组总氮含量较高于盐度缓慢调节组和淡水驯化组(图8d)。
3 讨 论
3.1 反应系统启动阶段
3.1.1 不同盐度调节方式对生物絮凝反应器启动过程中水质的影响
在采用有机粪便或饲料等培养生物絮凝的氮素转化过程中,首先会发生氨化过程,即氨化细菌将含氮的饲料粪便等有机物降解为无机氨氮。从系统中氨氮含量的动态变化看,较淡水驯化组,培养初期发生的氨化过程中,盐的添加对有机物降解为无机氨有一定的滞后作用,即盐度可能对氨化细菌有一定的抑制作用,但是抑制效果不明显,且初期缓慢分批增加盐度的处理组氨氮先降至低水平,说明有可能盐度缓慢调节的方式有助于氨氮的转变;结合氨氮和亚硝酸盐氮含量的变化,3个处理组中直接调节盐度的方式,氨氮转化为亚硝酸盐氮的过程比前期不添加盐的淡水驯化组明显滞后,氨氧化细菌明显被抑制;但是缓慢调节时,氨氮的抑制作用明显减弱,甚至不存在,说明系统中氨氧化细菌对盐度冲击具有一定的缓冲能力。后期硝酸盐氮含量的积累过程表明,盐度明显抑制亚硝酸盐氮氧化过程,而直接盐度调节的方式,抑制作用更明显。本试验结果与Pronk等[13]的研究结果一致,在好氧颗粒序批式反应器中,盐离子对氨氧化无明显的抑制作用,但明显抑制亚硝酸盐氮氧化进程。
整个启动阶段中,3个处理组总氮含量无明显变化,说明整个试验过程中,几乎不存在反硝化过程和外界氮气等的固氮作用。试验后期淡水驯化组氨氮含量有所积累,可能是系统中存在明显的异养型细菌。后期氨氮含量很低,碳源添加减少,硝化型细菌逐渐占优势,氨氮不能被直接利用。结合不同添加方式中三态氮和总氮含量的动态变化,先构建淡水生物絮团,再驯化成海水生物絮团的淡水驯化组,培养周期最短,较直接调节盐度的方式缩短了约20 d,较初期缓慢分批添加盐的方式,缩短了5~10 d,但启动完成后,盐度缓慢调节组的系统运行更稳定,启动所需时间和系统稳定性看,盐度缓慢调节组更有利于海水生物絮凝系统的构建。
3.1.2 不同盐度调节方式对启动过程中生物絮体沉降性和总固体悬浮物含量的影响
不同盐度添加方式试验组的生物絮团培养过程中,对比淡水驯化组,盐度直接调节的方式,絮团聚积,污泥膨胀减小,严重影响絮体的沉降性能,而盐度缓慢调节的方式,对絮团的沉降性无明显影响。这与王淑莹等[16-17]的研究一致,高盐度的海水会使活性污泥中原生动物和丝状菌逐渐减少,菌胶团变得更加密实。但是后期盐度缓慢调节组5 min的沉降体积突然降至0.00 mg/L的原因有待于进一步探究。
由总固体悬浮颗粒物含量的动态变化可见,添加盐会使系统中总固体悬浮颗粒物含量明显升高。试验后期在自来水中加入海水晶,当盐度为30时,经滤纸过滤测其总固体悬浮颗粒物值,发现所测值与盐度直接调节组(盐度为30)和淡水驯化组前期(盐度为0.2)总固体悬浮颗粒物的差值几乎相等,即海水生物絮凝系统中盐的添加会增加整个系统的总固体悬浮颗粒物含量,因此培养海水生物絮凝时,所需的总固体悬浮颗粒物值应是所测实际值减去相应海水盐度对应的总固体悬浮颗粒物值。
3.1.3 不同盐度调节方式对生物絮凝系统启动过程中微生物菌群结构的影响
絮团微生物高通量测序结果表明,3个处理组中,淡水组(淡水启动完成组)絮团中微生物多样性高于其他3组,说明盐度30的海水环境中一部分微生物种群会受到盐的冲击而死亡,生物多样性降低,而淡水驯化组微生物的丰度高于其他3组,说明淡水系统中某些微生物种群可能更适宜在高盐环境中生长,随着盐度缓慢加入,对高盐环境适应后迅速生长,加之淡水启动完成组微生物多样性最高,缓慢加入盐后,适宜高盐环境的微生物丰度增加。盐度直接调节组略低于盐度缓慢调节组,说明直接调节盐度对微生物冲击作用较大。这与文献[18-20]的研究结果一致。
对微生物门水平的分析发现,高盐环境有利于拟杆菌门细菌的生长,但抑制了变形菌门细菌的生长。系统中若存在较高丰度的放线菌门细菌,盐度缓慢增加对放线菌门细菌无抑制作用,但系统中放线菌门细菌丰度很低时,增加盐度会抑制放线菌门细菌的生长。对微生物纲水平的分析发现,盐度有利于黄杆菌纲和鞘脂杆菌纲细菌的生长,但抑制了α-变形菌纲细菌的生长,对放线菌纲细菌的影响同其对放线菌门细菌的影响。对微生物属水平的分析表明,Leptobactrium是海水生物絮凝系统中的优势菌群,不受盐调节方式的影响,只要系统中存在盐度,就会刺激Leptobactrium的生长,该菌属黄杆菌科,占海洋细菌的33.3%[21]。添加盐后系统中norank_f_Segniliparacea的丰度明显升高,说明将淡水生物絮凝驯化成海水生物絮凝时刺激了norank_f_Segniliparacea的生长。盐度缓慢调节组Phaeodactylibacter的丰度明显高于其他3组。安治武[22]在研究微生物制剂对养殖水体的净化效果时发现,Phaeodactylibacter是将硝酸盐还原为亚硝酸盐的优势硝化细菌,其丰度占13.69%。对微生物的分析发现,盐度调节方式对微生物丰度有一定影响,但是对微生物群落结构无明显影响,故3种盐度的调节方式均可用于生物絮团的构建。
3.2 启动完成后不同盐调节方式下氨氮等水质指标的变化
对10 mg/L的氨氮去除效果的监测发现,氨氮、亚硝酸盐氮和硝酸盐氮含量的动态变化无明显差异(P>0.05),说明在海水生物絮凝系统构建过程中,盐度调节方式对氨氮的去除效果无明显影响,3种盐度调节方式均可用于海水生物絮凝系统的构建。这与Kincannon等[23]的研究结果一致,经过初期的滞后期后,微生物种群能够适应高盐度环境,对絮凝的形成无持续抑制作用。
4 结 论
不同盐度调节方式下海水生物絮团培养的启动阶段中,三态氮、絮团沉降性、微生物群落结构和启动完成后氨氮转化的分析结果表明,在培养好的淡水生物絮凝系统中缓慢调节盐度的淡水驯化调节盐度方式,启动培养周期最短;盐度缓慢调节的方式,启动培养周期较淡水驯化组长,但启动完成后系统运行更稳定;直接调节盐度的方式运行周期最长。淡水驯化组微生物群落丰度较其他两组高,但不同盐度调节的海水生物絮凝启动的系统中微生物群落结构无显著性差异,结合启动完成后,3个处理组氨氮去除效果无显著差异,故3种盐度调节方式均可用于海水生物絮凝系统的构建。综上所述,盐度缓慢调节的方式更有利于海水生物生物絮凝系统的构建。
