小鼠精原细胞分化的蛋白质组学研究
2020-03-19李堃刘悦黄鹏杨智昉胡茜张颖李志宏吕叶辉梁乐
李堃 刘悦 黄鹏 杨智昉 胡茜 张颖 李志宏 吕叶辉 梁乐
(1. 上海健康医学院基础医学院,上海 201318;2. 上海健康医学院临床医学院,上海 201318;3. 上海交通大学医学院,上海 200025)
随着时代的进步,辅助生殖技术大大发展,而在此过程中精子的选择尤为重要。精子在雄性动物遗传信息传递过程中发挥着重要作用,其发生过程相对复杂。精子发生过程中,精原细胞作为精子发生的“种子”,起着十分重要的作用。根据分化的不同,精原细胞可以分为两大类:未分化的精原细胞(Undifferentiated spermatogonia)和分化中的精原细胞(Differentiating spermatogonia)。未分化的精原细胞包括单一型和合胞体型的A型精原细胞(A single、A paired、A aligned)。A single可以通过有丝分裂形成新的A single细胞或者A paired和A aligned细胞,从而维持精原细胞的数量的稳定。在精原细胞自身增殖过程中,有部分细胞发生分化,分化过程中依次形成A1精原细胞、A2精原细胞、A3精原细胞、A4精原细胞、In精原细胞和B型精原细胞。B型精原细胞再次分裂后则形成初级精母细胞进行减数分裂。精原细胞的命运和调控精原细胞的增殖或者分化的机制均尚未明确。未分化精原细胞与分化中精原细胞蛋白质组有所不同。因此有效地将两类精原细胞蛋白质组的表达差异进行探索,并且鉴定与精原细胞分化相关的蛋白质,对于精原细胞分化的研究具有重要的意义。
未分化的精原细胞和分化中的精原细胞在形态上很难区分,其主要依靠特异性标志物进行区分[1]。因此很难从形态学上对精原细胞的分化调控进行直观分析。而未分化的精原细胞和分化中的精原细胞来自同一个体,其基因组相同,因此用基因组学的方法对精原细胞分化的调控的研究也受到局限。而因为分化状态的不同,两类精原细胞的基因表达调控水平(蛋白组)会发生显著变化。因此,通过比较蛋白质组学研究能对精原细胞分化过程中蛋白质调控网络有广泛而完整的认知,找到精原细胞分化过程中的发生改变的重要蛋白。蛋白质组学方法通过高通量、大规模水平去研究细胞或机体内动态变化蛋白质的组成、翻译后修饰及表达水平[2],可以反映细胞或者组织整体的蛋白质动态变化[3],因此利用蛋白组学的方法对两类精原细胞的研究具有整体性。在蛋白质组学研究的诸多方法中,高效液相色谱串联质谱方法(LC-MS/MS)具有高灵敏度检测范围、高通量和高质量的优势[4],所以我们选择LC-MS/MS的方法对两类精原细胞进行研究。
通过蛋白质组学的方法将两类精原细胞的蛋白质组鉴定出来后,我们将获取到大量而复杂的蛋白质组数据。因此需通过肽段序列的注释、数据库的比对、GO功能分析以及KEGG通路分析等生物信息学[5]的方法将实验结果中的有效信息筛选出来,进而对下一步实验提供方向。本研究利用高效液相色谱串联质谱方法(LC-MS/MS)方法结合生物信息学分析,从未分化和分化中两类精原细胞的蛋白水平揭示调控精原细胞分化的差异蛋白,旨为两类精原细胞的特性提供科学依据,为进一步研究精原细胞的分化的相关分子机制奠定了基础。
1 材料与方法
1.1 材料
选择生后7 d雄性C57BL/6小鼠,由中国科学院上海实验动物中心提供。抗Thy1(CD90)磁珠抗体(货号:130-049-101德国美天旎公司)、抗c-Kit(CD117)磁珠抗体(货号:130-091-224 德国美天旎公司)、胶原酶I,DNase I,胰蛋白酶(美国罗氏公司)、Laminin包被培养皿(美国BD公司)、精原细胞培养液:α-MEM培养液中添加1%FBS、1×NEAA、1×N2-1、4 ng/mL GDNF、1 000 U/mL LIF( 美 国Gibico公司)。新鲜配制使用。DPBS,乙醚,BSA等一般化学试剂购自上海化学试剂有限公司。
1.2 方法
1.2.1 精原细胞的分离、纯化
1.2.1.1 消化分离小鼠睾丸细胞
(1)每批8-10只出生7 d小鼠,取出双侧睾丸。体视镜下(30×)去除白膜,收集生精小管,加入3-4mL D-PBS。
(2)反复吹打分散生精小管,吸除上层液体,再加入3 mL DPBS,重复洗2遍。
(3)吸除DPBS,加入3 mL胶原酶I 1 mg/mL,于37℃孵育10-15 min。每隔5 min小心吹打,直至无明显组织团块,自然沉降5 min。
(4)吸除胶原酶,DPBS洗2遍,去除DPBS。加入2 mL 0.25%和0.2 mL 10 mg/mL DNase I,37℃孵育2-5 min,充分吹打,显微镜下观察,细胞基本分散,呈单细胞状态。
(5)加入5 mL PBE液终止蛋白酶反应。将细胞悬液经细胞滤器过滤,收集滤过的细胞悬液,200×g离心2 min,收集细胞沉淀。
1.2.1.2 磁珠分选纯化精原细胞
(1)200 μL PBE溶液重悬细胞,加入20 μL抗Thy1(CD90)或者抗c-Kit(CD117)磁珠抗体,吹打混匀,4℃孵育20 min。
(2)将磁珠分选柱置于磁力架上,加入4 mL PBE溶液洗涤柱子。然后将抗体标记的细胞悬液小心加在分选柱中心,待液体完全进入柱体后,加入6 mL PBE溶液洗涤细胞。
(3)用6 mL PBE溶液重复洗涤3次。
(4)将分选柱从磁力架上取下,置于15 mL离心管,向分选柱内加入3 mL PBE溶液,将液体快速推出分选柱,收集细胞悬液,即为分离纯化的精原细胞。
1.2.2 蛋白质谱分析
1.2.2.1 蛋白质谱分析 以8-10只小鼠取到的细胞为一组。将磁珠分选纯化分离的细胞以PBS(含蛋白酶抑制剂)洗涤3次,充分去除BSA。-80℃冻存。共收集到Thy1阳性细胞3组,c-kit阳性细胞4组,进行生物学重复实验。将细胞沉淀交给中国科学院上海生化所蛋白质组分析中心进行蛋白质谱分析:蛋白酶解,并置于反相高效液相层析柱上洗脱蛋白,然后以LTQ-Orbitrap高效液相色谱组合式高分辨率质谱联用系统进行蛋白质谱分析。每个样品重复3次,以排除实验误差。
1.2.2.2 蛋白定量比较及生物信息学分析
(1)利用Maxquant软件将肽段质谱原始数据在小鼠IPI数据库中进行比对,匹配蛋白质。以非标记定量的方法对质谱结果中的蛋白进行定量,并比较两组中含量差异的蛋白质(P<0.05且差异>1.5倍)。
(2)以层次聚类分析(Hierachical cluster analysis,HCA)方法进行聚类分析,确认实验重复性。
(3)以互联网的生物信息学软件DAVID和KEGG数据库对质谱结果进行分析,推测差异蛋白的生物学分类和功能分类。
1.2.3 细胞标志基因及筛选出通路中重要基因的表达分析 以Gfrα1、Plzf作为未分化精原细胞标志,以c-Kit、Sohlh2作为分化精原细胞标志,prp4、prp8、p68、ddx1、fkbp5、top2、uba1、ube2o、tjp1和ctnna1作为筛选出通路的相关基因,磁珠分选的两组精原细胞,抽提总RNA后,反转录成cDNA。按照Premix exTaq说明书,以表1所示引物在ABI7500荧光定量PCR仪上进行定量扩增。记录CT值,用2-ΔΔCT法计算mRNA表达变化。
1.2.4 统计学处理 统计学分析应用SAS9.0统计软件进行统计学分析。流式细胞仪和免疫荧光法检测细胞纯度实验各组数据,均数±标准差(x-±s)表示,组间样本数据比较采用t检验,Real-time PCR检测标志基因表达的数据用均数±标准差(x-±s)表示,组间样本数据比较采用t检验。
2 结果
2.1 两类精原细胞的纯度
经流式细胞分选,Thy1+细胞中抗Gfrα1染色阳性率为85.65%±8.35%,而c-Kit+细胞约5.03%±1.98%(P<0.01)。 在 c-Kit+细 胞 中, 未分化精原细胞的表面标志Gfrα1阳性的细胞约2.41%±0.93%,c-Kit+细胞达到约90.02%±2.77%(P<0.01)。以抗 Gfrα1抗体为一抗对 Thy1+细胞进行染色,细胞纯度 86.83%±7.35%(P<0.01)。以抗c-Kit为一抗验证c-Kit+分选细胞,细胞纯度90.37%±3.74%(P<0.01)。

表1 Real-time PCR引物
2.2 两类精原细胞蛋白质鉴定基本结果
检测的7组样品,在“1%FDR” 的过滤标准下,共有 112 584条肽段,112 584条特异肽段和3 228个蛋白得到鉴定。两类精原细胞中含量差异的蛋白质(P<0.05且差异>1.5倍)共256个(表2)。分化中的精原细胞表达上调的蛋白质数量为193个,在分化中的精原细胞表达下调的蛋白质数量为63个。在3 228个蛋白质中,蛋白质长度主要集中在100-750个氨基酸(图1-A),蛋白质的分子量大小主要集中在100-200 kD和10-60 kD(图1-B)。

表2 两类精原细胞蛋白质鉴定结果
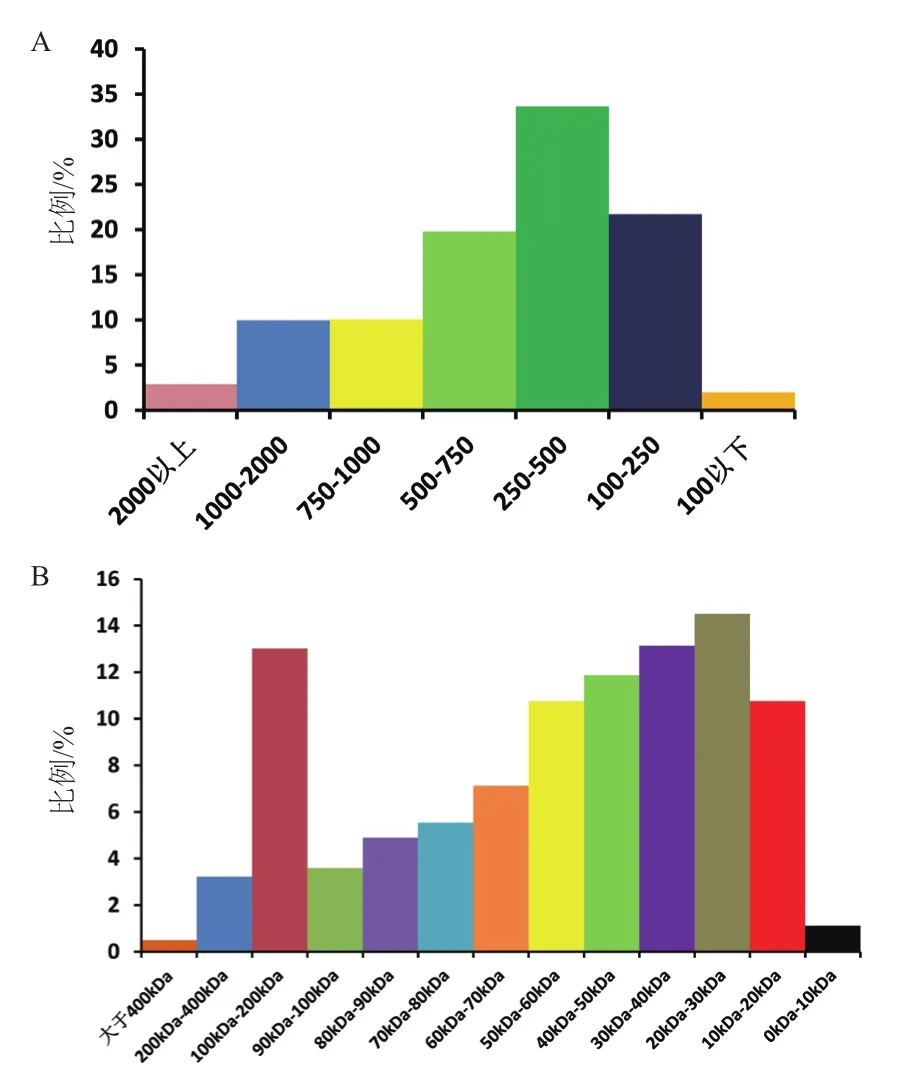
图1 蛋白质的分子量大小及长度
2.3 两类精原细胞差异表达蛋白质功能聚类
差异蛋白的富集分析发现,在生物过程方面,注释结果显示差异蛋白主要在代谢过程(Primary metabolic process),细胞代谢过程(Cellular metabolic process),分子代谢过程(Macromolecule metabolic process)和氮化合物代谢过程(Nitrogen compound metabolic process)中富集,他们占比分别17.94%,18.19%,15.06%和9.91%;在细胞组分方面,蛋白主要富集在细胞(Cell part)、细胞内组分(Intracellular part)和细胞器(Intracellular organelle)中;在分子功能方面,鉴定到的蛋白主要参与蛋白结合(Protein binding)、核苷结合(Nucleotide binding)、水解酶活性(Hydrolase activity)和核酸结合过程(Nucleic acid binding),它们占比分别达到39.13%、30.83%、21.74%和29.64%(图2)。
2.4 两类精原细胞差异表达蛋白质KEGG注释

图2 两类精原细胞差异表达蛋白质GO分析
KEGG注释结果显示:c-Kit阳性的精原细胞中上调的蛋白质中有65个蛋白质在KEGG数据库中有功能注释,共参与了12条代谢通路。其中,最主要的代谢通路是剪接体(Spliceosome)和泛素介导的蛋白水解(Ubiquitin mediated proteolysis),分别有12(6.25%)和 10(5.21%)个蛋白参与。在Kit阳性的精原细胞中下调的蛋白质中有23个蛋白质在KEGG数据库中有功能注释,共参与了6条代谢通路。其中,最主要的代谢通路是紧密连接(Tight junction),有6个(9.83%)蛋白质参与。另外,在c-Kit阳性的精原细胞中下调的蛋白质中有3个蛋白质在黏着连接(Adherens junction)通路有功能注释(图 3)。
2.5 差异蛋白质层次聚类分析
将256个差异蛋白进行层次聚类分析。左侧3列表示Thy1表达阳性的3组未分化的精原细胞,右侧4列表示c-Kit表达阳性的4组分化中的精原细胞。图中颜色表示表达量值,在分化中的精原细胞表达上调的蛋白质为绿色,表达下调的蛋白质为红色。3组Thy1+的细胞中蛋白表达的趋势基本一致,4组c-Kit+的细胞中蛋白的表达的趋势基本一致。结果如图(图4),在c-Kit+的分化中的精原细胞中,约2/3的差异蛋白表达上升。细胞分化前后标志基因及筛选出通路中相关蛋白表达分析的结果以Real-time PCR进一步分析。
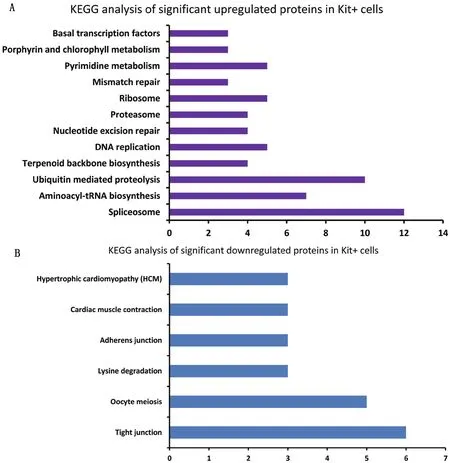
图3 在分化中精原细胞中上调蛋白质和下调蛋白质的KEGG分析
2.6 细胞标志基因及筛选出通路中相关基因的表达分析
通过荧光定量实时定量PCR(Real-time PCR)方 法 分 别 对 Gfrα1、Plzf、c-Kit、Sohlh2、prp4、prp8、p68、ddx1、fkbp5、top2、uba1、ube2o、tjp1和ctnna1基因在磁珠分选的两组细胞的mRNA的表达差异。可见在Thy1+细胞中Gfrα1和Plzf两个未分化精原细胞的标志基因的相对表达量分别可达到c-Kit+细胞的约9.47±1.29和4.40±0.59倍(P<0.01);紧密连接和黏着连接相关通路的tjp1和ctnna1基因的相对表达量分别可以达到c-Kit+细胞的3.04±0.22和2.33±0.15倍(P<0.01)。而在c-Kit+细胞中kit和sohlh2两个分化中精原细胞的标志基因的相对表达量分别可达到Thy1+细胞的约7.38±1.07和 3.88±0.28倍(P<0.01);剪接体通路相关的prp4、prp8和p68基因的相对表达量分别可以达到Thy1+ 细胞的 3.15±0.52,2.32±0.44(P<0.05)和2.60±0.14倍(P<0.01);DNA/RNA/蛋白合成相关的ddx1、fkbp5和top2 基因的相对表达量可以达到Thy1+细胞的 2.29±0.19,2.96±0.29和 3.02±0.18倍(P<0.01);泛素介导的蛋白水解通路相关的uba1和ube2o基因的相对表达量可以达到Thy1+细胞的3.27±0.36 和 2.52±0.45 倍(P<0.01)(图 5)。
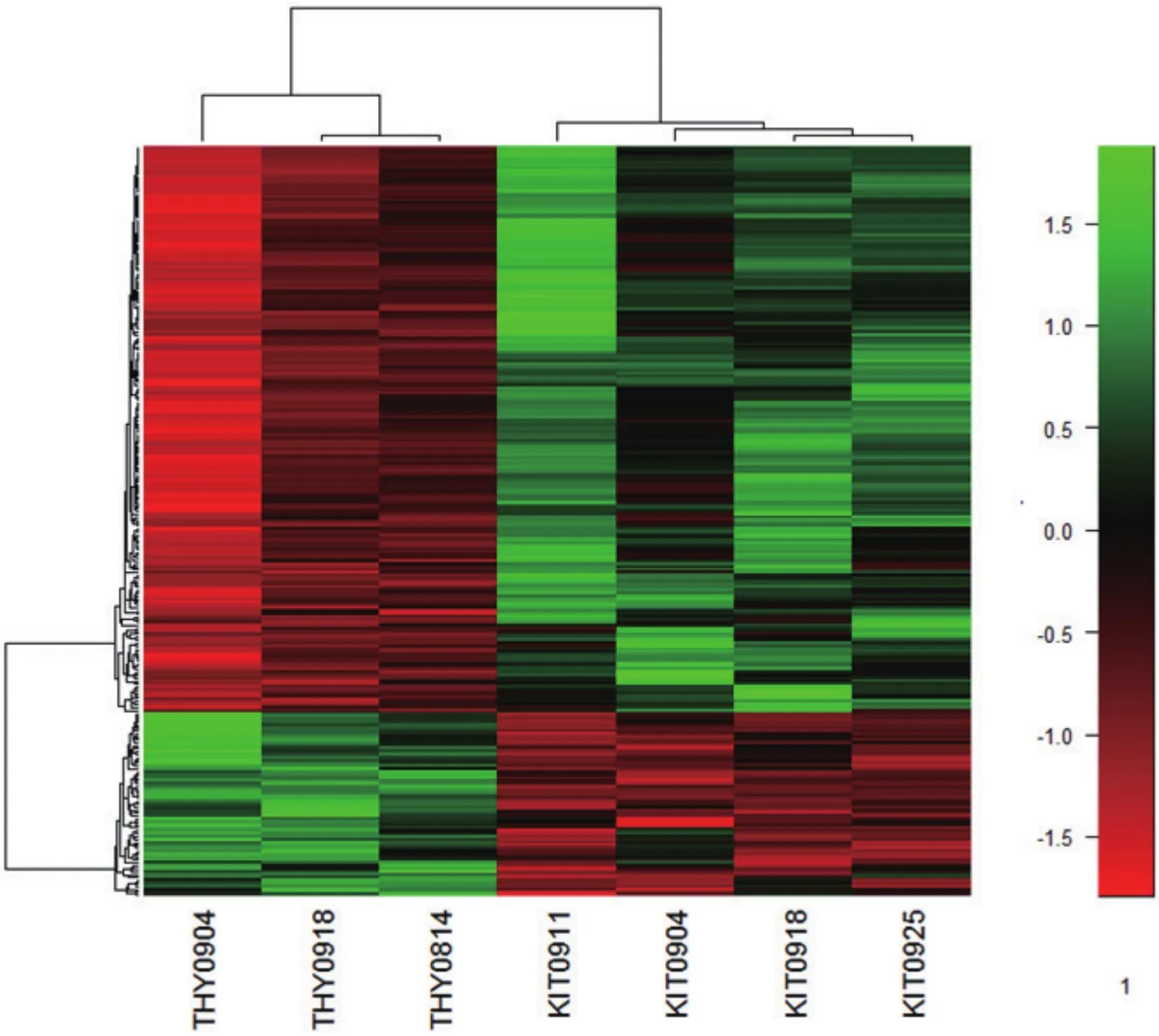
图4 差异蛋白质层次聚类分析
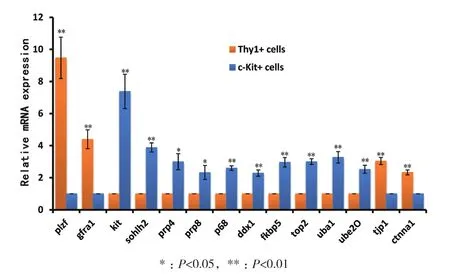
图5 Real-time PCR检测Thy1+细胞和c-Kit+细胞中的Gfrα1、Plzf、c-Kit、Sohlh2、prp4、prp8、p68、ddx1、fkbp5、top2、uba1、ube2o、tjp1 和 ctnna1基因的mRNA表达水平的相对差异
3 讨论
精子的产生依赖于一组精原细胞(Spermatogonia)的分化,它们是在婴儿时期通过其前体细胞生殖母细胞(Gonocytes)分化而形成。在整个成年期,精原细胞将自我更新或分化,以维持干细胞储备,同时为生精周期提供细胞。精原细胞进一步分化,以形成第一波生精波。精原细胞自我更新以维持干细胞的数量,以维持整个成年期的精子生成。人们较重视青春期后的精子形成,而生殖细胞发育的早期阶段直到最近才引起人们的注意。蛋白质是生命的物质基础,是有机大分子,是构成细胞的基本有机物,是生命活动的主要承担者。机体所有重要的组成部分都需要有蛋白质的参与。精原细胞的分化有大量蛋白质参与其中,未分化的精原细胞和分化中的精原细胞中的蛋白质存在大量的差异蛋白质。此前的研究都着眼于特定或不同睾丸时期的蛋白组研究[6-10]、睾丸中已经分化的不同时期的生精细胞的蛋白组研究[11]。然而,目前对于未分化的精原细胞和分化中的精原细胞中的差异蛋白质并未有过多讨论。本研究通过蛋白质组学结合生物信息学的方法,筛选出了未分化精原细胞和分化中的精原细胞的差异蛋白质并尝试揭示调控精原细胞的自我更新和分化的基因和途径。
本研究通过生物信息学数据库分析,3 228个蛋白得到鉴定。两类精原细胞中含量差异的蛋白质(P<0.05且差异>1.5倍)共256个。其中在分化中的精原细胞表达上调的蛋白质数量为193个,在分化中的精原细胞表达下调的蛋白质数量为63个。可见在精原细胞分化过程中,相对更多的蛋白质的表达上调。在3 228个蛋白质中,蛋白质长度主要集中在100-750个氨基酸的中等大小的蛋白质,蛋白质的分子量大小主要集中在100-200 kD和10-60 kD两个区间中。通过差异蛋白的富集分析发现来推测,精原细胞分化过程中,主要是参与细胞分子代谢的蛋白质的表达发生了变化,说明分化中的精原细胞和未分化的精原细胞中的细胞代谢水平有明显区别。并且通过分析细胞组分,主要是细胞内的细胞器的蛋白质表达水平出现明显差异,说明精原细胞分化过程中细胞内的成分和细胞器的种类和数量都发生了明显改变。从分子功能方面分析,鉴定到的差异蛋白主要参与蛋白结合、核苷结合、水解酶活性和核酸结合过程,说明精原细胞分化过程中细胞中的蛋白质相互作用,蛋白质与核酸的相互作用都比较旺盛,预示着分化中的精原细胞即将进入减数分裂,最终分化为成熟的精子。
KEGG注释结果显示:分化中的c-Kit阳性的精原细胞中上调的蛋白质中有65个蛋白质在KEGG数据库中有功能注释,共参与了12条代谢通路。其中,最主要的代谢通路是剪接体和泛素介导的蛋白水解,剪接体依靠RNA-RNA、RNA-蛋白质、蛋白质-蛋白质等三方面的相互作用。要涉及snRNA的碱基配对,相互识别等。它由多个核蛋白聚集而成,具有识别mRNA前体的5'剪接位点、3'剪接位点和分支点的功能[12]。这也与精原细胞分化过程中,精原细胞分化的众多基因表达调控相吻合。泛素化在蛋白质的定位、代谢、功能、调节和降解中都起着十分重要的作用。同时,它也参与了细胞周期、增殖、凋亡、分化、转移、基因表达、转录调节、信号传递、损伤修复、炎症免疫等几乎一切生命活动的调控。说明在精原细胞的分化过程中泛素化起着非常重要的作用[13]。
在分化中的c-Kit阳性的精原细胞中下调的蛋白质中有23个蛋白质在KEGG数据库中有功能注释,共参与了6条代谢通路。其中,最主要的代谢通路是紧密连接,并且有3个蛋白质在黏着连接有功能注释。在精原细胞分化为精子的过程中,精原细胞从睾丸生精上皮中支持细胞(Sertoli cells)形成的基底小室向近腔小室迁移。在此过程中,血睾屏障需要在特定的时间节点开闭。血睾屏障是生精小管与毛细血管血液之间的一层屏障结构。包括间质的毛细血管内皮、基膜、结缔组织、生精上皮基膜及支持细胞间的紧密连接[14-17]。血睾屏障的开闭取决于支持细胞间紧密连接的形成与否或紧密程度[18-19]。因此,分化中的精原细胞中表达下调的参与紧密连接的蛋白质可能与血睾屏障的调节有关系。
通过差异蛋白质层次聚类分析我们可以看到,3组Thy 1阳性细胞和4组c-Kit阳性细胞中表达的蛋白质图谱基本具有一致性,因此可以确认本实验的重复性。细胞分化前后标志基因及筛选出通路中相关基因的Real-time PCR表达分析的结果显示,剪接体通路相关的prp4、prp8和p68基因,DNA/RNA/蛋白合成相关的ddx1、fkbp5和top2基因,泛素介导的蛋白水解通路相关的uba1和ube2o基因在c-Kit+细胞中表达升高。而紧密连接和黏着连接相关通路的tjp1和ctnna1基因的c-Kit+细胞中表达降低。这些结果都与KEGG注释结果相互印证。
4 结论
本实验基于未分化精原细胞和分化中精原细胞的蛋白质组进行了鉴定及差异分析。研究发现,两类精原细胞中3 228个蛋白得到鉴定,其中含量明显差异的蛋白质共256个。差异蛋白在生物过程方面主要在代谢过程,细胞代谢过程,分子代谢过程和氮化合物代谢过程中富集;在细胞组分方面,蛋白主要富集在细胞、细胞内组分和细胞器中;在分子功能方面,鉴定到的蛋白主要参与蛋白结合、核苷结合、水解酶活性和核酸结合过程。两类精原细胞中差异蛋白质中共有88个蛋白参与了18条代谢通路。这些结果为阐明精原细胞分化的分子机制提供了新的策略与理论依据。
