血清CA19-9、CA50、PLT、PLR联合检测对胰腺导管腺癌的诊断效能
2020-03-19邹德泓侯爵常蕤杨琴唐世孝
邹德泓,侯爵,常蕤,杨琴,唐世孝
1西南医科大学附属医院,四川泸州 646000;2内江市第一人民医院
胰腺癌在我国癌症病死率统计中占据第10位,随着社会老龄化进程的加快,近年来发病率有上升趋势。胰腺导管腺癌(PC)为胰腺癌最常见的病理类型,占80%~90%,预后极差,中位生存期小于6个月,5年生存率低于1%[1]。由于其具有迅速转移到淋巴系统和远处器官的倾向,中国抗癌协会胰腺癌专业委员会《胰腺癌综合诊治指南(2018版)》推荐,根治性切除是目前治疗胰腺癌最有效的方法[2]。但由于PC早期不易发现,多数患者诊断时已进入中晚期,治疗效果欠佳。因而,早发现、早诊断、早治疗是提高PC生存率的关键。CA19-9是目前最常用的胰腺癌诊断标志物[3],约10%的胰腺癌患者Lewis抗原阴性,CA19-9不升高,而CA50可作为不表达CA19-9的 PC 患者的血清学补充[4]。已有多项研究[5~9]表明,PLT促进肿瘤发生发展,同时慢性炎症损伤在PC发生、发展、转移中起着重要作用,PLT和淋巴细胞比值(PLR)作为炎症指标在PC诊断中鲜有报道,故推测联合应用PLT、PLR与血清 CA19-9、CA50有助于提高 PC诊断效能。本研究探讨了血清CA19-9、CA50及PLT、PLR联合应用诊断PC的效能,以寻找合适的诊断方法,达到早期发现、诊断PC的目的。
1 资料与方法
1.1 临床资料 2012年5月~2019年5月西南医科大学附属医院收治PC患者108例,均符合《胰腺癌综合诊治指南(2018版)》中PC的诊断标准。排除标准:术后病理证实为胰腺其他类型肿瘤;术前经过化疗、放疗等抗肿瘤治疗;近期罹患急慢性感染性疾病;患有自身免疫性、血液系统疾病;合并有其他部位恶性肿瘤。其中男60例、女48例,年龄(55.89±9.99)岁,分化程度为低、中、高分别为36、38、34例。胰腺炎性肿块患者82例(肿块组),其中男36例、女46例,年龄(63.02±13.92)岁;胰腺假性囊肿76例(囊肿组),其中男46例、女30例,年龄(62.26±12.61)岁,术后病理证实为良性。纳入健康体检者98例作为对照组,其中男50例、女48例,年龄(62.61±9.23)岁。各组年龄、性别构成有可比性。
1.2 血清CA19-9、CA50、PLT检测及PLR计算 患者于术前清晨、健康体检者于体检日当天清晨采静脉血5 mL两管,采血后12 h内全血送西南医科大学附属医院检验科、核医学科检测。于核医学科采用MAGLUMI 2000 Plus化学发光仪及配套试剂检测血清CA19-9、CA50;于检验科采用Sysmex XN9000血常规分析流水线及配套试剂检测出PLT、外周血淋巴细胞计数等指标。以上均按照仪器及试剂使用说明书进行。PLR为外周血PLT与淋巴细胞的比值。
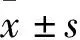
2 结果
2.1 各组血清CA19-9、CA50水平及PLT、PLR比较 各组之间PC患者血清CA19-9、CA50水平及PLT、PLR比较,Z值分别为75.543、80.046、19.476、37.417,P均<0.05。与其他三组相比,PC组血清CA19-9、CA50及PLT、PLR高(P均<0.05)。肿块组CA50血清水平较对照组高(P<0.05)。见表1。
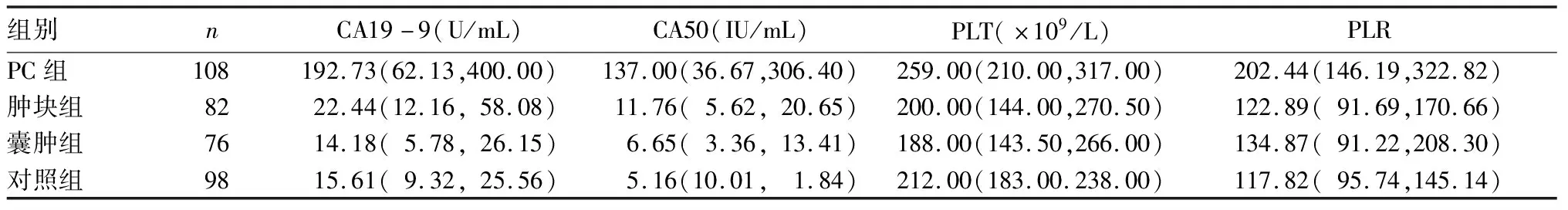
表1 各组血清CA19-9、CA50水平及PLT、PLR[M(P25,P75)]
2.2 不同分化程度PC患者血清CA19-9、CA50水平及PLT、PLR比较 不同分化程度之间PC患者血清CA19-9、CA50水平及PLT、PLR比较,Z值分别为7.729、8.066、2.734、2.340,P均<0.05。低分化与中分化PC患者血清 CA19-9、CA50比较,P均<0.05。高分化PC与低、中分化PC患者之间各指标比较,P均>0.05。3组中PLT、PLR比较,P均>0.05。见表2。

表2 不同分化程度PC患者血清CA19-9、CA50水平及PLT、PLR[M(P25,P75)]
2.3 血清CA19-9、CA50水平和PLT、PLR单项联合应用诊断PC的效能
2.3.1 以对照组为对照,上述各指标单独及联合应用诊断PC的效能 血清CA19-9诊断PC的ROC下面积为0.928,取最佳截断值为29.84 U/mL时,敏感性、特异性分别为90.91%、91.84%。血清CA50诊断PC的ROC下面积为0.932,取最佳截断值为15.54 IU/mL时,敏感性、特异性分别为87.27%、95.92%。PLT诊断PC的ROC下面积为0.719,取最佳截断值为245.00×109个/L时,敏感性、特异性分别为61.82%、83.67%。PLR诊断PC的ROC下面积为0.847,取最佳截断值为158.22时,敏感性、特异性分别为70.91%、85.71%。血清CA19-9、CA50联合应用诊断PC的ROC下面积为0.934,敏感性、特异性分别为90.91%、95.92%。血清CA19-9、血清CA50、PLT、PLR联合应用诊断PC的ROC下面积为0.973,敏感性、特异性分别为89.09%、100%。四项指标联合应用诊断PC的ROC下面积大于血清CA19-9、血清CA50、PLT、PLR、CA19-9联合CA50曲线下面积(Z值分别为2.125、2.034、2.00、4.975、3.254,P均<0.05)。联用血清CA19-9、CA50及PLT、PLR指标诊断PC的诊断效能均高于单一指标。见表3、图1。
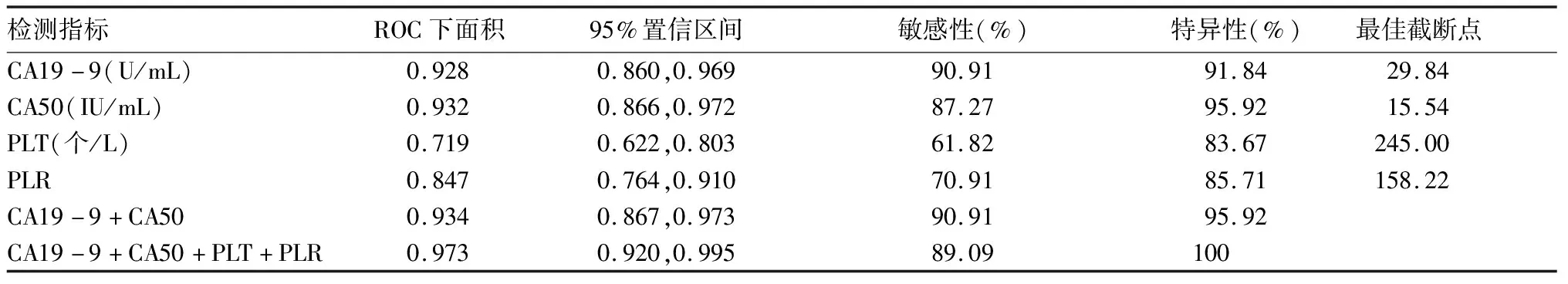
表3 以对照组为对照,各指标单独及联合应用诊断PC的效能
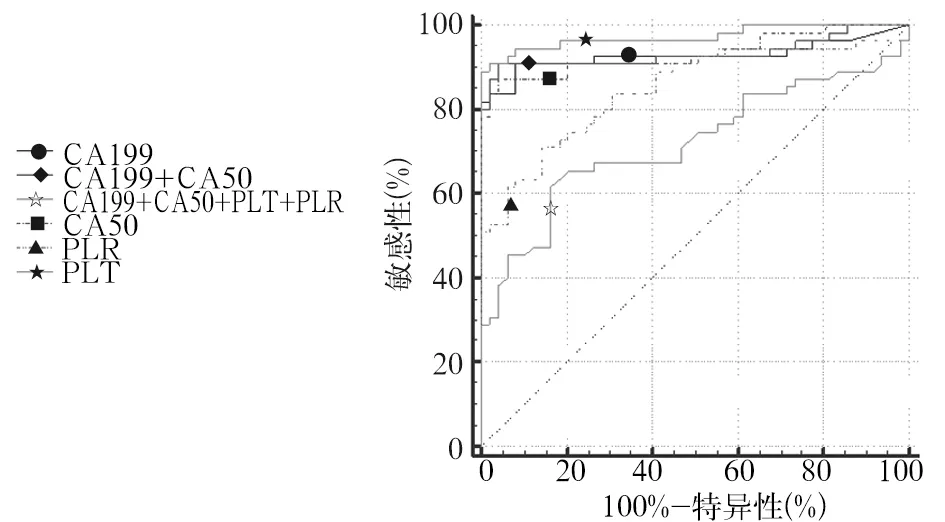
图1 以对照组为对照,四项指标独立及联合诊断PC的ROC
2.3.2 以胰腺良性肿块为对照,上述各指标单独及联合应用诊断PC的效能 血清CA19-9诊断PC的ROC下面积为0.871,取最佳截断值为78.72 U/mL时,敏感性、特异性分别为72.73%、91.14%。血清CA50诊断PC的ROC下面积为0.862,取最佳截断值为28.89 IU/mL时,敏感性、特异性分别为78.18%、91.14%。PLT诊断PC的ROC下面积为0.695,取最佳截断值为192×109个/L时,敏感性、特异性分别为83.64%、51.9%。PLR诊断PC的ROC下面积为0.727,取最佳截断值为125时,敏感性、特异性分别为89.09%、49.37%。血清CA19-9、CA50联合应用诊断PC的ROC下面积为0.871,敏感性、特异性分别为78.18%、87.34%。血清CA19-9、CA50及PLT、PLR四项指标联合应用诊断PC的ROC下面积为0.88,敏感性、特异性分别为83.64%、77.22%。四项指标联合应用诊断PC的ROC曲线下面积大于血清CA19-9、血清CA50、PLT、PLR、血清CA19-9联合CA50曲线下面积(Z值分别为2.247、2.075、2.106、4.149、3.843,P均<0.05)。联用血清CA19-9、CA50及PLT、PLR指标诊断PC效能高于单一指标,但单一指标CA19-9及CA50特异性均较高,PLR敏感性较高。见表4、图2。
3 讨论
目前已有研究报道,MUC1、MUC4等黏蛋白家族成员、磷脂酰肌醇蛋白聚糖、成纤维细胞、补体C3、补体C4、载脂蛋白E等可作为PC诊断及预后预测、复发监测的指标,但其中大部分由于检测复杂、缺乏国际统一数值区间等原因而仅处在实验研究阶段[10~12]。CA19-9是目前最常用的PC诊断标志物,是一种神经节苷脂,通常是由Lewis抗原的前体物质在一种唾液酸转移酶和一种岩藻糖转移酶的共同作用下形成。Lewis抗原包括Le-a和Le-b,这两者是由基因Le所调控,只有当个体同位基因中有一者为Le(+)时,方可表达CA19-9[13],若患者两同位基因型为双隐Le(-)Le(-),则即使患有典型胰腺恶性肿瘤,也不会检测到CA19-9的升高,不同基因型中,Le(+)Le(+)型CA19-9升高最为明显,Le(+)Le(-)型由于前体物质相对不足,血清中 CA19-9 的水平则相对较低。人群中约10%的PC患者Lewis抗原阴性,CA19-9不升高,但如若个体局部的恶性肿瘤出现了体细胞突变,相关的酶活性和功能出现了变化,肿瘤细胞中Le基因重新被激活,又可大量合成CA19-9,故单纯检测CA19-9并不能最大程度检出PC患者,此时需结合其他肿瘤标志物辅助检查,同时胰腺炎、胰腺良性病变、胆道梗阻或胆道系统感染等因素也会导致其升高[4],因而降低了CA19-9诊断PC的特异性。CA50是一种唾液酸酯和唾液酸糖蛋白,不受Le基因调控,可作为不表达CA19-9的PC患者的血清学补充,敏感性较高,但其在多种肿瘤中升高,器官的特异性较低[8]。目前发现并被报道的 PC 相关肿瘤标志物很多,单一肿瘤标志物在PC早期诊断中尚有一定局限性,因此多种肿瘤标志物的联合应用在PC早期诊断中具有较大价值。血细胞分析是简单易行的检测手段,在广大基层医院均能开展,有报道[13]显示,肿瘤细胞产生的PLT生成样激素及肿瘤相关的炎症介质可刺激PLT增高,过高的PLT能影响肿瘤的进展及患者的预后,肿瘤细胞和PLT相互作用形成PLT-肿瘤细胞复合体在肿瘤血道转移中起重要作用[14]。与此同时,已有多项研究表明,慢性炎症损伤在PC发生、发展、转移中均起着重要作用[15]。PLT作为肿瘤发生发展过程中的重要媒介、PLT和PLR作为炎症反应重要指标之一,在PC诊断中均有一定价值。
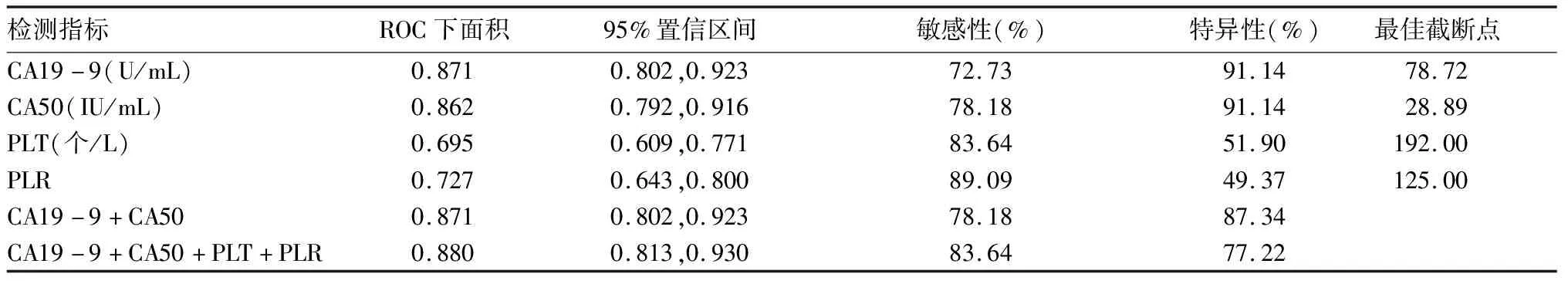
表4 以胰腺良性肿块为对照,各指标单独及联合应用诊断PC的效能
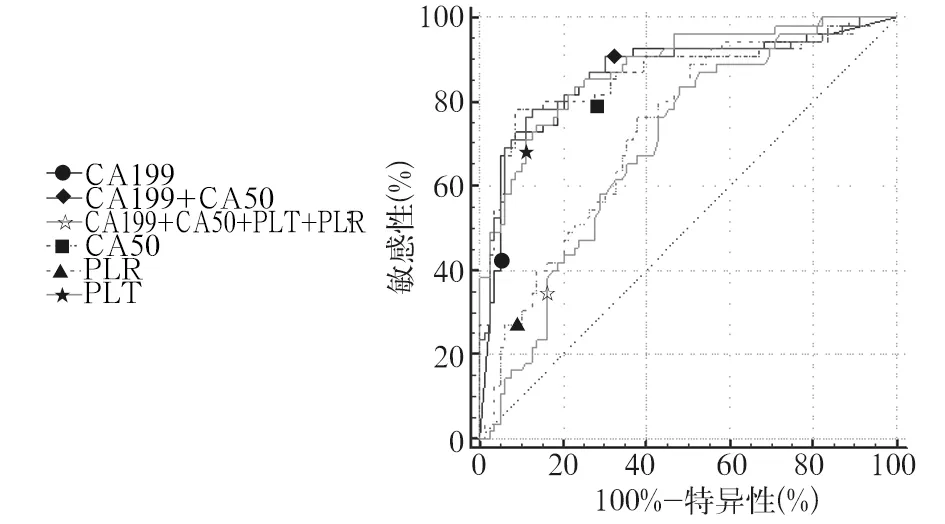
图2 以胰腺良性肿块为对照,四项指标独立及联合应用诊断PC的ROC
本研究结果显示PC组血清CA19-9、CA50水平及PLT、PLR均高于肿块组及对照组,肿块组CA50水平高于对照组。CA50作为肿瘤标志物不仅可在胰腺癌、结直肠癌、肺癌、乳腺癌等多种恶性肿瘤中升高,同时也受炎症影响,在慢性萎缩性胃炎、慢性胰腺炎、结肠炎甚至肺炎的部分患者也可检测到CA50的升高,这进一步验证了单种肿瘤标志物确诊某一种肿瘤是有所欠缺的,需联合多种指标检测进行肿瘤的诊断,同时由于炎症是导致肿瘤发生的重要因素,在临床上若检测出胰腺炎性肿块患者CA50升高,应建议患者密切随访,若CA50持续或短期内大幅度升高需警惕胰腺恶性肿瘤的发生,这与Lei等[16,17]的研究一致。此外我们还对比了不同分化程度PC患者的上述指标水平,结果显示血清CA19-9、CA50在低、中分化肿瘤中差异具有统计学意义,这可能与二者在分化较差的肿瘤细胞中合成更多有关[13],但血清CA19-9与CA50在高分化PC中、PLT与PLR在PC各种分化程度中的差异均无统计学意义。尽管已有多项研究表明,PLT在肿瘤微血管内聚集和脱颗粒,并释放血小板衍生生长因子、转化生长因子等,可刺激胰腺癌细胞生长、分化,同时分化程度越低的肿瘤细胞,理论上合成的肿瘤相关蛋白越高[18,19],但细胞分化、合成蛋白的过程均涉及基因调控,基因表达时间、空间差异性、差异调控下新合成的特异性蛋白质、不同细胞表面抗原,以及异常细胞周期、信号传导通路等多种复杂因素[20],单纯以肿瘤标志物及PLT为依据进行分化程度的推测可能效果欠佳,当然亦可能由于本研究样本量较小,统计结果存在误差。
本研究显示,在以对照组作为参照时,血清CA19-9、CA50作为独立指标均显示较高的敏感性及特异性,而PLT、PLR表现欠佳,未显示较高的诊断效能,当CA19-9联合CA50或CA19-9、CA50、PLT、PLR四项指标联合应用时则同样表现对PC诊断效能的提高,CA19-9、CA50、PLT、PLR、CA19-9联合CA50、四项指标联合应用的ROC线下面积分别为0.928、0.932、0.719、0.847、0.934、0.973。值得注意的是,CA19-9联合CA50和CA19-9、CA50单一指标检测对比ROC下面积接近,敏感性及特异性均较高,提示若不考虑联用PLT指标,在人群中进行PC筛查时,选择CA19-9联合CA50检测与选择CA19-9、CA50单一指标效果相近,但若不考虑公共卫生投入,选择四项指标同时检测会有最高的诊断效能。而在胰腺炎性肿块、胰腺假性囊肿等胰腺良性占位性病变作为对照时,四项指标联合应用较单一指标有更高的诊断效能,CA19-9、CA50、PLT、PLR、CA19-9联合CA50、四项指标联合应用的ROC线下面积分别为0.871、0.862、0.695、0.727、0.871、0.88。即血清CA19-9、CA50与PLT、PLR联合应用对PC有较高的诊断效能,提示若影像学已发现胰腺有占位性病变,四项指标联合检测能最大程度预测占位病变的良恶性,做到减少漏诊、误诊,尽可能在早期发现PC,提高治愈率。
综上所述,血清CA19-9、CA50作为诊断PC的肿瘤标志物,尽管单一指标诊断效能优于PLT、PLR,但联用以上四种指标均优于单一指标检测效能,因此建议,将血清CA19-9、CA50及PLT、PLR联合应用诊断PC。
