地塞米松对秀丽隐杆线虫的毒性效应及其机制
2020-03-19阮嘉莉黄其春
阮嘉莉,黄其春
广西医科大学附属肿瘤医院,南宁 530021
糖皮质激素是临床上应用范围最广的药物之一。地塞米松是糖皮质激素典型的代表,适应证广泛,用药剂量差异大,任何剂量均存在不良作用,且剂量的大小和生长抑制之间存在直接关系[1]。多数研究[2]报道了地塞米松单用或配合抗癌药物使用的合理性,但却忽略地塞米松易随病情的持续进展而加量长期使用,过量使用有可能会干预正常治疗进程。皮质激素的大量使用可能会直接参与体内氧化应激反应从而产生细胞毒性[3]。最新研究[4]表明,慢性激素治疗会通过改变人体相关基因,干扰体内正常的内分泌机制。临床治疗使用地塞米松来控制癌症患者恶心呕吐等不良作用的行为实际上可能会加重患者整体症状负担[5]。研究报道,地塞米松具有潜在的药物毒性,但是其毒性作用机制仍未明确。秀丽隐杆线虫(下文简称线虫)是第一个基因组序列基本上完整并且被全部测序的多细胞生物,其中有12/17种已知信号转导途径和人类是共同的,具有高度同源性[6]。线虫生命周期短、结构简单、身体透明、可大量繁殖,对药物浓度变化高度敏感,现已用于毒理学研究[7]。不同于其他模型生物,线虫还有独立的中央基因组数据库Worm Base[8],可以直接选择与应激反应相关的基因来评估溶液暴露的毒性。2017年12月~2018年10月,我们观察了不同浓度地塞米松对线虫生殖能力、运动能力及氧化胁迫相关基因如细胞色素P450家族蛋白基因(Cyp-35a2)、超氧化物歧化酶基因(Sod-1)、谷胱甘肽转移酶基因(Gst-1)、细胞凋亡相关基因如类P-53蛋白基因(Cep-1)表达的影响,进一步探讨地塞米松作用于生物体的毒性作用机制,为临床用药安全化、合理化提供理论依据。
1 材料与方法
1.1 实验动物、试剂及仪器 野生型线虫(N2)和线虫食物大肠杆菌OP50由中国科学院昆明动物研究所梁斌老师惠赠;地塞米松磷酸钠注射液购自天津金耀药业有限公司;吖啶橙染色剂购自北京索莱宝有限公司;PCR引物由上海生工生物工程公司合成,逆转录试剂盒与荧光定量PCR试剂盒均购自Takara公司。体视显微镜(广西梧州奥卡光学仪器有限公司),SPX-70B型生化培养箱(上海邦西仪器科技有限公司),电子分析天平(美国Thermo Forma公司),微量移液器(德国Eppendorf公司)。
1.2 线虫培养 线虫置于含有食物OP50的NGM培养皿上,在20 ℃培养箱中培养。利用铂丝针挑取年轻成虫进行转板传代。当皿上含有大量虫卵或者产卵高峰期的线虫时,利用裂解液(现配现用,5 mol/L NaOH:5%NaClO=1∶2)处理虫体。将余留的虫卵置于M9液体中培养16 h为孵化的L1期幼虫。将生长发育停滞在L1期的线虫置于涂有OP50的NGM皿上继续生长48 h,可得到L4同期化线虫用于实验。
1.3 地塞米松加入方法 结合本课题组的前期研究,在保证实验浓度不导致线虫死亡但可能会对正常生长发育造成影响的情况下,设立0、500、1 000、1 500、2 000 mg/L的5个浓度组(空白组、D1组、D2组、D3组、D4组),利用K-medium溶液(32 mmol/L Kcl, 51 mmol/L Nacl)稀释。采用液体暴露方法,将同步化后的L4期线虫加入不同组中,20 ℃无菌恒温培养箱培养48 h。暴露结束后进行实验。
1.4 线虫生殖能力、运动能力观察 生殖能力:随机挑选暴露48 h的L4期线虫置于含有OP50的NGM培养皿上,每个培养皿上只放置1条线虫,每24 h进行一次转板直至线虫不再产卵。记录每次转板时线虫的子代数目,每条线虫在产卵期得到子代数目的总和记为线虫总产卵数。运动能力:随机挑选暴露48 h的L4期线虫,通过测定头部摆动、身体弯曲、咽泵频率来评估行为能力。测定头部摆动需将线虫挑至中央滴有60 μL M9缓冲液的NGM皿上,线虫在缓冲液中自由适应1 min后,记录20 s内线虫头部从一侧摆向另外一侧再摆动回来的次数。测定身体弯曲则将线虫挑至无食物的NGM皿上自由恢复1 min后,记录20 s内线虫沿身体长轴方向爬行波长的次数。测定咽泵频率需将线虫置于含有OP50的NGM培养皿上,让其在菌落上自由运动饮食1 min后,观察20 s内线虫咽泵跳动的次数。
1.5 线虫细胞凋亡情况观察 采用吖啶橙AO活体染色法[9]。将暴露于地塞米松环境后的L4期线虫置于加有吖啶橙溶液(25 μg/mL)的孔板内,20 ℃避光培养2 h。结束后挑至无OP50的培养皿上恢复运动10 min,制备中央滴有左旋咪唑溶液(60 μg/mL)的2%琼脂糖垫子载玻片,随机挑取10~15条线虫于咪唑溶液中麻醉,加以盖玻片固定后,置于倒置荧光显微镜下拍照,激发波长为488 nm,显微镜下观察线虫身体各个部分细胞的凋亡情况。拍摄所得细胞凋亡荧光图像利用Image J软件处理,用相对荧光强度值表示细胞凋亡水平。
1.6 线虫氧化胁迫相关基因Cyp-35a2、Cep-1、Sod-1、Gst-1检测 采用实时荧光定量PCR法。使用TRIzol试剂标准化提取线虫的总RNA,并测定在260 nm和280 nm波长处的光密度(OD)值,确保所提取RNA的纯度在1.8~2.0。利用逆转录试剂盒合成cDNA,配制20 μL反应体系,进行实时荧光定量PCR检测。以肌动蛋白基因(Act-1)作为内参基因,Cyp-35a2、Cep-1、Sod-1、Gst-1引物参考C.elegans数据库(www.wormbase.org)检索的序列进行设计,实验步骤严格按照试剂盒说明书进行,以 2-ΔΔCt表示目的基因相对表达量。
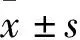
2 结果
2.1 各组线虫平均产卵量及运动能力变化 与空白组相比,D2组、D3组、D4组线虫产卵数下降(P均<0.01);D4组线虫头部摆动、身体弯曲能力、咽泵频率降低(P均<0.01)。见表1。
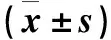
表1 各组线虫平均产卵量、头部摆动、身体弯曲、咽泵频率
2.2 各组线虫细胞凋亡水平比较 染色后的正常细胞境下为淡绿色,而凋亡细胞由于DNA断裂导致片段化增加,染色后呈现为亮绿色或者黄色[10]。空白组、D1组、D2组、D3组、D4组线虫细胞相对荧光强度值分别为116.0±39.4、119.9±44.7、142.5±31.7、187.5±18.4、195.1±25.8。与空白组相比,D3、D4组增强了61%、68%(P均<0.05)。其荧光部位主要集中在线虫咽部及身体前半部分。见图1。
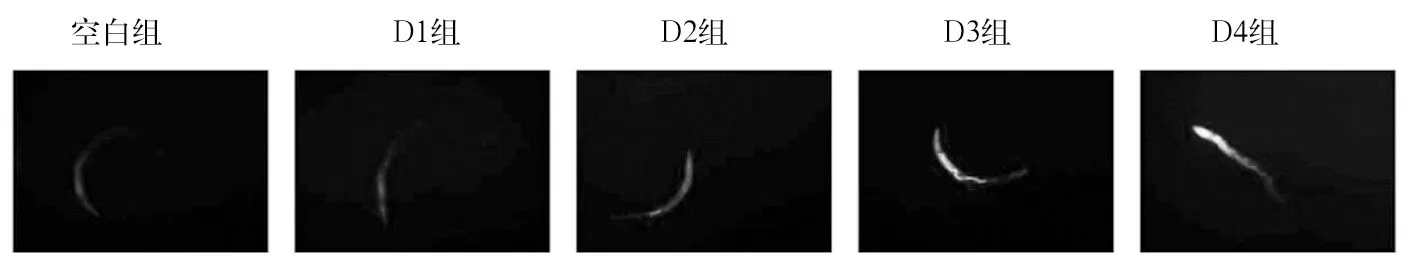
图1 各组线虫细胞凋亡荧光图像
2.3 各组线虫体内Sod-1、Cep-1、Cyp-35a2、Gst-1基因的相对表达量比较 与空白组比较,D1、D2、D3、D4组线虫体内Sod-1基因相对表达量均升高(P均<0.01);与空白组比较,D1、D2组线虫体内Cep-1基因相对表达量升高,D3、D4组降低(P均<0.05);与空白组比较,D1组Cyp-35a2基因相对表达量降低,D2、D3、D4组升高但无统计学意义;与空白组比较,D1、D2、D3、D4组Gst-1的相对表达量降低(P均<0.01),详见表2。
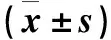
表2 各组线虫体内Sod-1、Cep-1、Cyp-35a2、Gst-1基因的相对表达量
3 讨论
人体长期、大剂量使用地塞米松时,会产生明显的不良反应,包括心血管疾病增加、月经絮乱、骨质疏松等[11]。生命早期地塞米松暴露会对健康造成长期不利的后果[12]。已有研究[13]发现,地塞米松可诱导发育毒性。地塞米松在体内参与胰岛素释放和生物合成等多种反应,其效应取决于浓度和治疗持续时间[14],而地塞米松的安全剂量在很多时候是未知的。线虫的生理功能(生殖率、运动行为)常被作为检测药物毒性的首选。它们分别反映外源环境对线虫繁殖能力引起的生殖毒性和潜在的神经毒性,比LC50半致死浓度更为敏感[15]。
研究[16,17]发现,地塞米松产前暴露会降低大鼠卵巢体积和影响正常生育功能,通过干扰分泌内分泌激素直接影响卵巢贮备功能,地塞米松暴露后线虫的生殖能力改变表明体内已经发生了内分泌的干扰。Heck等[18]研究了通过地塞米松诱导的抑郁样表型小鼠,发现小鼠体内细胞活性氧水平和NMDA R2A亚基水平的升高会导致小鼠神经细胞毒性,证实了地塞米松能诱导神经毒性改变。本研究结果显示,与空白组相比,D2组、D3组、D4组线虫产卵数下降;D4组线虫头部摆动、身体弯曲能力、咽泵频率降低,提示高剂量地塞米松对线虫的生殖毒性和神经毒性。细胞凋亡能够反映线虫体内细胞应对环境刺激的能力,地塞米松作为细胞凋亡诱导剂通过靶向不同的细胞内信号传导途径,诱导细胞凋亡和减少各种细胞的增殖[17,19]。本研究结果显示,暴露在1 500 mg/L及以上浓度地塞米松的线虫会出现凋亡现象,浓度越高细胞凋亡程度越明显,结合同组线虫生殖和运动能力的改变,推断细胞凋亡可能是造成线虫生殖及运动能力降低的一种潜在机制。
氧化胁迫相关基因表达量的改变代表了线虫有害物质暴露后的各种应激反应或防御机制。Sod-1是生物体抗氧化自由基破坏的主超氧化物歧化酶[20]。当线虫受到外源有害物质胁迫时,Sod-1基因通过上调来应对外源有害物质对器官造成的氧化损伤。Mutsaers等[21]研究表明,地塞米松暴露会通过改变多种线粒体编码的基因表达呼吸链酶和抗氧化剂酶,诱导细胞活性氧增加,抑制抗氧化酶的活性,导致机体抗氧化系统减弱,更容易发生氧化应激和细胞损伤[22]。Gst-1基因表达物是一类可保护机体免受氧化损伤而具有解毒效果的多功能蛋白,主要参与抑制氧化应激[23]。线虫极易受到外界氧化应激的影响,地塞米松可能通过氧化应激方式损伤线虫机体,同时干扰线虫解毒过程。外界氧化应激的影响超过线虫自身能耐受的阈值,自身防御机制减弱甚至无法抵抗,使线虫无法通过Gst结合产物来抑制各种氧化应激[24]。本研究结果显示,与空白组比较,D1、D2、D3、D4组线虫体内Sod-1基因相对表达量均升高;D1、D2、D3、D4组Gst-1的相对表达量均降低,Sod-1上调和Gst-1下调的同时存在,提示氧化应激是高浓度地塞米松导致线虫生殖毒性及神经毒性的主要方式。
Cep-1是编码哺乳动物P53肿瘤抑制蛋白的同源物的一种基因,与生物细胞凋亡情况密切相关[25]。本研究结果显示,与空白组比较,D1、D2组线虫体内Cep-1基因相对表达量升高,D3、D4组又降低,说明低浓度地塞米松中线虫体内Cep-1显著上调,通过促进细胞凋亡来响应氧化应激的压力,协助Sod-1启动机体防御机制维护机体稳态。随着地塞米松浓度的增加,Cep-1基因呈现出前后完全相反的改变,结合线虫细胞凋亡水平的改变(D3组和D4组),说明Cep-1基因表达变化与细胞凋亡程度改变的趋势一致。有研究[26]表明,高剂量糖皮质激素会诱导蛋白质降解,通过增加蛋白在体内的周转而影响乙酰胆碱酯酶活性。而Cyp-35a2基因的表达同时伴随着乙酰胆碱的活性抑制[27],间接影响线虫的运动和发育。本研究中地塞米松仅诱导线虫体内Cyp-35a2表达量的轻度上调,差异没有统计学意义,提示其改变可能不是影响线虫生理行为改变的主要因素。
综上所述,1 500 mg/L浓度及以上的地塞米松对秀丽隐杆线虫具有明显的生殖毒性和神经毒性,其作用机制可与引起氧化应激和促使细胞凋亡有关,为临床上地塞米松的合理应用提供了理论依据,更多有关病理剂量地塞米松介导的临床不良反应所涉及的机制仍需进一步探讨。
