不同产地佛手的挥发油成分比较分析
2020-03-13赵永艳张军银彭腾何沛煜匡宇
赵永艳 张军银 彭腾 何沛煜 匡宇

摘 要 目的:比较不同产地佛手挥发油成分的差异。方法:采用水蒸气蒸馏法提取10个不同产地佛手挥发油并计算得率;采用气质联用法分析不同产地佛手挥发油中化学成分;通过NIST 14.L数据库进行化合物检索并鉴别;采用峰面积归一化法测定各化学成分的相对质量分数;采用SPSS 20.0软件对样品进行聚类分析。结果:10个不同产地佛手挥发油得率为0.10%~1.75%,其中以四川乐山市犍为县样品最高(1.75%)。不同产地佛手挥发油共鉴别出66个成分,相对分子量为126.20~392.66,以C10和C15化合物居多;相对分子量为136、154的同分异构体所占比例较大,主要为环烃基单萜烯类成分。不同产地佛手挥发油有12个共有成分,按相对质量分数由大到小依次为柠檬烯(24.90%)、萜品烯(14.71%)、(-)-4萜品醇(2.88%)、柠檬醛(2.33%)和α-没药烯(2.33%)、香叶醇(1.52%)、α-蒎烯(1.37%)、反式佛手柑油烯(1.16%)、异松油烯(1.13%)、棕榈酸甲酯(1.12%)、芳樟醇(1.09%)、乙酸香叶酯(1.04%);其中8个为单萜烯类成分,2个为倍半萜烯类成分,2个为酯类成分。不同产地佛手可聚为4类,即S2、S4、S6聚为一类,S1、S3、S7、S8聚为一类,S5、S10聚为一类,S9为一类。结论:不同产地佛手的挥发油成分存在一定的差異,同一成分的含量在不同产地佛手挥发油中也存有差异。
关键词 佛手;挥发油;产地;气质联用法;成分
ABSTRACT OBJECTIVE: To compare the difference of the components of volatile oil in Citrus medica from different producing areas. METHODS: The volatile oil of C. medica from 10 different producing areas was extracted with steam distillation, and the yield was calculated. The components of the volatile oil of C. medica from different producing areas were analyzed by GC-MS. The compounds were retrieved from NIST 14.L mass spectrum database and identified. Relative mass fraction of chemical component was determined by peak area normalization method. Cluster analysis of samples were performed by using SPSS 20.0 software. RESULTS: The yields of volatile oil of C. medica from 10 different producing areas were 0.10%-1.75%, among which sample from Qianwei county in Leshan city of Sichuan province was the highest (1.75%). A total of 66 components were identified in the volatile oil of C. medica from different producing areas, with a relative molecular weight of 126.20-392.66. The majority was C10 and C15 compounds; isomers with relative molecular weight of 136, 154 took up the great proportion, which were mainly cycloalkane monoterpenes. There were 12 common components in the volatile oil of C. medica from different areas, which were limonene(24.90%), terpinene(14.71%), (-)-4 terpineol(2.88%), citral(2.33%), α-myrrhene(2.33%), geraniol(1.52%), α-pinene(1.37%), trans bergamot olene(1.16%), isoterpinene(1.13%), methyl palmitate(1.12%), linalool(1.09%) and geranyl acetate(1.04%) according to relative mass fraction; 8 of them were monoterpenes, 2 were sesquiterpenes and 2 were esters. There were 4 categories of C. medica from different producing areas, i.e. S2, S4, S6 clustered into one; S1, S3, S7, S8 clustered into one; S5 and S10 clustered into one; S9 as one. CONCLUSIONS: There are some difference of the components in volatile oil of C. medica from different producing areas, and the content of the same component also has great difference in the volatile oil of C. medica from different producing areas.
KEYWORDS Citrus medica; Volatile oil; Producing area; GC-MS; Component
佛手为芸香科植物佛手(Citrus medica L. var. sarcodactylis Swingle)的干燥果实,其味辛、苦、酸,性温,归肝、脾 、胃、肺经,具有疏肝理气、和胃止痛、燥湿化痰之功,可用于治疗肝胃气滞、胸胁胀痛、胃脘痞满、食少呕吐、咳嗽痰多等症[1],是一种药食同源的中药[2]。根据佛手产地的不同,可分为川佛手(四川产)、广佛手(广东产)、浙佛手(浙江产)、云佛手(云南产)和闽佛手(福建产)等[3]。近年来,佛手在全国各地进行了大面积的种植,但由于受气候、土壤等因素的影响,其质量也存在一定差异[4]。有研究发现,佛手挥发油中的有效成分柠檬烯具有抗炎[5-6]、抗焦虑[7]、抑制细胞增殖[8-9]等作用;α-蒎烯具有抗抑郁[10]、抗炎[11]等作用;β-蒎烯具有抗抑郁[12]、抗菌[13]等作用;α-松油烯具有抗氧化的作用[14];γ-松油烯具有抗菌、抗氧化的作用[15];芳樟醇可抗癫痫[16-17]、抗焦虑[18]、镇痛[19]等。目前,虽然有研究对不同产地佛手挥发油的含量和化学成分进行了比较研究[20-24],但这些研究检测的指标较少且缺乏对不同产地佛手挥发油共有成分的总结,具有一定的局限性。基于此,本研究采用水蒸气蒸馏法提取不同产地的佛手挥发油,并对其得率进行比较;同时,采用气质联用法(GC-MS)比较了不同产地佛手挥发油的成分差异,并通过面积归一化法计算其挥发油中共有成分的相对质量分数,旨在为其质量评价提供参考。
1 材料
1.1 仪器
7890A/5975C型GC-MS仪,包括5975C inert型惰性MS检测器、7890A型GC系统、NIST 14.L数据库(美国Agilent公司);FA2004N型十万分之一电子天平(成都市计量监督检定测试院);200T型多功能粉碎机(永康市铂欧五金制品有限公司);ZDHW型调温电热套(北京中兴伟业仪器有限公司);5 mL轻油型挥发油提取器(凌云实验室装备有限公司)。
1.2 药材与试剂
10批佛手样品(编号:S1~S10)均购自中药材天地网,经成都中医药大学药学院龙飞副教授鉴定为芸香科植物佛手(C. medica L. var. sarcodactylis Swingle)的干燥果实,其样品信息来源见表1。无水硫酸钠、二氯甲烷、正己烷、氯化钠均为分析纯,水为蒸馏水。
2 方法与结果
2.1 佛手挥发油的提取
按2015年版《中国药典》(四部)通则2204“甲法”[25]提取佛手挥发油。将佛手样品干燥后粉碎,过四号筛。称取粉末100 g,置于圆底烧瓶中,加入水1 000 mL,浸润30 min后用电热套加热,从第1滴冷凝水滴入油水分离器中开始计时,随后向冷凝管中滴入二氯甲烷1 mL辅助提取,蒸馏提取8 h至挥发油不再增加。提取结束冷却后将二氯甲烷层移出,水相加入氯化钠至饱和,用少量二氯甲烷萃取3次,合并二氯甲烷层,经适量无水硫酸钠脱水后,转移至于棕色玻璃瓶中,于40 ℃下水浴除去二氯甲烷,即得佛手挥发油。
2.2 佛手挥发油得率的测定
按公式计算佛手挥发油得率(W):W=m/M×100%[26]。式中,m为挥发油质量,M为药材样品质量。不同产地佛手挥发油得率见表2。由表2可知,四川乐山市犍为县样品(S2)的挥发油得率最高(1.75%),云南沐陽市样品(S10)的挥发油得率最低(0.10%);四川雅安市(S1)、重庆市石柱县(S4)、深圳市宝安区(S6)、广东韶关市(S7)和广西贺州市(S8)的佛手挥发油得率均不低于0.50%,提示不同产地佛手挥发油的含量存在较大差异。
2.3 GC-MS检测条件
2.3.1 GC条件 色谱柱:19091S-433-Agilent HP-5ms毛细管柱(30 m×250 μm,0.25 μm);进样温度:280 ℃;载气:氦气;分流流量:50 mL/min;程序升温:初始温度60 ℃保持3 min,以10 ℃/min升至280 ℃并保持5 min;进样口温度:325 ℃;分流进样,分流比:50 ∶ 1;进样量:1 μL。
2.3.2 MS条件 离子源:电子轰击离子源;离子源温度:230 ℃;四极杆温度:150 ℃;电子能量:70 eV;溶剂延迟时间:3 min;质量扫描范围:质荷比(m/z)35~550。
2.4 供试品溶液的制备
取“2.1”项下10个不同产地佛手挥发油各0.1 mL,加正己烷定容至1 mL,经0.22 μm微孔滤膜滤过,取续滤液,即得供试品溶液,用于GC-MS分析。
2.5 佛手挥发油成分分析
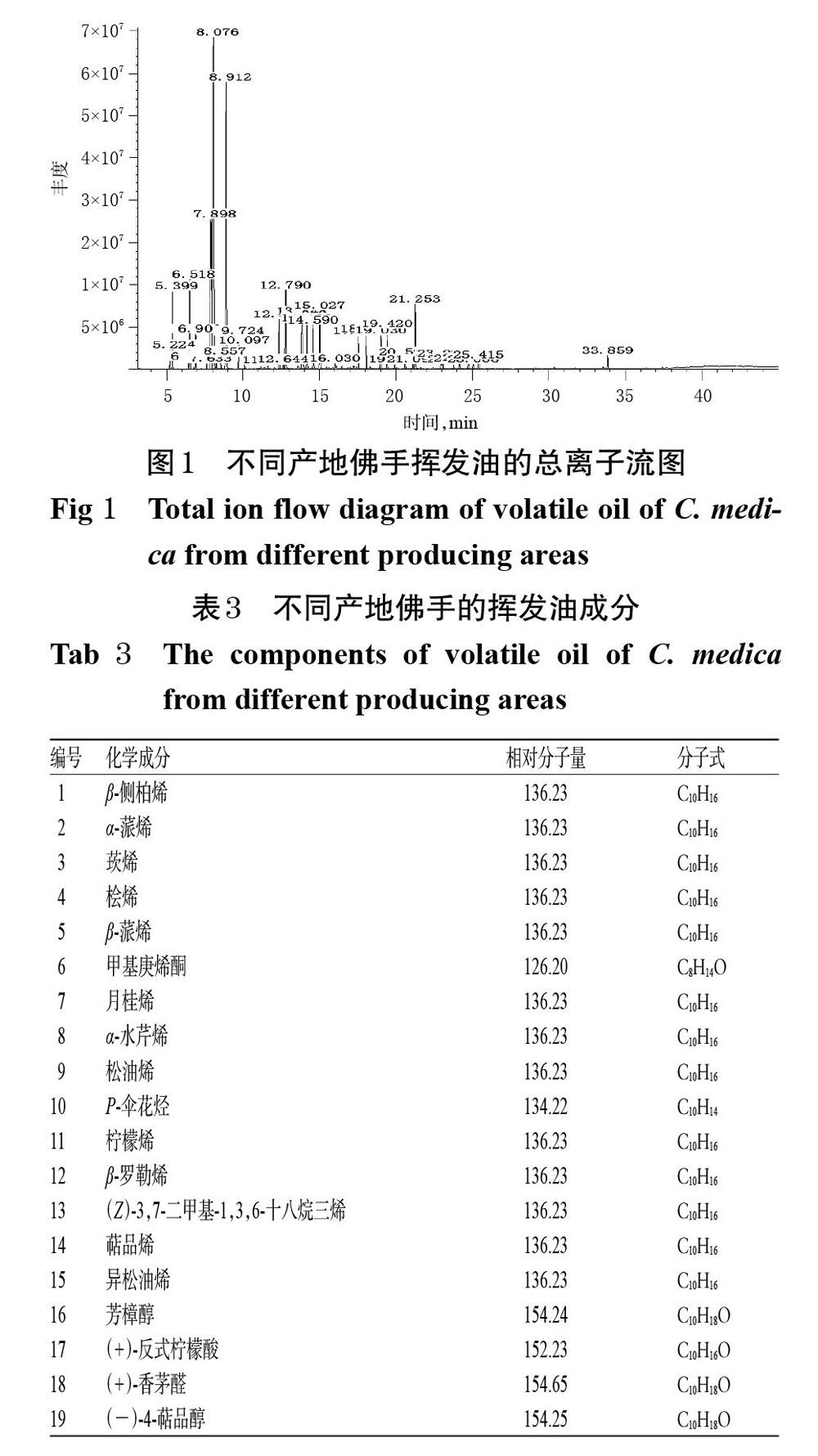
取“2.4”项下供试品溶液适量,按“2.3”项下检测条件进样测定,得总离子流图(图1)。根据GC-MS得到的质谱信息、相对保留时间,同时参考相关文献[26-27],经NIST 14.L数据库进行检索,并与数据库中的标准图谱进行对照。结果,不同产地佛手挥发油中,四川雅安市样品(S1)共分离出92个成分,鉴别出35个;四川乐山市犍为县样品(S2)共分离出59个成分,鉴别出35个;四川成都市金堂县样品(S3)共分离出69个成分,鉴别出29个;重庆市石柱县样品(S4)共分离出92个成分,鉴别出51个;浙江金华市样品(S5)共分离出81个成分,鉴别出35个;深圳市宝安区样品(S6)共分离出58个成分,鉴别出36个;广东韶关市样品(S7)共分离出109个成分,鉴别出39个;广西贺州市样品(S8)共分离出92个,鉴别出37个;广西桂林市样品(S9)共分离出92个成分,鉴别出42全;云南沐阳市样品(S10)共分离出73个,鉴别出34个。不同产地佛手挥发油中共鉴别出66个成分,其中单萜烯类成分24个、倍半萜烯类10个、二萜类2个、醇类2个、酮类2个、酯类11个、酚类3个、烷烃类2个、羧酸类1个、醚类2个、芳香烃1个、酚类3个、烷烃类3个。不同产地佛手的挥发油成分见表3。采用面积归一化法计算其相对质量分数,结果见表4。
由表3可知,10个产地佛手挥发油中鉴别出的66种化学成分的相对分子量为126.20~392.66,以C10和C15化合物居多,相对分子量为136、154的同分异构体所占比例较大,主要为环烃基单萜烯类成分。
由表4可知,不同产地佛手挥发油中有12个共有成分,其平均相对质量分数由大到小依次为柠檬烯(24.90%)、萜品烯(14.71%)、(-)-4-萜品醇(2.88%)、柠檬醛(2.33%)和α-没药烯(2.33%)、香叶醇(1.52%)、α-蒎烯(1.37%)、反式佛手柑油烯(1.16%)、异松油烯(1.13%)、棕榈酸甲酯(1.12%)、芳樟醇(1.09%)、乙酸香叶酯(1.04%);其中8个为单萜烯类成分,2个为倍半萜烯类成分,2个为酯类成分。
2.6 聚类分析
以12个共有成分的相对质量分数为原始数据,采用SPSS 20.0软件,以欧氏距离为测度对10个不同产地佛手进行聚类分析,结果见图2。由图2可知,10个不同产地的佛手可聚为4类:S2、S4、S6聚为一类,S1、S3、S7、S8聚为一类,S5、S10聚为一类,S9为一类。
3 讨论
本研究结果显示,10个不同产地佛手样品中四川乐山市犍为县样品挥发油得率最高(1.75%),其次为重庆市石柱县(1.00%)及深圳市宝安区(0.84%)样品;其化学成分相对质量分数均以柠檬烯和萜品烯较高,其中以深圳市宝安区样品挥发油中柠檬烯(33.28%)和萜品烯(22.23%)的相对质量分数最高。但此结果与部分已有研究不一致,如赵磊等[24]研究发现,佛手挥发油中的主要化学成分为柠檬烯、P-伞花烃、柠檬烯、松油烯;Leggio A等[27]研究表明,十六酸和亚油酸为佛手挥发油的主要成分,其中川佛手挥发油主要化学成分为柠檬酸和3-蒈烯;陈菲等[28]研究认为,D-柠檬烯、(+)-2-蒈烯为其主要成分;黄海波等[29]研究则认为,浙佛手挥发油的主要成分为柠檬烯和3-蒈烯,金佛手的主要成分为乙酸乙酯和油酸。笔者推测造成各研究间差异的原因可能与佛手采收时间、产地不同有关,但仍有待后续研究进一步探讨。
本研究中,同一成分在不同产地佛手挥发油中的相对质量分数存在较大差异,有21个成分的相对质量分数>1.00%,其中12个为单萜烯类成分、3个为倍半萜类成分、3个为酯类成分、1个为芳香烃类成分、1个为醇类成分、1个为烯烃类成分。不同产地佛手挥发油的主要成分虽然基本一致,但也存在一定的差异。比如,四川乐山市犍为县和重庆市石柱县佛手挥发油中可检测到甲基庚烯酮,其他产地样品则未检出;重庆市石柱县佛手挥发油中可检测到莰烯、(+)-反式柠檬酸、6-榄香烯,其他产地样品则未检出;重庆市石柱县和广西桂林市佛手挥发油中检测到柠檬烯乙二醇,其他产地样品则未检出;广西贺州市佛手挥发油中检测到茴香脑,其他产地样品则未检出。其原因可能与其遗传基因或生长的环境有关[4]。
佛手挥发油中的柠檬烯、γ-松油烯、α-蒎烯、佛手柑油烯是其香气成分[29-30],因此从佛手挥发油香气方面,可以柠檬烯、α-蒎烯、异松油烯和反式佛手柑油烯的相对质量分数作为评价其质量的指标。结果显示,以深圳市宝安区、重庆市石柱县、四川乐山市犍为县、四川雅安市佛手挥发油中上述4种成分的相对质量分数较高,但深圳市宝安区佛手挥发油中其他单萜烯类成分的相对质量分数也较高(因其他单萜烯类成分可降低佛手挥发油的香气),這在一定程度上会降低挥发油的质量,由此笔者推测四川、重庆地区佛手挥发油在香气方面的质量优于其他地区样品。有研究报道,佛手挥发油中的柠檬烯、α-蒎烯、β-蒎烯、松油烯、芳樟醇等成分是其发挥药理作用的主要成分[6,24],因此从佛手挥发油药理作用方面,可将上述5种成分作为评价其质量的指标。结果显示,以深圳市宝安区佛手挥发油中柠檬烯、α-蒎烯、β-蒎烯、松油烯、芳樟醇的相对质量分数较高,由此笔者推测深圳市宝安区佛手挥发油在药理作用方面的质量优于其他地区样品。
聚类分析结果显示,10个不同产地佛手可聚为4类:S2、S4、S6聚为一类,S1、S3、S7、S8聚为一类,S5、S10聚为一类,S9为一类。提示佛手的聚类结果与样品产地距离远近无关,但其原因有待进一步研究。
综上所述,不同产地佛手的挥发油成分存在一定的差异,同一成分的含量在不同产地佛手挥发油中也存在差异。
参考文献
[ 1 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2015 年版.北京:中国医药科技出版社,2015:178-179.
[ 2 ] 卫生部公布的既是食品又是药品的物品名单[J].山东食品科技,2002(2):33.
[ 3 ] 《中华本草》编委会.中华本草:精选本:上册[M].上海:上海科技出版社,1998:1020.
[ 4 ] 张桂芳,徐鸿华.佛手种质资源研究概况[J].广州中医药大学学报,2007,24(1):69-72.
[ 5 ] HIROTA R,ROGER NN,NAKAMURA H,et al. Anti-inflammatory effects of limonene from yuzu(Citrus junos Tanaka)essential oil on eosinophils[J]. J Food Sci,2010,75(3):H87-H92.
[ 6 ] DALESSIO PA,OSTAN R,BISSON JF,et al. Oral administration of D-limonene controls inflammation in rat colitis and displays anti-inflammatory properties as diet supplementation in humans[J]. Life Sci,2013,92(24):1151-1156.
[ 7 ] DE ALMEIDA AA,COSTA JP,DE CARVALHO RB,et al. Evaluation of acute toxicity of a natural compound(+)- limonene epoxide and its anxiolytic-like action[J]. Brain Res,2012. DOI:10.1016/j.brainres.2012.01.070.
[ 8 ] DA FONSECA CO,SIM?O M,LINS IR,et al. Efficacy of monoterpene perillyl alcohol upon survival rate of patients with recurrent glioblastoma[J]. J Cancer Res Clin Oncol,2011,137(2):287-293.
[ 9 ] CHAUDHARY SC,SIDDIQUI MS,ATHAR M,et al.D- limonene modulates inflammation,oxidative stress and Ras-ERK pathway to inhibit murine skin tumorigenesis[J].Hum Exp Toxicol,2012,31(8):798-811.
[10] CHEN W,LIU Y,LI M,et al. Anti-tumor effect of α-pinene on human hepatoma cell lines through inducing G2/M cell cycle arrest[J]. J Pharmacol Sci,2015,127(3):332-338.
[11] KIM DS,LEE HJ,JEON YD,et al. Alpha-pinene exhibits anti-inflammatory activity through the suppression of MAPKs and the NF-κB pathway in mouse peritoneal macrophages[J]. Am J Chin Med,2015,43(4):731-742.
[12] GUZM?N-GUTI?RREZ SL,G?MEZ-CANSINO R,GARC?A-ZEBAD?A JC,et al.Antidepressant activity of Litsea glaucescens essential oil:identification of β-pinene and linalool as active principles[J]. J Ethnopharmacol,2012,143(2):673-679.
[13] WANG W,LI N,LUO M,et al. Antibacterial activity and anticancer activity of Rosmarinus officinalis L. essential oil compared to that of its main components[J]. Molecules,2012,17(12):2704-2713.
[14] RUDB?CK J,BERGSTR?M MA,B?RJE A,et al. α-Terpinene,an antioxidant in tea tree oil,autoxidizes rapidly to skin allergens on air exposure[J]. Chem Res Toxicol,2012,25(3):713-721.
[15] ASBAGHIAN S,SHAFAGHAT A,ZAREA K,et al. Comparison of volatile constituents,and antioxidant and antibacterial activities of the essential oils of Thymus caucasicus,T. kotschyanus and T. vulgaris[J]. Nat Prod Commun,2011,6(1):137-140.
[16] PEANA AT,DAQUILA PS,PANIN F,et al. Anti-inflammatory activity of linalool and linalyl acetate constituents of essential oils[J]. Phytomedicine,2002,9(8):721-726.
[17] PEANA AT,DAQUILA PS,CHESSA ML,et al. (-)- linalool produces antinociception in two experimental models of pain[J]. Eur J Pharmacol,2003,460(1):37-41.
[18] DE SOUSA DP,N?BREGA FF,SANTOS CC,et al. Anticonvulsant activity of the linalool enantiomers and racemate:investigation of chiral influence[J]. Nat Prod Commun,2010,5(12):1847-1851.
[19] CHENG BH,SHEEN LY,CHANG ST.Evaluation of an- xiolytic potency of essential oil and S-(+)-linalool from Cinnamomum osmophloeum ct. linalool leaves in mice[J].J Tradit Complement Med,2015,5(1):27-34.
[20] 金曉玲,徐丽珊,施潇,等. 4种佛手挥发油化学成分的研究[J].中国药学杂志,2002,37(10):737-739.
[21] 高幼衡,黄海波,徐鸿华.广佛手挥发性成分的GC-MS分析[J].中草药,2002,33(10):21-22.
[22] 王俊华,符红.广佛手挥发油化学成分的GC-MS分析[J].中药材,1999,22(10):516-517.
[23] 刘盼,雷素娟,唐鹏,等.不同产地佛手GC指纹图谱及4种成分测定[J].中成药,2018,40(11):2491-2496.
[24] 赵磊,籍保平,周峰,等. 12种金华佛手挥发油成分的比较研究[J].食品科学,2006,27(6):179-184.
[25] 国家药典委员会.中华人民共和国药典:四部[S]. 2015 年版.北京:中国医药科技出版社,2015:203.
[26] 辛晓伟.石韦药材挥发油成分分析及抑菌活性研究[D].济南:山东中医药大学,2016.
[27] LEGGIO A,LEOTTA V,BELSITO EL,et al. Aromatherapy:composition of the gaseous phase at equilibrium with liquid bergamot essential oil[J]. Chem Cent J,2017. DOI:10.1186/s13065-017-0340-y.
[28] 陈菲,吴永江,马丽,等. GC-MS联用分析松针和佛手挥发油化学成分的差异[J].中国医药导报,2014,11(6):90-92.
[29] 黄海波,贺红,潘超美,等. 3种不同产地佛手挥发油含量测定和GC-MS分析[J].医药世界,2002,43(7):57-59.
[30] 杨君,郜海燕,储国海,等.基于GC-MS和GC-O联用法分析佛手精油关键香气成分[J].食品科学,2015,36(20):194-197.
(收稿日期:2019-08-08 修回日期:2020-01-03)
(编辑:陈 宏)
