健脾补肾方对再生障碍性贫血患者骨髓增生及相关细胞因子的影响
2020-03-13曹宇峰张琳琳吕丽丽王磊边月平
曹宇峰 张琳琳 吕丽丽 王磊 边月平
再生障碍性贫血(AA)是临床常见的造血障碍性疾病,患者由于全血细胞减少而出现贫血症状,常合并出血和感染,且易并发中毒性休克等并发症,对患者生命安全和生活质量造成严重影响[1-3]。目前,西医针对AA尚缺乏特效治疗方法,主要采用免疫抑制剂、细胞刺激因子疗法及其他对症处理措施,虽然能够有效改善患者临床症状,但长期用药易产生肝肾毒性,患者耐受性差[4-6]。研究发现,中医药治疗AA能够显著提高疾病缓解率,且不具有西药的毒副作用。本研究采用健脾补肾方治疗AA,旨在观察健脾补肾方对AA患者骨髓造血及相关细胞因子的影响。
1 资料与方法
1.1 一般资料 将2016年1月至2018年6月我院收治的90例再生障碍性贫血患者纳入研究范围,按照随机数字表法随机分为对照组和治疗组,每组45例。对照组中,男25例,女20例;年龄32~61岁,平均年龄(39.12±5.42)岁;病程1~12年,平均(5.12±0.73)年;中医症候分型:脾肾阴虚型10例,脾肾阳虚型19例,脾肾阴阳两虚型16例。治疗组中,男23例,女22例;年龄30~65岁,平均年龄(40.00±5.51)岁;病程1~14年,平均(5.78±0.82)年;中医证候分型:脾肾阴虚型12例,脾肾阳虚型18例,脾肾阴阳两虚型15例。2组年龄、性别比、病程、中医证候分型等一般资料比较差异无统计学意义(P>0.05)。见表1。

表1 2组一般资料比较 n=45
1.2 纳入及排除标准
1.2.1 纳入标准:①符合《血液病诊断及疗效标准》制定的再生障碍性贫血诊断标准,且经临床症状体征、血常规指标、骨髓涂片及病理学检查确诊为AA;②符合《中药新药临床研究指导原则》制定的中医辨证分型诊断标准;③入组前2周内未接受过激素、化疗药物治疗者;④患者均自愿参加本研究,且签署知情同意书。
1.2.2 排除标准:①合并PNH、白血病等其他血液系统疾病;②合并心、肝、肺、肾等重要脏器功能不全者;③妊娠或哺乳期女性;④对本研究药物过敏或有禁忌证者。
1.3 治疗方法 对照组给予环孢素A治疗,口服,4 mg·kg-1·d-1,2次/d;同时根据病情给予抗感染、补血及止血药物。治疗组给予健脾补肾方治疗,组成:黄芪 24 g,女贞子 15 g,太子参 24 g,白术芍 15 g,炒丹皮 15 g,制半夏 10g,小蓟草 15 g,菟丝子 24 g,炒枳壳 10 g,炙甘草 6 g。1个月为1个疗程,共治疗2个疗程。针对不同中医辨证分型,健脾补肾方中分别配伍不同中药,脾肾阴虚型可选择滋阴生精的药物,如生地黄、黄柏等;脾肾阳虚型可选择填精助阳的药物,如补骨脂、淫羊藿;脾肾阴阳两虚型可选择阴阳双补的药物,如杜仲、制首乌等。
1.4 观察指标
1.4.1 骨髓增生程度、非造血细胞百分率:分别于治疗前后采用骨髓图像分析仪评价骨髓增生程度及非造血细胞百分率。根据成熟红细胞与有核细胞百分率将骨髓增生程度分为活跃、减低、重度减低共3级。
1.4.2 骨髓组织骨髓组织微血管密度(MVD)、血管内皮生长因子(VEGF)表达:分别于治疗前后抽取患者髂后上棘部位骨髓活检标本,甲醛固定后石蜡包埋切片,采用免疫组化SP法判定MVD。低倍镜下找出每张切片中3个血管最丰富区域,高倍镜下计数MVD,共计数3次,取均值。VEGF主要定位于细胞浆(膜)中,以检出棕褐色颗粒为VEGF阳性表达。高倍镜下随机选取5个视野,分别计数100个细胞,计算阳性细胞百分率,取均值。
1.4.3 骨髓基质细胞碱性成纤维细胞生长因子(bFGF)、Rho家庭成员A(Rho-A)、Ras相关的C3肉毒杆菌毒素底物(Rac)表达:采用Real time-PCR法测定骨髓基质细胞bFGF、Rho-A、Rac mRNA表达。按照TRizol说明书进行骨髓基质细胞总RNA的提取和逆转录,SYBR Green染料法进行目的基因扩增,根据RQ=2-ΔΔCt计算目的基因相对表达量。引物序列由上海生工生物工程有限公司合成。见表2。

表2 Real time-PCR引物序列
1.4.4 骨髓液bFGF、Rho-A、Rac水平:分别于治疗前后抽取患者骨髓液3 ml,采用酶联免疫吸附实验(ELISA)测定bFGF、Rho-A、Rac水平。
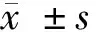
2 结果
2.1 2组骨髓增生程度比较 治疗前2组骨髓增生程度比较差异无统计学意义(P>0.05)。治疗后2组骨髓增生程度均明显好于治疗前,组间比较差异有统计学意义(P<0.05),且治疗组骨髓增生程度好于对照组(P<0.05)。见表3。
2.2 2组非造血细胞百分率比较 治疗前2组非造血细胞百分率比较差异无统计学意义(P>0.05)。治疗后2组非造血细胞百分率均明显低于治疗前,组间比较差异有统计学意义(P<0.05),且治疗组非造血细胞百分率低于对照组(P<0.05)。见表4。

表3 2组骨髓增生程度比较 n=45,例(%)
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05


组别非造血细胞对照组 治疗前62.79±8.43 治疗后50.62±7.21∗治疗组 治疗前63.48±9.05 治疗后36.22±5.14∗#
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05
2.3 2组骨髓组织MVD、VEGF表达比较 治疗前2组骨髓组织MVD、VEGF表达比较差异无统计学意义(P>0.05)。治疗后2组骨髓组织MVD、VEGF表达均明显高于治疗前,组间比较差异有统计学意义(P<0.05),且治疗组MVD、VEGF表达高于对照组(P<0.05)。见表5。


组别MVDVEGF(%)对照组 治疗前0.89±0.114.10±0.56 治疗后1.25±0.16∗5.99±0.63∗治疗组 治疗前0.92±0.134.12±0.52 治疗后1.47±0.20∗#7.46±0.87∗#
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05
2.4 2组骨髓基质细胞bFGF、Rho-A、Rac表达比较 治疗前2组骨髓基质细胞bFGF、Rho-A、Rac mRNA表达比较差异无统计学意义(P>0.05)。治疗后2组骨髓基质细胞bFGF、Rho-A、Rac mRNA表达均明显高于治疗前,组间比较差异有统计学意义(P<0.05),且治疗组bFGF、Rho-A、Rac mRNA表达高于对照组(P<0.05)。见表6,图1。


组别bFGF mRNARho-A mRNARac mRNA对照组 治疗前1.02±0.160.67±0.080.74±0.11 治疗后1.48±0.21∗1.12±0.16∗1.23±0.17∗治疗组 治疗前1.05±0.180.69±0.100.72±0.10 治疗后1.79±0.26∗#1.57±0.23∗#1.64±0.26∗#
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05

图1 Real time-PCR测定bFGF、Rho-A、Rac mRNA表达
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05
2.5 2组骨髓液bFGF、Rho-A、Rac水平比较 治疗前2组骨髓液bFGF、Rho-A、Rac水平比较差异无统计学意义(P>0.05)。治疗后2组骨髓液bFGF、Rho-A、Rac水平均明显高于治疗前,组间比较差异有统计学意义(P<0.05),且治疗组bFGF、Rho-A、Rac水平高于对照组(P<0.05)。见表7。


组别bFGF(ng/L) Rho-A(μg/L)Rac(μg/L)对照组 治疗前28.62±4.052.33±0.351.38±0.21 治疗后49.77±6.82∗3.06±0.41∗1.99±0.25∗治疗组 治疗前30.21±4.132.30±0.321.42±0.18 治疗后68.98±8.34∗#4.15±0.54∗#3.22±0.47∗#
注:与治疗前比较,*P<0.05;与对照组比较,#P<0.05
3 讨论
AA是一种由于骨髓造血功能进行性衰竭而导致全血细胞减少和造血干细胞缺陷的临床综合征,该病病因尚不明确,且病程长,治疗难度大,患者预后差。目前,AA的确切发病机制尚不清楚。研究显示,造血细胞的增殖和分化有赖于造血微环境为其提供支持,其中多种细胞因子是造血过程中重要的免疫调节因子[7]。而AA患者存在造血微环境紊乱和细胞因子调节异常,这是AA发生发展的重要病理机制,并与骨髓造血衰竭严重程度呈正相关[7-9]。微血管通过为造血细胞的生长提供血供、氧供及其他营养物质在生理性造血过程中发挥关键作用。造血微环境的破坏引起骨髓血管生成减少、血管通透性降低及营养物质供应减少,从而造成骨髓造血组织萎缩,同时脂肪化增加,最终导致造血功能衰竭[10]。VEGF是已知作用最强的促血管生成因子,具有维持造血干细胞增殖、分化、更新及血管新生的作用,AA患者造血微环境中VEGF表达降低可能通过引起血管内皮细胞凋亡等多种途径影响血管生成及造血干细胞生存[11]。bFGF是一类具有多种生理作用的细胞生长因子,其与表达在血管内皮细胞、成骨细胞表面的bFGFR结合后启动信号级联反应,能够促进骨髓间充质干细胞增殖、分化、血管新生并增加血管通透性[12]。研究表明,Rho-GTP家族通过参与细胞骨架形成和黏附、调节干细胞发育等作用在维持骨髓微环境稳态中发挥重要作用,其中Rho-A、Rac是Rho-GTP家族的重要成员,Rho-A、Rac基因缺失直接导致细胞骨架形成减少,造血微环境紊乱及造血功能下降[13,14]。因此,MVD、VEGF、bFGF、Rho-A、Rac是反映骨髓造血微环境稳态的重要指标,对于判断AA病情发展及预后至关重要。
近年来,以环孢素A为代表的免疫抑制剂已经成为治疗AA的一线治疗药物,对骨髓造血具有显著改善作用,但药物产生的肝肾毒性对患者耐受性和预后均造成严重影响[15]。中医将AA归于“虚劳”、“血枯”范畴,认为AA久治不愈的原因在于脾肾亏虚引起气血不足、血枯髓空,从而导致AA发病。因此,AA治疗应以填髓生血,化生气血为治疗原则[16]。健脾补肾方主要根据AA脾肾亏虚的病机,方中诸药合用能够起到补肾填精、养血生髓的功效。现代药理学研究发现,方中菟丝子、女贞子等多种成分具有改善骨髓微循环、调节免疫功能、增加骨髓网织红细胞及血小板数量等作用,从而促进骨髓造血功能恢复。本研究前期应用健脾补肾方治疗AA患者,疗效优于单纯西药治疗,但健脾补肾方发挥治疗作用的可能机制尚未见报道。
本研究通过观察骨髓增生程度、骨髓组织MVD、VEGF表达及相关细胞因子等指标变化,探讨健脾补肾方治疗AA的可能机制。结果表明,治疗后两组骨髓增生程度均明显好于治疗前,非造血细胞百分率均明显低于治疗前,组间比较差异有统计学意义(P<0.05),且治疗组以上指标改善程度优于对照组(P<0.05),说明健脾补肾方较单纯西药治疗能够有效促进骨髓增生恢复正常。同时,治疗后2组骨髓组织MVD、VEGF表达均明显高于治疗前,组间比较差异有统计学意义(P<0.05),且治疗组以上指标改善程度优于对照组(P<0.05),提示骨髓血管生成减少及VEGF表达降低与AA发生发展密切相关,应用健脾补肾方治疗AA能够明显促进骨髓血管新生,从而增强骨髓造血功能。此外,治疗组治疗后骨髓基质细胞bFGF、Rho-A、Rac表达及骨髓液bFGF、Rho-A、Rac水平均明显高于对照组(P<0.05),说明健脾补肾方通过调节骨髓基质细胞bFGF、Rho-A、Rac表达促进骨髓造血功能的恢复。
综上所述,健脾补肾方治疗再生障碍性贫血疗效显著,能够有效促进骨髓增生,改善造血微环境,从而增强骨髓造血功能,其机制与上调骨髓基质细胞bFGF、Rho-A、Rac表达有关。
