氨磷汀对急性放射性肠炎小鼠VEGF、bFGF和PI3K/PKB通路mRNA表达的影响*
2020-03-11张跃伟孙锁柱张丹谢静张蓉李长政
张跃伟,孙锁柱,张丹,谢静,张蓉,李长政
(1.锦州医科大学火箭军总医院 研究生培养基地,辽宁 锦州121001;中国人民解放军火箭军特色医学中心 2.病理科,3.消化科,4.中医科,北京 100088)
近年来,随着结直肠和妇科肿瘤放疗患者的增多,放射性肠炎的发病率也呈逐年上升趋势。放射性肠炎发病机制复杂,涉及细胞凋亡、微血管损伤、炎症介质表达上调、免疫屏障破坏及肠道菌群失调等多个方面,其中微血管损伤是重要机制之一[1-2]。内镜下放射性肠炎常呈黏膜下血管网减少与周围血管集簇相间分布等特征性表现,可能与辐射后微血管损伤、数目减少、密度下降,黏膜下纤维化,残留或新生血管异常生长等因素有关。但典型改变发生时间较晚,目前对急性期微血管损伤机制的研究相对较 少[3-4]。本实验通过观察辐射后第1、7及14天不同时间点辐射组和干预组小鼠小肠组织中血管内皮生长因子(vascular endothelial growth factor,VEGF)、碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)和磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB)通路mRNA表达变化,探讨放射性肠炎早期微血管相关基因在微血管损伤发生、发展中的生物学意义及氨磷汀对微血管的保护作用。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组 清洁级健康C57BL/10J小鼠84只,3个月龄,雌雄各42只,雌鼠体重(20±2)g,雄鼠体重(28±2)g,由南京大学生物医药研究院培育[实验动物生产许可证号:SCXK(苏)2018-0008]。将小鼠随机分成对照组(12只)、辐射组(36只)、干预组(36只)。对照组未辐射,辐射组和干预组分别于辐射后第1、7和14天处死12只小鼠。
1.1.2 实验试剂 固定组织RNA 提取试剂盒和UltraSYBR Mixture 试剂盒(北京康为世纪生物科技有限公司),RevertAid First Strand cDNA Synthesis Kit 试剂盒(美国赛默飞世尔公司提供)。
1.2 方法
1.2.1 辐射60Co-γ 辐照装置由北京师范大学化学学院提供,北京伽玛高新有限公司生产(型号:GM-11-03-A),对辐射组小鼠进行一次性6 Gy 辐射,小鼠笼距辐射源≤30 cm,剂量率1.00 Gy/min,总时长6 min。干预组小鼠辐射前30 min 腹腔注射氨磷汀,按人体给药剂量换算成小鼠给药量为200 mg/kg。
1.2.2 标本制作分别于辐射后第1、7及14天采用颈椎脱臼法处死小鼠,取出小肠,用磷酸盐缓冲液冲洗至无粪便残留,剪切分段,分别置于10%甲醛中固定,-80℃冰箱保存备用。
1.2.3 病理切片 常规脱水、透明、石蜡包埋、组织切片及HE 染色。
1.2.4 qRT-PCR 参照固定组织RNA 提取试剂盒说明书提取总RNA。参照RevertAid First Strand cDNA Synthesis Kit 试剂盒说明书进行逆转录。采用两步法进行qRT-PCR,GAPDH 为内参,引物由北京天一辉远科技有限公司提供。见表1。
1.3 统计学方法
数据分析采用SPSS 23.0统计软件。计量资料以均数±标准差(±s)表示,比较用单因素方差分析或重复测量设计的方差分析,进一步两两比较用LSD-t检验,P<0.05 为差异有统计学意义。

表1 引物列表
2 结果
2.1 病理改变
光学显微镜下观察,对照组小鼠小肠黏膜下微血管分布规律、结构完整(见图1A)。辐射组与干预组第1天均可见微血管充血、扩张及红细胞溢出等改变,且两组无差异(见图1B);辐射组第7天黏膜下层微血管数量减少,血管壁变薄、破坏,干预组剩余血管数量多于辐射组,且结构相对完整(见图1C、D);辐射组第14天黏膜下层微血管进一步减少,阶段性消失,结构完整的微血管罕见,黏膜、黏膜下结构紊乱及细胞数目减少,干预组无微血管阶段性消失现象,仍可见结构完整的微血管(见图1E、F)。

图1 各组小鼠小肠黏膜病理切片(HE 染色×200)
2.2 qRT-PCR 扩增曲线和熔解曲线
各组VEGF、bFGF、PI3K及PKB基因不同CT值的扩增曲线平行性良好,其倾斜程度基本一致,说明目的基因与内参基因扩增效率一致。上述各目的基因和内参基因熔解曲线均在对应熔解温度上形成单峰,说明产物特异性良好。在对照组和各不同时间点辐射组、干预组中分别选取一条代表性扩增曲线和熔解曲线(见图2 ~9)。
2.3 对照组与辐射组VEGF、bFGF、PI3K及PKB mRNA相对表达量比较
对照组与辐射组第1、7及14天小鼠小肠组织中VEGF、bFGF、PI3K及PKB mRNA相对表达量比较,经方差分析,差异有统计学意义(P<0.05)。与对照组相比,辐射组第1和7天VEGF、bFGF、PI3K及PKB mRNA相对表达量升高(P<0.05),且辐射组 第14天VEGF、bFGF mRNA相对表达量仍升高(P<0.05)。对照组与辐射组第14天PI3K、PKB mRNA相对表达量比较,差异无统计学意义(P>0.05)。见表2和图10。
2.4 对照组与干预组VEGF、bFGF、PI3K及PKB mRNA相对表达量比较
图2 辐射组VEGF基因qRT-PCR 扩增曲线和熔解曲线
图3 辐射组bFGF基因qRT-PCR 扩增曲线和熔解曲线
图4 辐射组PI3K基因qRT-PCR 扩增曲线和熔解曲线
对照组和干预组第1、7及14天小鼠小肠组织中VEGF、bFGF、PI3K及PKB mRNA相对表达量比较,经方差分析,差异有统计学意义(P<0.05)。与对照组相比,干预组第1天VEGF、bFGF、PI3K及PKB mRNA相对表达量均升高(P<0.05);对照组与干预组第7和14天VEGF、bFGF、PI3K及PKB mRNA相对表达量比较,差异无统计学意义(P>0.05)。见表3和图11。
2.5 辐射组和干预组各时VEGF、bFGF、PI3K、PKB mRNA相对表达量比较
图5 辐射组PKB基因qRT-PCR 扩增曲线和熔解曲线
图6 干预组VEGF基因qRT-PCR 扩增曲线和熔解曲线
图7 干预组bFGF基因qRT-PCR 扩增曲线和熔解曲线
辐射组与干预组第1、7及14天VEGF mRNA相对表达量比较,采用重复测量设计的方差分析,结果:①不同时间点的VEGF mRNA相对表达量有差别(F=75.66,P=0.000);②两组的VEGF mRNA相对表达量有差别(F=66.689,P=0.000),干预组较辐射组低;③两组VEGF mRNA相对表达量变化趋势有差别(F=16.975,P=0.000)。见表4。
辐射组与干预组第1、7及14天bFGF mRNA相对表达量比较,采用重复测量设计的方差分析,结果:①不同时间点的bFGF mRNA相对表达量有差别(F=75.289,P=0.000);②两组的bFGF mRNA相对表达量有差别(F=109.134,P=0.000),干预组较辐射组低;③两组的bFGF mRNA相对表达量变化趋势有差别(F=13.322,P=0.000)。见表5。
图8 干预组PI3K基因qRT-PCR 扩增曲线和熔解曲线
图9 干预组PKB基因qRT-PCR 扩增曲线和熔解曲线
表2 对照组与辐射组VEGF、bFGF、PI3K及PKB mRNA相对表达量比较(n =12,±s)
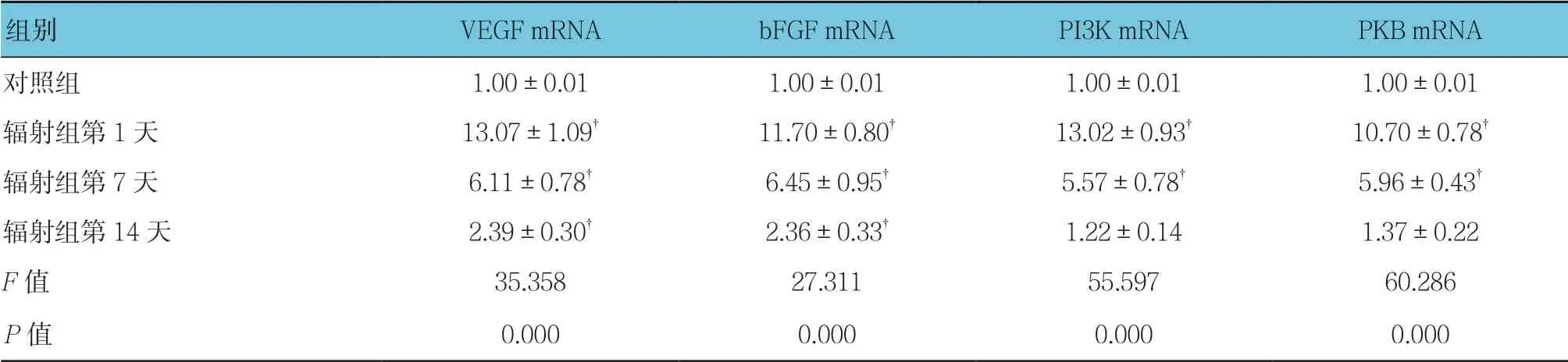
表2 对照组与辐射组VEGF、bFGF、PI3K及PKB mRNA相对表达量比较(n =12,±s)
注:†与对照组比较,P <0.05。
组别 VEGF mRNA bFGF mRNA PI3K mRNA PKB mRNA对照组 1.00±0.01 1.00±0.01 1.00±0.01 1.00±0.01辐射组第1天 13.07±1.09† 11.70±0.80† 13.02±0.93† 10.70±0.78†辐射组第7天 6.11±0.78† 6.45±0.95† 5.57±0.78† 5.96±0.43†辐射组第14天 2.39±0.30† 2.36±0.33† 1.22±0.14 1.37±0.22 F 值 35.358 27.311 55.597 60.286 P 值 0.000 0.000 0.000 0.000
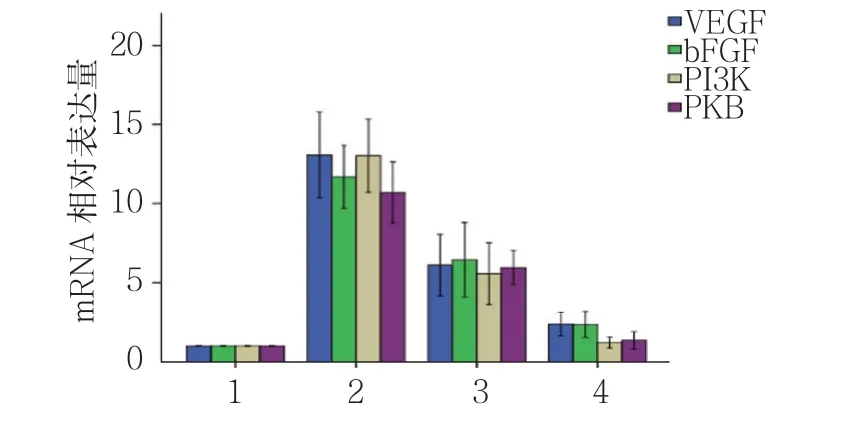
图10 对照组与辐射组VEGF、bFGF、PI3K及PKB mRNA相对表达量比较(n =12,±s)
辐射组与干预组第1、7及14天的PI3K mRNA相对表达量比较,采用重复测量设计的方差分析,结果:①不同时间点的PI3K mRNA相对表达量有差别(F=79.914,P=0.000);②两组的PI3K mRNA相对表达量有差别(F=57.871,P=0.000),干预组较辐射组低;③两组的PI3K mRNA相对表达量变化趋势有差别(F=9.597,P=0.001)。见表6。
辐射组与干预组第1、7及14天的PKB mRNA相对表达量比较,采用重复测量设计的方差分析,结果:①不同时间点的PKB mRNA相对表达量有差别(F=84.241,P=0.000);②辐射组与干预组的PKB mRNA相对表达量有差别(F=103.748,P=0.000),干预组较辐射组低;③两组的PKB mRNA相对表达量变化趋势有差别(F=33.951,P=0.001)。见表7。
表3 对照组与干预组VEGF、bFGF、PI3K及PKB mRNA相对表达量比较(n =12,±s)
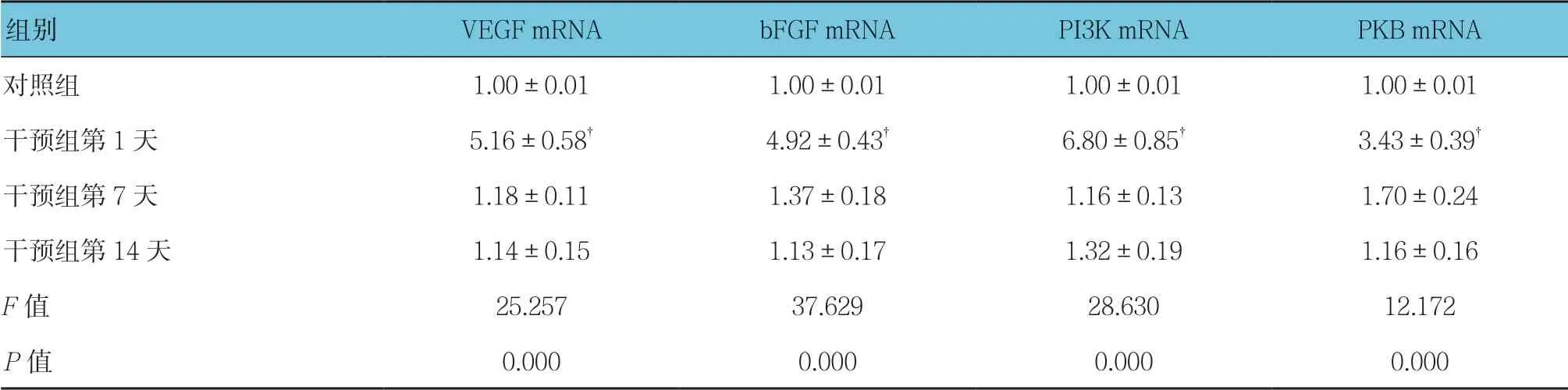
表3 对照组与干预组VEGF、bFGF、PI3K及PKB mRNA相对表达量比较(n =12,±s)
注:†与对照组比较,P <0.05。
组别 VEGF mRNA bFGF mRNA PI3K mRNA PKB mRNA对照组 1.00±0.01 1.00±0.01 1.00±0.01 1.00±0.01干预组第1天 5.16±0.58† 4.92±0.43† 6.80±0.85† 3.43±0.39† 干预组第7天 1.18±0.11 1.37±0.18 1.16±0.13 1.70±0.24干预组第14天 1.14±0.15 1.13±0.17 1.32±0.19 1.16±0.16 F 值 25.257 37.629 28.630 12.172 P 值 0.000 0.000 0.000 0.000
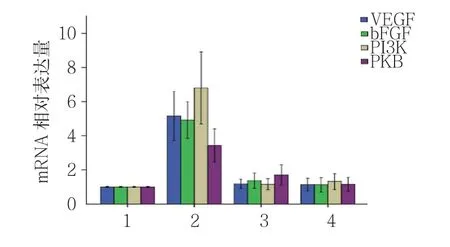
图11 对照组与干预组VEGF、bFGF、PI3K及PKB mRNA相对表达量比较(n =12,±s)
表4 辐射组和干预组各时间点VEGF mRNA相对表达量 比较(n =12,±s)
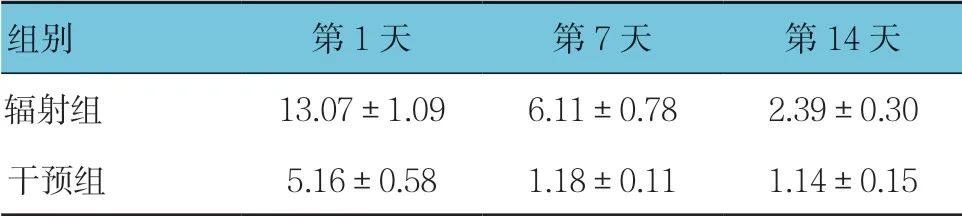
表4 辐射组和干预组各时间点VEGF mRNA相对表达量 比较(n =12,±s)
组别 第1天 第7天 第14天辐射组 13.07±1.09 6.11±0.78 2.39±0.30干预组 5.16±0.58 1.18±0.11 1.14±0.15
表5 辐射组和干预组各时间点bFGF mRNA相对表达量 比较(n =12,±s)
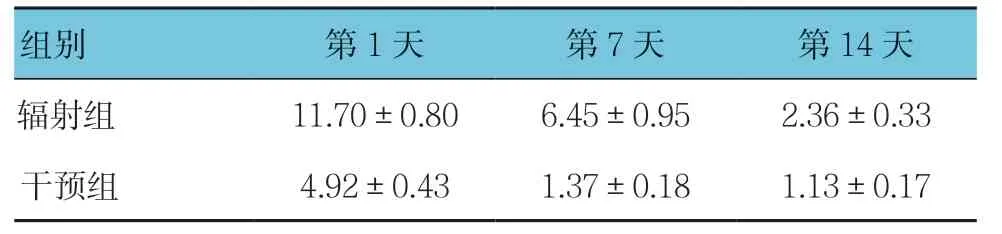
表5 辐射组和干预组各时间点bFGF mRNA相对表达量 比较(n =12,±s)
组别 第1天 第7天 第14天辐射组 11.70±0.80 6.45±0.95 2.36±0.33干预组 4.92±0.43 1.37±0.18 1.13±0.17
表6 辐射组和干预组各时间点PI3K mRNA相对表达量 比较(n =12,±s)
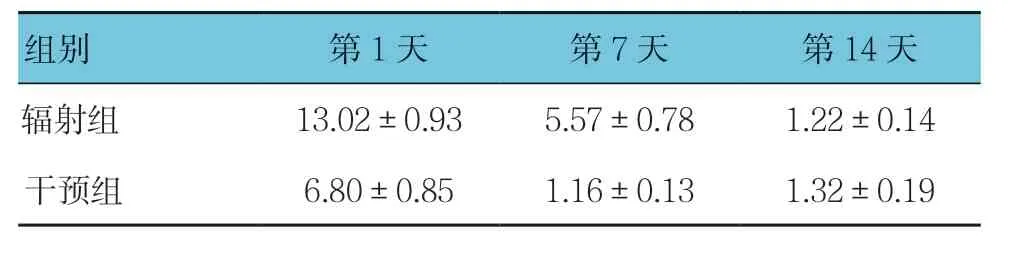
表6 辐射组和干预组各时间点PI3K mRNA相对表达量 比较(n =12,±s)
组别 第1天 第7天 第14天辐射组 13.02±0.93 5.57±0.78 1.22±0.14干预组 6.80±0.85 1.16±0.13 1.32±0.19
表7 辐射组和干预组各时间点PKB mRNA相对表达量 比较(n =12,±s)
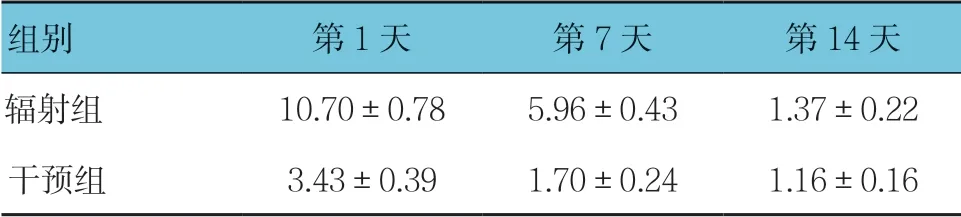
表7 辐射组和干预组各时间点PKB mRNA相对表达量 比较(n =12,±s)
组别 第1天 第7天 第14天辐射组 10.70±0.78 5.96±0.43 1.37±0.22干预组 3.43±0.39 1.70±0.24 1.16±0.16
3 讨论
VEGF是最有效的血管生成生长因子之一,具有增加血管通透性,促进细胞外基质变性、血管内皮细胞迁移、增殖及血管形成等作用[5]。有研究表明,血管在发育过程中,尖端细胞可感知VEGF的梯度,导致丝状伪足形成,并向VEGF 梯度迁移[6]。血管生成对于伤口愈合、组织再生及炎症性疾病至关重要,也在辐射损伤和修复中发挥重要作用。
bFGF 也称为FGF-2,对成纤维细胞、血管内皮细胞等具有很强的促进细胞分裂的增殖活性。其在促进创伤愈合和组织修复、纤维化和瘢痕形成中发挥重要生物学作用[7];此外,bFGF在促进血管生成方面功能强大,通过与多种血管内皮细胞表面的受体相互作用,引起毛细血管基底膜降解,毛细血管内皮细胞迁移、增殖及胶原合成等,促进血管生成的作用[8-9]。早期GRAZIANO[10]和SAADEH[11]等的研究表明,bFGF可以上调内皮细胞中VEGF的表达,VEGF的表达可随bFGF的增加而升高。这些证据表明,bFGF 可能激活VEGF 系统,并与VEGF 发挥协同效应,在血管生成的过程中共同发挥作用。
PI3K/PKB通路在多种细胞生长过程中发挥关键作用,如葡萄糖代谢、凋亡、细胞增殖、转录及细胞迁移[12]。PI3K 具有第2 信使作用,多种生长因子和信号传导复合物,包括bFGF、VEGF都能启动PI3K的激活过程,最终磷酸化丝氨酸/苏氨酸蛋白激酶蛋白的Ser308 导致PKB 活化[13-14]。活化的PKB 可以通过激活核转录因子κB 等途径,上调肿瘤坏死因子-α、白细胞介素-1β及白细胞介素-6等炎症因子的表达,参与辐射早期炎症反应,并可以通过胱天蛋白酶、内皮型一氧化氮合酶等途径调节细胞的增殖、分化、凋亡及血管生成等过程[15-16]。
本实验结果表明,放射性肠炎早期微血管损伤主要表现为通透性增加随后破坏数量减少,以辐射后第7和14天病理改变最显著。辐射后第1 ~7天小鼠小肠组织中VEGF、bFGF和PI3K/PKB通路mRNA相对表达量同步升高。此阶段VEGF、bFGF 可能存在协同效应,以增加微血管通透性和参与炎症反应作用为主,同时激活PI3K/PKB通路,通过上调炎症因子表达、诱导细胞凋亡等方式参与辐射后微血管破坏和组织损伤。辐射后第14天VEGF、bFGF mRNA相对表达量仍高于对照组,而PI3K/PKB通路mRNA相对表达量已经降至对照组水平,且黏膜下急性炎症反应趋于消退。由于VEGF、bFGF 参与新生血管生长及瘢痕生成过程,推测VEGF、bFGF 持续表达很可能与后期慢性放射性肠炎的新生血管生成、瘢痕形成等过程 有关。
氨磷汀为广谱放疗细胞保护剂,可通过清除自由基等机制对正常细胞起到保护作用。另有研究表明,氨磷汀通过不依赖于其自由基清除特性的机制保护血管免受放射线的影响[17-19]。其机制可能为促进内皮细胞生长,促进新生血管增殖,增加微血管数量 等[17-19]。干预组 mRNA在辐射后第1天表达低于辐射组,第7天时达到对照组水平,下降速度快于辐射组。第14天与对照组比较无差异,而辐射组VEGF、bFGF mRNA 第14天呈高表达。组织学观察干预组微血管密度大于辐射组且结构相对完整。这表明氨磷汀可能通过下调辐射早期VEGF、bFGF mRNA 进而下调PI3K/PKB通路的表达,从而减轻放射性肠炎的微血管损伤。
本实验观察到,VEGF、bFGF和PI3K/PKB通路mRNA相对表达量高峰为辐射后第1天,组织学损伤的高峰为第7 ~14天,组织学损伤与mRNA在时间上存在滞后性,符合从分子学改变到组织学改变的规律。同时VEGF、bFGF在微血管消失和黏膜下层组织破坏严重的辐射组中持续表达,很可能在分子层面上启动促进新生血管生成及瘢痕修复的机制,在后续异常新生血管形成、黏膜下纤维化、瘢痕形成中发挥作用,而损伤相对较轻的干预组并不存在VEGF、bFGF的持续表达。这一过程与肝硬化发生过程中肝窦破坏、纤维化、异常血管床和假小叶形成有一定相似之处,其中的VEGF、bFGF及TNF-α 等变化也非常相似。VEGF、bFGF 高表达者可能更容易出现白色瘢痕和异常增生的毛细血管簇相间现象。这与临床严重的放射性肠炎内镜呈黏膜下血管网减少、白色瘢痕形成与周围血管集簇相间分布,而较轻者该表现不典型相符。
综上所述,放射性肠炎的微血管损伤过程是早期破坏后数量减少,同时可能启动慢性放射性肠炎的病理机制,后期逐渐在周围组织瘢痕形成的基础上,新生血管代偿性异常增殖,最终出现内镜下微血管分布失衡的表现。氨磷汀可能通过下调VEGF、bFGF和PI3K/PKB通路mRNA表达从而减轻急性放射性肠炎的微血管损伤,并可能在慢性放射性肠炎的发生、发展中发挥作用。
