DADLE对SH-SY5Y细胞缺氧复氧损伤的保护作用
2020-03-07刘麟文周雅春姚俊岩
刘麟文 周雅春 姚俊岩
(上海交通大学医学院附属第一人民医院麻醉科,上海 200080)
中枢神经系统的缺血再灌注损伤,包括缺血性脑梗塞和脊髓缺血再灌注损伤,其后果严重,不仅导致不同程度的神经功能缺失如偏瘫、截瘫,甚至引起死亡[1-4]。近年的流行病学研究结果表明,全球缺血性脑血管疾病的发病率和病死率逐年上升,且呈现出年轻化发展的趋势[5,6],如何减轻神经缺血再灌注损伤日益受到重视。众多学者力求采取低温、缺血预处理后处理等措施保护缺血的神经系统,但效果有限[7-10]。药物保护措施因具备可行性高、创伤小等优点,具有更广阔的临床应用前景,但目前尚缺乏公认有效的神经保护药物。[D-Ala2,D-Leu5]enkephalin(DADLE)是一种人工合成的 δ 阿片受体(δ opioid receptor,DOR)激动剂,DADLE 可诱发冬眠,保护外周器官,促进细胞生存,这种保护作用在心、肝和肾等器官均有所体现[11-12]。但δ 阿片受体激动剂能否减轻神经系统缺血再灌注损伤,目前研究尚少。且临床上应用大剂量阿片受体激动剂将带来呼吸抑制等严重副作用,因此如何更好地利用其保护作用,减少或避免副作用值得深入探讨。人神经母细胞瘤细胞SH-SY5Y细胞是神经保护领域普遍采用的工具细胞,本研究采用体外培养的SH-SY5Y细胞进行不同时间的缺氧,复制神经细胞不同程度的缺氧复氧损伤,继而在缺氧过程中给予不同浓度的DADLE,探讨其对神经细胞有无保护作用,且该作用是否具有剂量效应关系,确定其最佳保护剂量。
1 材料和方法
1.1 试剂
人神经母细胞瘤细胞SH-SY5Y细胞来源于中国科学院上海生命科学研究院细胞资源中心;高糖DMEM 培养基、无糖DMEM 培养基、噻唑蓝MTT(3-[4,5-dimethyl-2-thiazolyl]-2,5-diphenyl-2Htetrazolium bromide)和DMSO 均购自美国Sigma公司;胎牛血清购自美国Gibco 公司。
1.2 细胞培养及分组
将SH-SY5Y细胞用含10%胎牛血清和1%双抗(青霉素加链霉素)的高糖DMEM 培养基培养,置于37℃、5%CO2的培养箱中使细胞贴壁生长,隔天换液。当细胞生长到80%~90%时,用0.25%胰酶进行消化传代。待细胞处于生长对数期时,进行细胞计数、铺板等操作,用于后续实验。
将上述细胞随机分为以下5 组:缺氧0 h 组,即无缺氧对照组;缺氧6 h 组;缺氧12 h 组;缺氧24 h 组;缺氧48 h 组。将4 组中的正常细胞培养液更换为无糖DMEM 培养基,并置于37℃自制恒温缺氧罐中,使缺氧罐中逐渐充满5%CO2和95%N2混合气,直至达到无氧状态。将上述细胞按照分组条件,置于无氧罐中分别行缺氧6、12、24 h 和48 h 后取出,更换高糖DMEM 培养基,置于正常培养箱中复氧4 h。缺氧0 h 组组细胞则于其余各组细胞缺氧开始及结束两个时间点,相应更换2 次正常培养基,并全程置于正常CO2细胞培养箱中使细胞正常生长,未行缺氧和复氧操作。分别于缺氧即刻及复氧后,将各组细胞置于显微镜下观察,了解并记录细胞的形态变化。
1.3 MTT 法检测细胞生存率
根据预实验结果,将上述96 孔板中每孔接种 5 000 个细胞,每孔100 μL 细胞悬液。待缺氧6、12、24 h 和48 h 各组细胞分别缺氧6、12、24 h或48 h 后,吸去无糖培养基,加入无酚红高糖DMEM 培养基100 μL,同时进行复氧,此时每孔细胞加入MTT 溶液20 μL,小心操作避免污染,继续避光孵育4 h 后终止复氧。缺氧0h组细胞仅更换2 次正常培养基。各组细胞均予400 g×3 min 离心后吸取上清液,每孔再加入150 μL DMSO 溶液,振荡10 min,使结晶物充分溶解,继而在酶标仪上选择490 nm 波长测定各组细胞光吸收值,以缺氧时间为横坐标,生存率为纵坐标绘制细胞生长曲线。生存率计算公式为细胞生存率% =(缺氧组细胞吸光度值-调零孔吸光度值)/(对照组吸光度值-调零组吸光度值)×100%。
1.4 评估缺氧和复氧4 h 对细胞的损伤程度。
首先将SH-SY5Y 单细胞悬液稀释为5×104/mL,于96 孔板中种板,使得每孔含100 μL 细胞悬液,随机分为缺氧对照组、PBS 对照组和DADLE药物处理组3 组。将上述3 组细胞分别加入等量无糖DMEM 培养基,置于37℃恒温的5% CO2和95% N2缺氧罐中同步缺氧12 h。缺氧期间,缺氧对照组仅给予单纯缺氧处理不给予任何药物;而DADLE药物处理组细胞每孔加入1 μL 浓度为100 pmol/L的DADLE 药物进行孵育;PBS 对照组细胞每孔按照等容原则给予PBS 1 μL。缺氧12 h 结束后,从缺氧罐中取出3 组细胞,吸去无糖培养基,更换为高糖DMEM 培养基,置于正常培养箱中复氧,同时给予MTT 孵育4 h,复氧结束后采用MTT 法测定细胞生存率。
另选SH-SY5Y细胞研究其保护作用有无量效关系。即将SH-SY5Y细胞随机分为6 组:D0 组:单纯缺氧组;D1 组:DADLE 10 pmol/L 组;D2组:DADLE 100 pmol/L 组;D3 组:DADLE 1 nmol/L 组;D4 组:DADLE 10 nmol/L 组;D5 组:DADLE 100 nmol/L 组。将上述6 组细胞同步缺氧12 h,缺氧期间,D0 组细胞仅给予单纯缺氧处理,不加入任何药物孵育;而D1、D2、D3、D4 和D5组则加入等容量(每孔1 μL)分别含有10 pmol/L、100 pmol/L、1 nmol/L、10 nmol/L 或100 nmol/L的DADLE 溶液进行处理。缺氧12 h 结束后,各组细胞同时复氧,并给予MTT 试剂孵育4 h 后检测细胞生存率。
采用SPSS 24 进行统计学分析,所有数据以±s表示,各组间整体比较采用单因素方差分析(One-Way ANOVA),两两比较采用LSD 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 光镜下SH-SY5Y细胞形态
结果显示(图1),可见正常SH-SY5Y细胞呈棒状、杆状或梭状,有较短的或者中等长度的放射状神经突起,细胞核粗大。
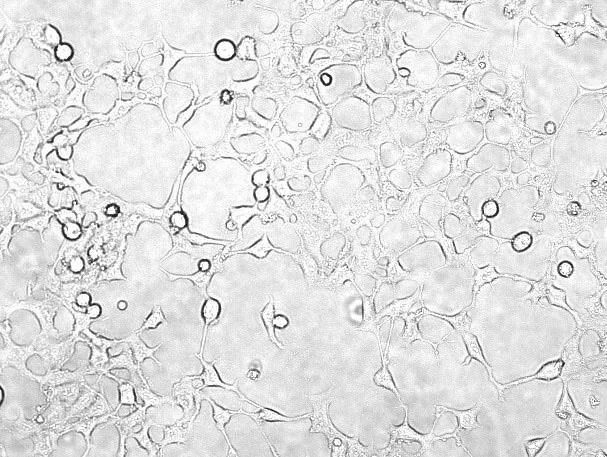
图1 正常SH-SY5Y细胞形态,×200Fig 1 Normal SH-SY5Y cell morphology,×200
2.2 SH-SY5Y细胞缺氧不同时间的显微镜下形态变化
光镜下(图2)可见:缺氧6 h后,SH-SY5Y细胞形态出现异常,表现为细胞形态变得细长,细胞间连接不再紧密。绝大部分细胞离开底壁,折光度变差。而复氧4 h后,部分细胞重新贴壁,但细胞状态仍无法恢复正常。缺氧12 h后,SH-SY5Y细胞形态变化更为明显,表现为细胞失去正常形态,变圆、肿胀,聚集成团,全部细胞均脱离底壁,而复氧4 h后,细胞仍不能贴壁,仍保持悬浮于培养液中。
2.3 SH-SY5Y细胞缺氧不同时间和复氧4 h 的生存率
无缺氧对照组的细胞生存率为100%。缺氧6 h 后复氧4 h 组细胞生存率为(68.1±4.3)%;缺氧12 h 后复氧4 h 组细胞生存率为(52.6±2.8)%;缺 氧24 h 后复氧4 h 组细胞生存率为(26.7± 1.5)%;而缺氧48 h 后复氧4 h 组细胞生存率为(3.5±1.7)%。缺氧6、12、24 h 和48 h 组与无缺氧对照组比较,细胞生存率的差异均有统计学意义,表现为随着缺氧时间的延长,细胞的生存率逐渐降低(P<0.05)。说明SH-SY5Y细胞体外缺氧6、12、24 h 或48 h,复氧4 h 后可导致不同程度的细胞损伤。
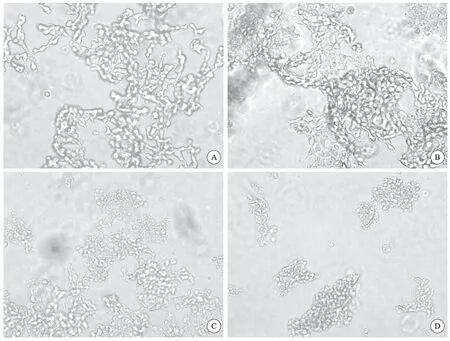
图2 缺氧及复氧后的细胞形态,×200Fig 2 Cell morphology of SH-SY5Y after hypoxia and reoxygenation,×200
2.4 给药DADLE 100 pmol/l 后细胞生存率变化
与单纯缺氧组比较,SH-SY5Y细胞缺氧12 h 期间给予DADLE100 pmol/L 处理可使细胞生存率上升到(58.7±0.5)%,差异有统计学意义(P<0.05)。而溶媒PBS 对照组细胞生存率无明显增高(P>0.05),说明用于溶解DADLE 的溶媒无作用,该保护作用是由DADLE 药物本身产生。DADLE 对SH-SY5Y细胞缺氧12 h 复氧4 h生存率的影响如图3 所示。
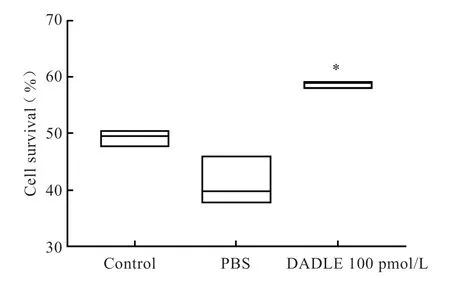
图3 DADLE 100 pmol/L 对SH-SY5Y细胞缺氧复氧后 生存率的影响与缺氧对照组比较Fig 3 The effect of DADLE 100 pmol/L on the survival rate of SH-SY5Y cells after hypoxia-reoxygenation
2.5 不同浓度DADLE 对细胞缺氧复氧损伤的影响结果
结果显示DADLE 10 pmol/L和100 pmol/L 2 个药物剂量使神经细胞生存率分别上升为(61.2±2.4)%和(58.7±0.5)%,与单纯缺氧对照组比较差异有统计学意义(P<0.05);而 DADLE 1、10 nmol/L 和100 nmol/L 3 个剂量组的细胞生存率与单纯缺氧组比较,未见明显上升(P>0.05)。DADLE 对SH-SY5Y 缺氧复氧保护作用的量效关系如图4 所示。可见DADLE 药物的保护作用与DADLE 剂量密切相关,并呈现出小剂量的效果优于大剂量的效果。随着剂量的增加,其保护作用反而减弱。
3 讨论
建立稳定性高、可重复性强的神经损伤模型是研究药物神经保护效果的关键。本实验所采用的神经母细胞瘤细胞SH-SY5Y细胞是实验室中常用的研究神经功能的工具细胞,可较好反映神经细胞的一般特征。建立缺血再灌注损伤的缺氧复氧细胞模型有多种方法,目前应用广泛的方法是物理缺氧复氧法和化学缺氧复氧法。本研究使用的混合气体培养法是目前建立体外细胞缺氧复氧模型最常用的方法[13],其具体方案是将95%N2和5%CO2组成的混合气体通入一个自制密闭盒子,制造无氧环境,将细胞在无氧环境培养相应时间后再置于正常环境中培养,造成缺氧复氧损伤,从而模拟在体模型中的缺血再灌注损伤。

图4 DADLE 对SH-SY5Y 缺氧复氧保护作用的量效关系Fig 4 The dose-effect relationship of DADLE on SH-SY5Y hypoxia-reoxygenation
本研究成功采用混合气体培养法建立了SHSY5Y细胞体外缺氧复氧损伤模型。研究结果表明,缺氧12 h 后,SH-SY5Y细胞形态发生明显变化,表现为细胞失去正常形态,变圆、肿胀,聚集成团,全部细胞均脱离底壁,证明缺氧12 h 已经对细胞状态产生一定损害;而再复氧4 h 后,细胞仍不能贴壁,保持悬浮于培养液中,进一步说明缺氧12 h后复氧4 h 对细胞造成了明确损伤。同时MTT 检测结果提示,缺氧12 h 后复氧4 h 可使细胞生存率降低至(52.6±2.8)%。据文献报道,细胞生存率在30%~60%范围内,更有利于神经保护药物是否有效的评估[14]。而在预实验中我们还发现,因SH-SY5Y细胞生长快、倍增时间短,缺氧后如复氧时间过长,细胞可能恢复生长,将影响最终生存率的正确判断。因此,本研究确定缺氧12 h 后复氧4 h 可使细胞生存率维持在50%左右,可满足药物作用效果的实验要求,可作为建立稳定的体外SHSY5Y细胞缺氧复氧模型的条件。
阿片系统主要由多种阿片肽及其相应受体组成,其中阿片受体主要包括κ 阿片受体(KOR),μ 阿片受体(MOR)和δ 阿片受体(DOR),其中DOR 广泛分布于心、肝、肺、肾等组织器官中,在神经系统中的脑和脊髓均有一定分布[15-16]。在大鼠大脑中动脉闭塞模型中的研究发现,DOR 的激活可对缺血后的脑细胞产生一定的神经保护作用[17-18]。DADLE 是一种人工合成的δ 阿片受体激动剂,近年来,因其能诱导冬眠,延长外周和中枢组织细胞存活时间而受到关注[15]。据报道,DADLE可通过MEK-ERK 途径促进细胞存活。同时DADLE 还可促进大鼠空间认知功能的恢复,并调节缺血后的神经发生[19]。本研究首先选择DADLE 100 pmol/L 探讨DADLE 对神经细胞缺氧复氧损伤有无保护作用,结果与单纯缺氧组比较,缺氧期间给予DADLE 100 pmmol/L 处理可使细胞生存率上升到(58.7±0.5)%;而其溶媒对照PBS 并无保护作用。上述结果提示DADLE 可减轻神经细胞的缺氧复氧损伤,这与其他学者的研究结果相一致。
有研究表明,DADLE能降低大鼠海马神经元的死亡,改善其学习记忆能力和运动功能,作用与剂量有相关性[20]。因此,本研究在确认DADLE 100 pmol/L有明确保护作用的基础上,进一步研究了缺氧期间给予其他不同剂量DADLE,使细胞孵育液的DADLE浓度变为更小的10 pmol/L和更大的1 nmol/L、10 nmol/L和100 nmol/L,对细胞进行处理后发现10 pmol/L和100 pmol/L 2个剂量对细胞有明显保护作用,而1、10 nmol/L和 100 nmol/L对细胞的保护作用反而减弱甚至消失,该结果说明DADLE的神经保护作用存在剂量依赖效应,呈现出较小剂量的保护作用优于较大剂量。推测DADLE的该种量效关系可能与DADLE在较大剂量和较小剂量时激活的机制不同有关,如分别激活依赖于阿片受体或不依赖于阿片受体两种完全不同的信号转导途径从而产生不同的作用。其次,本研究发现,随着药物剂量增大,DADLE的神经保护作用反而消失,这也可能是由于较大剂量的DADLE产生了毒副作用,反而对神经细胞造成损伤所致。关于DADLE 减轻SH-SY5Y细胞缺氧复氧损伤的具体作用机制尚有待下一步设计实验进行进一步研究。
综上,本研究表明SH-SY5Y细胞体外缺氧6、12、24 h 或48 h,复氧4 h 后可导致不同程度的神经细胞损伤,而缺氧期间给予DADLE 可对神经细胞产生明确的保护作用,且该保护作用与DADLE 剂量存在效应关系,呈现出10 pmol/L 和100 pmol/L 两个较小剂量的保护效果优于1、10 nmol/L 和 100 nmol/L 3 个较大剂量。本研究为采用阿片受体激动剂作为神经缺氧复氧损伤的保护作用提供了一定的实验室依据。