脂肪间充质干细胞外泌体对心肌梗死中心肌细胞的保护作用*
2020-03-07徐主恩洪家旺吴永刚
徐主恩 章 波 黎 荣 洪家旺 陈 亮 吴永刚
(上海市浦东医院急诊科,上海 201300)
随着科技发展和社会进步,心血管药物及器械取得突破性的进展,但心肌梗死死亡率仍然居高不下。近年来,干细胞为基础的细胞治疗成为心肌梗死研究的热点,其机制主要为旁分泌效应[1]。虽然干细胞治疗心肌梗死安全可行,但是细胞移植后在损伤区域分布的数量较少,且细胞在移植后凋亡较快,是否致瘤也不明确[2-4]。因此,寻找新的靶点和方法实施干细胞对心梗的治疗具有重要意义。外泌体是一种直径在30~120 nm 有膜结构的纳米囊泡,形成于细胞小体,并被释放到细胞外周,能够通过传递蛋白、microRNA 等介导细胞间的信号。研究报道,干细胞来源的外泌体在心保护方面作用显著,其能够抑制心肌细胞凋亡、促进新生血管生成、改善心肌梗死后功能[5-9]。但是脂肪间充质干细胞(adipose tissue-derived stromal cell,ADSCs)来源的外泌体及其对心肌梗死的治疗,却鲜有报道。本研究拟将ADSCs 来源的外泌体,通过免疫印迹和透射电镜的方法进行鉴定,并用纯化后的外泌体处理缺血缺氧24 h 后H9C2 细胞,观察其凋亡和增殖的变化,从而确定ADSCs 来源的外泌体对心肌梗死后心肌细胞的保护作用。
1 材料和方法
1.1 实验动物和材料
3~4 周雄性SD 大鼠(50~60 g),由第二军医大学动物中心提供。培养基DMEM/F12、培养基1640 和胎牛血清(FBS)购自美国Gibco 公司;TUNEL 细胞凋亡检测试剂盒购自上海汉恒生物公司;CCK8 试剂盒购自浙江碧云天生物公司;外泌体提取试剂盒购自上海领科生物;CD9、CD63、CD81 抗体购自美国Abcam 公司;山羊抗小鼠IgG二抗购自英国Invitrogen 公司。
1.2 ADSCs 的分离、培养
大鼠经颈椎脱臼处死后,取大鼠腹股沟处脂肪并用无菌刀片切碎成糊状,用0.15%的Ⅳ型胶原酶在37℃消化45 min,1 500 r/min 离心5 min,去除悬浮的上清液和脂肪,加入培养液:DMEM/F12+15% FBS+1% penicillin/streptomycin,将 细胞重悬,接种于75 cm2培养瓶,置入37℃含5%的CO2培养箱培养。24 h 后换液,去除未贴壁细胞。当细胞融合达80%~90%时,进行细胞1:2 传代,传至第4 代待用。
1.3 ADSCs 外泌体的提取
第4 代ADSCs 无血清无氧培养48 h,收集细胞上清液,在4℃条件下,2 000 r/min 离心20 min,除去残渣;转移至新的离心管中,加入1/3 体积的外泌体分离液;颠倒直至完全混匀,放4℃过夜。4℃过夜后可见白色浑浊形成;4℃,5 000 r/min,离心30 min 弃上清,再次重复以上离心。剩余的沉淀即为外泌体。
1.4 外泌体电镜观察
取分离纯化外泌体 8 µL,加入等体积平衡盐PBS 溶液稀释后滴加于2 mm 的载样铜网上,于室温静置1 min,用滤纸吸去多余液体,用3%(w/v)磷钨酸钠溶液(pH6.8)室温负染5 min,用双蒸水洗后室温晾干,于透射电镜下观察并拍照。
1.5 免疫印迹检测
将提取的外泌体用0.1 mol/L PBS 清洗后加Radio-Immunoprecipitation Assay(RIPA)buffer进行细胞裂解。取上清液,用Bradford 法测蛋白浓度,于100℃水中煮5 min,离心备用。制备分离胶,加样,SDS-PAGE 电泳,取出胶板进行转膜,染膜,然后用一抗CD9(1∶1 000)、CD63(1∶1 000),CD81(1∶2 000),4℃孵育过夜。二抗(1∶2 000)室温孵育2 h。取膜后TBST 漂洗,用保鲜膜包好PVDF 膜,暗室中用X 胶片感光、显影、定影。
1.6 H9C2 细胞凋亡检测
分别取24 孔板中单独培养和10 µg 外泌体处理48 h 的H9C2 细胞。用4%多聚甲醛固定10 min,用0.3% Triton X-100 通透10 min,每孔加100 µL TUNEL 检测试剂,37℃避光孵育60 min,PBS 洗涤 3 次,用DAPI 染色5 min,用PBS 洗涤3 次后置于荧光显微镜下观察。
1.7 H9C2 细胞增殖能力检测
分别取单独培养(外泌体处理0 h)和外泌体处理(20 µg/mL)24 h、48 h 和72 h 的H9C2细胞。分别经胰酶消化制成单细胞悬液,接种于 96 孔培养板中,浓度为3×103细胞/孔,待细胞贴壁后,分别用10 µg ADSC-exosome 处理,每孔加 5 µL CCK8,反应3 h 后,用酶标仪进行检测,450 nm 波长处测定96 孔板上每个孔的吸光度值(OD)。
1.8 统计学处理
以上实验均重复3 次,结果取平均值。应用SPSS18.0 统计学软件进行分析,计量数据以±s表示,两组间比较采用t检验,多组之间的差异采用单因素方差分析(one-way,ANONA)。
2 结果
2.1 ADSCs 形态特征
细胞接种24 h 后,将培养基弃掉,并反复用PBS 清洗后,可见瓶底有零星的贴壁细胞,形态呈多角形或梭形即为ADSCs。培养3 d 后,ADSCs 呈团簇状聚集生长。传代后,细胞呈长梭形,两端有较长突起,均匀分布生长。传至第4 代时,细胞纯度可达99%以上。第1 代至第4 代细胞形态变化不明显(图1)。

图1 ADSCs 形态特征,标尺=50 μmFig 1 Morphology of ADSCs,bar=50 μm
2.2 外泌体的形态和表形特征
透射电镜下ADSC 外泌体呈圆形或椭圆形,直径30~120 nm,有完整胞膜结构,内含低密度物质(图2)。免疫印迹结果证实其表达外泌体表面标志CD9、CD63 和CD81(图3)。
2.3 H9C2 细胞的凋亡检测
在缺血缺氧24 h 又经ADSCs 外泌体处理48 h之后,TUNEL 检测结果显示H9C2 细胞凋亡的数量相比于未处理组有明显的下降(图4)。在光镜下可见经过外泌体处理后的H9C2 细胞,其细胞状态相对更好。以上结果提示ADSCs 外泌体抑制缺血缺氧H9C2 细胞的凋亡。
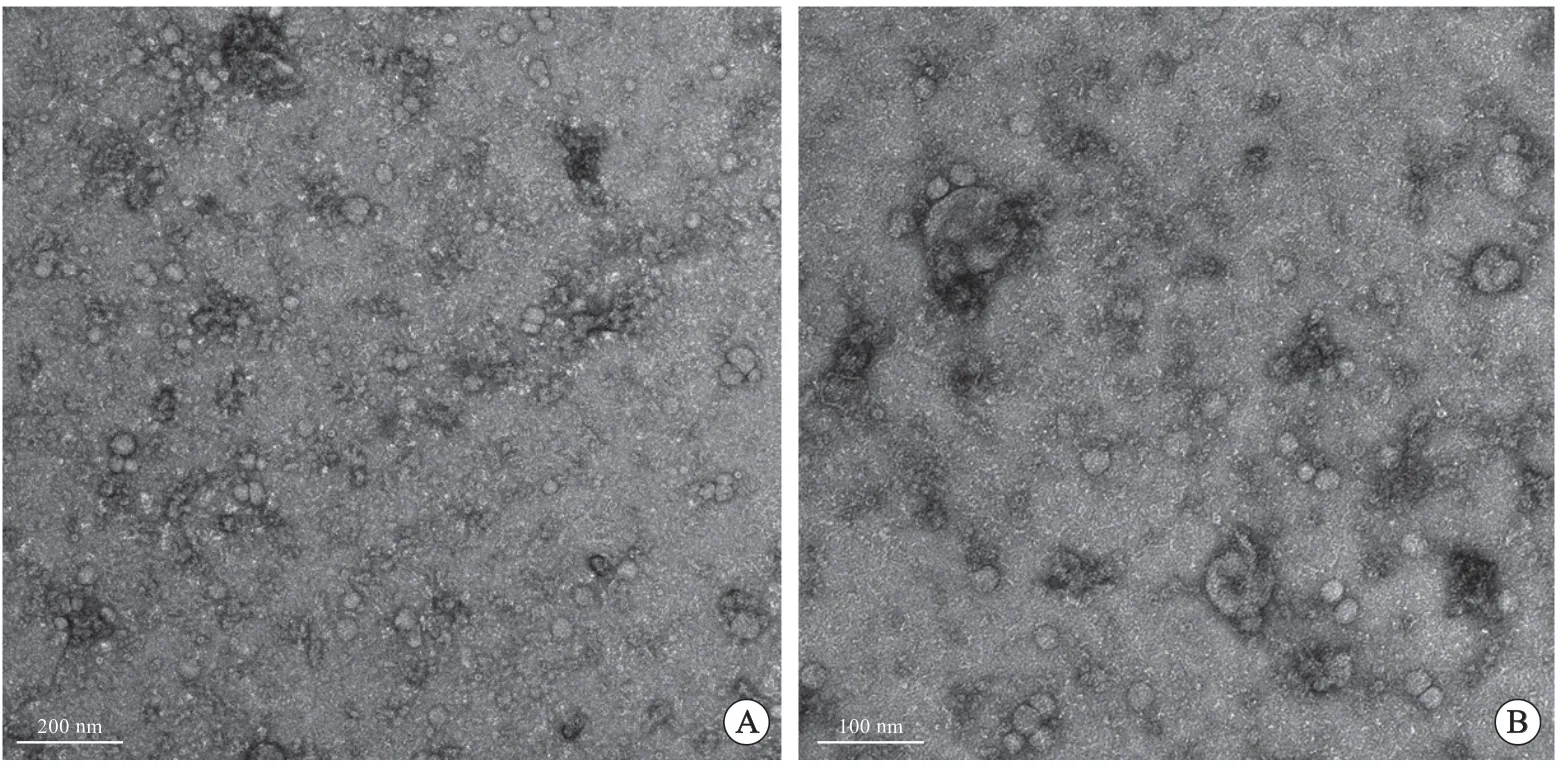
图2 ADSCs 外泌体的透射电镜观察Fig 2 Electron micrographs of ADSCs-derived exosomes

图3 ADSCs 外泌体表达CD9、CD63、CD81 标记蛋白Fig 3 Exosomes secreted from ADSCs were identified by protein marker CD9,CD63,and CD81
2.4 H9C2 细胞的增殖检测
CCK8 检测结果提示H9C2 细胞在经过ADSCs处理24 、48 h 和72 h 后,其增殖能力相较于对照组有明显的增强(图5)。说明ADSCs 外泌体促进缺血缺氧H9C2 细胞的增殖。
3 讨论
多种干细胞可用于治疗心肌梗死、心力衰竭等心脏疾病。ADSCs 可从皮下脂肪获得,取材方法更为简单,容易被患者所接受[10],而且受年龄影响比较小,年长患者依然可以获得活力较好的ADSCs[11-12]。脂肪干细胞的增殖能力很强,可在短时间内获得大量活力较好的细胞。ADSCs 在基础研究和临床移植中取得了较好治疗效果[13]。但是仍面临一些障碍:细胞在损伤区滞留率比较低,细胞植入体内后存活率也比较低,虽早期有一定作用,但长期保护作用却未知[14-15]。
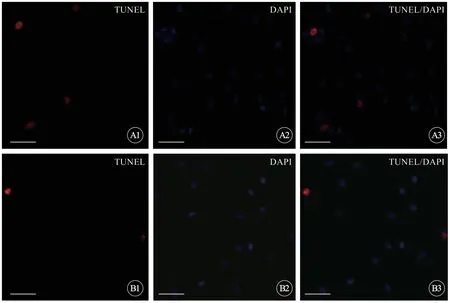
图4 H9C2 细胞经ADSCs 外泌体处理48 h 后(图B),相比于未处理组(图A),细胞凋亡数量明显减少,bar=25 μmFig 4 The apoptosis of H9C2 cells was significantly reduced after 48 h exosomes treatment(B)with comparison to no treatment(A),bar=25 μm

图5 H9C2 细胞的增殖能力Fig 5 Proliferation of H9C2 cells
而ADSCs 外泌体既可以起到对心的保护作用,又可避免以上问题,所以成为新的研究热点。实际上,外泌体确实可以通过生长因子、趋化因子、细胞因子、转录因子、基因和RNA 起到一定作用。作为一种膜囊泡,外泌体不仅有装载大量货物的能力,但也能保护蛋白质和RNA 等物质的降解酶或化学物质[16]。而且,外泌体可以减少心肌细胞的凋亡,影响心重构,改善心肌功能。
本实验用对H9C2 细胞进行缺血缺氧的培养方式在体外建立心梗模型。ADSCs 外泌体对H9C2 细胞处理后,显示其凋亡减少,增殖能力变强。所以,ADSCs 外泌体对心肌梗死有保护作用,是治疗心肌梗死的新方法。