原发性胆汁性胆管炎相关细胞因子的研究进展
2020-02-28黄志琴黄会芳
黄志琴, 黄会芳
1 山西医科大学第一临床医学院,太原 030000; 2 山西医科大学第一医院 消化内科, 太原 030000
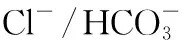
免疫细胞及细胞因子在固有免疫和适应性免疫应答过程中参与PBC的发生发展。 细胞因子指在细胞信号传导中起介导作用的蛋白质,包括IL、IFN、TNF、集落刺激因子、趋化因子、生长因子、TGFβ家族等。 PBC患者肝组织门静脉汇管区CD4+T淋巴细胞、CD8+T淋巴细胞浸润明显增多;CD4+T淋巴细胞在不同细胞因子的刺激下分化为辅助性T淋巴细胞(Th)1、Th2、Th9、Th17、调节性T淋巴细胞(Treg)等,这些CD4+T淋巴细胞亚群可进一步分泌多种细胞因子介导肝脏炎症过程[4]。同时,CD8+T淋巴细胞在CD4+T淋巴细胞的辅助下,通过表达自杀相关因子(factor associated suicide,Fas)、IFNγ发挥细胞毒性作用。B淋巴细胞也可在CD4+T淋巴细胞的辅助下,分化为浆细胞,产生AMA。对于天然免疫细胞,PBC患者单核细胞和巨噬细胞也明显增多[4],同样通过分泌多种细胞因子介导肝脏炎症过程,而自然杀伤细胞(NK细胞)、自然杀伤T淋巴细胞(NKT细胞)通过分泌穿孔素、自杀相关因子配体(factor associated suicide ligand,FasL)、IFNγ介导BEC损伤。因此,免疫细胞与细胞因子紧密联系,共同参与PBC的免疫调节。
1 细胞因子在PBC中的作用
鉴于细胞因子作为免疫调节过程中的重要成分参与PBC的发病,以下主要介绍促炎细胞因子IL-12、IL-17、IL-9、IL-8、TNFα、IL-6和抗炎细胞因子IL-10及其相关信号通路在PBC中的作用。
图1PBC的发病机制
1.1 IL-12 IL-12家族包括IL-12、IL-23、IL-27、IL-35,是一组异二聚体分子,发挥多向免疫调节功能。IL-12主要由抗原递呈细胞产生,由P35(IL-12A基因编码)和P40(IL-12B基因编码)亚基组成,分别与IL-12受体(IL-12 receptor,IL-12R)β2(IL-12RB2基因编码)和IL-12Rβ1(IL-12RB1基因编码)结合。IL-12通过IL-12—Janus激酶2(JAK2)—信号转导和转录激活因子4(STAT4)信号通路促进CD4+T淋巴细胞向Th1分化,Th1产生IFNγ和TNFα发挥促炎作用,同时IFNγ可能通过正反馈上调IL-12 Rβ2的表达,并抑制CD4+T淋巴细胞向Th17分化[5]。遗传因素可能是PBC的发病基础,研究[6]发现了27个与PBC相关的非人类白细胞抗原风险基因位点,其中IL-12A和IL-12RB2基因位点与PBC的相关性最强,也最容易重复,且与IL-12通路有关的下游基因位点酪氨酸激酶2(tyrosine kinase 2,TYK2)、STAT4和与IL-12产生有关的上游基因位点干扰素调节因子(interferon regulatory factor,IRF)5、细胞因子信号抑制物1(suppressors of cytokine signaling 1,SOCS1)、核因子-κB1(NF-κB1)和肿瘤坏死因子受体超家族成员1A(tumor necrosis factor receptor superfamily member 1A,TNFRSF1A)均与PBC具有相关性。如IRF5与NF-κB结合促进包括IL-12在内的Th1型细胞因子的产生,IRF8基因编码的转录因子与IL-12的启动子结合也可以调节IL-12和IFNγ的产生[6]。IL-12—JAK2—STAT4通路相关分子的遗传易感性与PBC密切相关。Yoshida等[7]发现,IL-12P40亚基在TGFβⅡ型受体显性失活(dominant-negative transforming growth factor-β receptor type Ⅱ,dnTGFβRⅡ) 小鼠(PBC动物模型)中起致病作用,且在敲除IL-12P40亚基后血清细胞因子、肝脏门静脉淋巴细胞浸润、胆管损伤降低,胆管炎的症状得到改善,但是IL-12的靶向治疗并未真正应用于临床。
1.2 IL-17 IL-17参与多种自身免疫性疾病的发展,然而在PBC中的作用尚不清楚。研究[8-10]发现,PBC患者及动物模型IL-2受体α敲除(IL-2 receptor α knockout mice,IL-2RαKO)小鼠、2-辛炔酸偶联牛血清白蛋白(2-octynoic acid coupled to bovine serum albumin,2OA-BSA)小鼠外周血IL-17及肝组织中Th17高表达,肝组织中Th17主要聚集在受损的小叶间胆管周围,而且2OA-BSA小鼠敲除IL-17后可减轻胆管损伤和降低AMA滴度,提示IL-17可能参与PBC的致病过程。国内外学者[8,11]发现,Th17是由CD4+CD161+T淋巴细胞分化而来,同时肝脏的非实质细胞(nonparenchymal cell,NPC)如肝巨噬细胞、肝窦状内皮细胞、肝星状细胞和树突状细胞对Th17的生成具有重要意义。Lan等[8]研究表明,和单独培养的脾脏CD4+T淋巴细胞相比,与野生型小鼠肝脏NPC共培养的脾脏CD4+T淋巴细胞可使IL-17的浓度增加约10倍。血清IL-6、IL-1β和IL-23可能诱导IL-17的生成,而血清IL-2对IL-17的生成起抑制作用[8,12]。因此,进一步研究IL-17参与PBC的具体机制时,需要考虑肝脏NPC与CD4+T淋巴细胞的相互作用及细胞因子环境。另外,外周血IL-17与肝组织Th17的分布不是一成不变的,随着PBC疾病进展,IL-17在循环中逐渐减少,Th17在肝脏中逐渐积聚,且Th17可能以时间和剂量依赖方式促进肝星状细胞增殖和IL-8分泌发挥促肝纤维化作用[11]。近年来,Kawata等[10]和Yang等[13]先后发现,IL-12/Th1和IL-23/Th17信号通路在PBC中起致病作用,IL-12/Th1在疾病早期起关键作用,IL-23/Th17可增强IL-12/Th1介导的免疫损伤,晚期PBC患者Th1/Th17平衡向Th17偏斜,提示Th17在PBC晚期起主导作用,推测Th17的失衡可能成为PBC晚期患者免疫治疗的靶点。
1.3 IL-9 IL-9是由一种新发现的T淋巴细胞亚群即Th9分泌。 IL-9与其受体结合后发挥多效性,可能通过激活STAT3促进CD4+T淋巴细胞向Th17分化发挥促炎作用,也可能通过激活STAT5增强Treg的免疫抑制功能[14]。我国学者[15-17]初步发现,PBC患者外周血和肝组织中IL-9呈高表达,肝组织中增高的Th9主要位于门静脉汇管区的BEC,与PBC主要损伤BEC一致;研究还发现,血清IL-9与IgG呈正相关,推测IL-9可能参与B淋巴细胞的分化增殖过程,促进自身抗体的产生,进而参与肝组织的炎症损伤过程。肝纤维化是PBC等慢性肝病进展至终末期肝病的必经阶段,Qin等[18]首次发现IL-9具有促肝纤维化作用,Guo等[19]进一步发现IL-9主要通过Raf/MEK/ERK信号通路促进肝纤维化。目前,IL-9在PBC中的作用处于初步研究阶段,尚需研究证实IL-9参与PBC的具体机制。
1.4 IL-8 IL-8作为一种趋化因子可以吸引中性粒细胞。研究[20]指出,胆汁淤积性肝病患者反应性胆管周围的中性粒细胞浸润可能与受损BEC表达的IL-8有关。Yokoyama等[21]进一步证实,包括PBC在内的慢性炎性胆管病变,肝内BEC中IL-8的分泌是通过脂多糖(LPS)—Toll样受体4(TLR4)—NF-κB—丝裂原活化蛋白激酶(MAPK)途径。此外,IL-8与细胞生长、肿瘤发生相关,可以诱导胆管细胞增殖,有助于胆管损伤修复,但IL-8持续升高可能导致细胞异常增殖,进而发生癌症。研究[22]发现,血清IL-8与原发性肝癌的肿瘤大小和分期显著相关,同时PBC患者原发性肝癌的发生率较健康人明显增高[23],提示IL-8可能与PBC有关。Zimmermann等[24]通过对病毒、酒精、免疫及其他原因引起的200例慢性肝病患者血清IL-8进行检测,发现PBC患者血清IL-8水平最高,且与肝纤维化进展密切相关;研究还发现,PBC患者肝内IL-8及趋化因子受体1(chemokine receptor 1,CXCR1)明显高表达,而且IL-8与肝内中性粒细胞浸润有关,与Isse等[20]研究结果一致。我国学者[25]也发现PBC患者血清IL-8升高,且与CXCR1呈正相关。最近一项研究[26]精确计算出血清IL-8每增加1 pg/ml,自身免疫性肝病患病概率增加48.36倍。虽然PBC患者对熊去氧胆酸(UDCA)的生化反应可以评估其预后,但在治疗前,几乎无血清学标志物能预测疾病转归。Umemura等[27]纳入136例PBC患者,在UDCA治疗前检测33种血清学标志物的表达水平,进行平均8.8年的随访,发现UDCA治疗前,血清IL-8与肝失代偿、肝病相关死亡有关。
1.5 TNFα TNFα主要由巨噬细胞产生,与受体结合后作用于肝细胞和BEC,激活细胞内caspase通路和NF-κB途径发挥促凋亡及调节作用。早期研究[28]发现,PBC患者血清TNFα增高与疾病的严重程度相关,使用UDCA后TNFα降低。近年来,有学者[29]利用病理学二分法发现dnTGFβRⅡ小鼠敲除IL-6基因后结肠炎症状改善,而PBC症状加重,推测IL-6缺乏后会使肝脏TNFα代偿性增加,因此使胆管炎症状加重。同时医务工作者在使用生物制剂时,要充分考虑对其他自身免疫性疾病的副作用。TNFα可能在PBC中起显著致病作用,TNFα拮抗剂或许对PBC的治疗有效。Spadaro等[30]报道了1例46岁女性患有类风湿关节炎合并PBC,患者对依那西普反应良好,经过30个月的随访,类风湿关节炎及PBC均未再复发。随后,Triantafillidis等[31]及Del Ross等[32]各报道了1例PBC合并其他自身免疫性疾病的患者,经过阿达木单抗治疗,同样症状均得到改善。这些表明PBC与其他自身免疫性疾病可能有共同致病途径,TNFα拮抗剂可能用于PBC的治疗。
1.6 IL-6 已有研究[8-10]发现包括IL-6在内的促炎细胞因子在PBC患者及动物模型血清中明显升高。胆管细胞增生是胆汁性肝硬化发生的原因之一,研究[33]表明,LPS可能通过IL-6/STAT3途径促进大鼠胆管细胞增生进而引发胆汁性肝硬化。2014年Saito等[34]报道了1例57岁女性,患有类风湿关节炎、系统性硬化症合并淋巴结病、PBC,经过9个月的托珠单抗治疗,上述症状均改善。然而这只是个例,IL-6拮抗剂用于PBC的治疗尚需要进一步研究。
1.7 IL-10 IL-10的主要来源是单核巨噬细胞和Th,IL-10与其受体结合后通过抑制主要组织相容性复合物及共刺激CD80和CD86的表达,进而抑制单核巨噬细胞向T淋巴细胞递呈抗原的能力而发挥抑炎作用。近年来,在自身免疫性肝病中,与IL-10产生相关的Treg(CD4+CD25+FoxP3+)研究较为广泛。Treg通过与细胞直接接触或间接产生抑炎细胞因子如IL-10、细胞毒性T淋巴细胞相关蛋白4(cytotoxic T lymphocyte associated protein 4,CTLA-4)等抑制过度免疫反应。研究[35]发现,PBC患者Treg的数量及IL-10的产生均显著低于健康人,但循环和肝脏的共刺激CD86显著增加,表明PBC患者Treg抑制共刺激CD86表达能力的下降可能促进胆管损伤和肝纤维化;同时发现,Treg不仅数量减少,功能也会相对受损,使IL-10的产生进一步减少,推测可能与Treg对IL-2刺激的反应性差有关。最近,一项研究[36]指出,PBC患者Treg对IL-12刺激的敏感度增加,产生更多IFNγ,可能与Treg内STAT4快速而强烈的磷酸化有关,也提示PBC患者Treg功能受损。有学者[37]通过研究Foxp3+Treg敲除的Scurfy小鼠,发现Scurfy小鼠血清TNFα、IL-6、IL-12及AMA滴度显著升高,门静脉周围也有中至重度淋巴细胞浸润,与PBC表现相一致。此外,Tanaka等[38]在dnTGFβRⅡ小鼠的基础上过继转移Foxp3+Treg后发现,胆管炎的症状较未过继转移小鼠明显缓解。由此可见,IL-10及Treg对PBC可能是一种保护因素,通过抑炎作用维持自身免疫耐受,避免过度免疫反应损伤机体。
2 细胞因子相关免疫治疗在PBC中的进展
UDCA是治疗PBC的一线用药,但有约40%患者对UDCA应答不佳,因此亟需寻找有效的替代疗法。2016年,一种新型药物奥贝胆酸(OCA)被批准用于UDCA治疗1年后应答欠佳的患者,然而OCA在失代偿期肝硬化中的作用尚不明确[39]。亦有将免疫抑制药物尝试用于PBC的研究,但疗效较差,因此,研发新的、有效的药物十分重要。与免疫抑制剂相比,生物疗法的特异性更强。针对细胞因子及其信号通路在PBC中的作用,生物制剂的研发仍是一个新的领域。
2.1 IL-12信号通路拮抗剂 (1)抗IL-12/优特克单抗(ustekinumab):ustekinumab是一种靶向IL-12和IL-23共同亚基P40的单克隆抗体,已被批准用于克罗恩病和银屑病。国外一项Ⅱ期临床试验纳入20例对UDCA应答不佳的PBC患者,给予ustekinumab治疗28周后,虽然血清ALP下降约12%,但无患者达到血清ALP下降≥40%的试验预期终点(NCT 01389973)[40]。(2)JAK1/JAK2抑制剂/巴瑞克替尼(baricitinib):IL-12可能通过IL-12—JAK2—STAT4信号通路在PBC中发挥促炎作用[5]。baricitinib是JAK1/JAK2的抑制剂,已被批准用于类风湿关节炎,关于baricitinib在PBC中的疗效观察正在进行Ⅱ期临床试验(NCT03742973)。
2.2 IL-17信号通路拮抗剂 IL-17的靶向治疗已在多种自身免疫性疾病中取得令人满意的疗效,如中和IL-17A的苏金单抗(secukinumab)、依奇珠单抗(ixekizumab)和中和IL-17受体A的布罗达单抗(brodalumab),在银屑病、类风湿关节炎、强直性脊柱炎等 Ⅱ/Ⅲ 期临床试验中的结果均较好[12]。以银屑病为例,Ⅱ期临床试验发现银屑病患者使用secukinumab(NCT01071252)、ixekizumab(NCT01107457)、brodalumab(NCT00975637)12周后,大多数患者的银屑病面积和严重性指数较基线水平至少改善75%, Ⅲ期临床试验(NCT01365455)进一步发现secukinumab比依那西普对银屑病的疗效更快、更持久[12]。netakimab(BCD-085)作为中和IL-17A的另一单克隆抗体,已被批准用于银屑病,其在PBC中的疗效观察也正在进行临床试验。
2.3 Treg细胞疗法 Treg及IL-10、CTLA-4维持机体内免疫耐受状态,可能用于自身免疫性疾病和实体器官移植术后的治疗。(1)Treg:2016年一项研究[41]纳入10例活体肝移植患者,过继转移Treg,同时原有免疫抑制剂逐渐减量,发现7例患者可完全停用免疫抑制剂,其余3例患者在免疫抑制剂减量期间出现轻度排斥反应,而这3例患者均是自身免疫性肝病患者。因此,Treg用于维持自身免疫性肝病患者的免疫耐受状态,尚需进一步研究证实。目前正在进行一系列临床试验,如Treg在肝移植术后(NCT02188719、NCT02474199、NCT02166177)、肾移植术后(NCT02091232、NCT02129881、NCT02088931、NCT02711826)及系统性红斑狼疮(NCT02428309)中的安全性及疗效观察。(2)CTLA-4/阿巴西普(abatacept):Treg分泌CTLA-4,与抗原递呈细胞上的共刺激CD80/CD86结合,抑制T淋巴细胞活化。Popp等[42]报道了1例类风湿关节炎合并PBC的51岁女性患者,给予abatacept后症状改善。随后,一项Ⅲ期临床试验,纳入16例对UDCA应答欠佳的PBC患者,给予abatacept治疗24周后,仅有1例达到试验预期终点(NCT02078882)[43]。(3)IL-10生物制剂:关于IL-10的生物制剂,目前仅用于科研实验,严禁用于临床医疗及其他非科研用途。
2.4 其他 IL-8、IL-9拮抗剂在PBC中的报道较少,仅有研究[44]发现,在右旋糖酐硫酸酯钠诱导的炎症性肠病小鼠模型中,靶向IL-8受体的SB225002拮抗剂可降低炎症性肠病的严重程度。TNFα拮抗剂依那西普[30]、阿达木单抗[31-32]及IL-6拮抗剂托珠单抗[34]可以缓解PBC的症状仅属于个例,可能与PBC和类风湿关节炎、克罗恩病等其他自身免疫性疾病有共同致病途径相关。
3 小结与展望
综上所述,PBC是一种慢性自身免疫性肝病,免疫细胞及细胞因子在固有免疫和适应性免疫应答过程中参与PBC的发生发展。本文着重讨论了促炎细胞因子IL-12、IL-17、IL-9、IL-8、TNFα、IL-6和抗炎细胞因子IL-10及其信号通路在PBC中的作用。随着PBC疾病进展,不同疾病阶段发生的免疫反应及致病信号通路不同,细胞因子的表达水平也不同。此外,细胞因子之间及其与免疫细胞之间相互作用,各种自身免疫性疾病有部分相同的病理特征,使PBC的发病机制更为复杂,至今仍未完全阐明。UDCA是治疗PBC的一线用药,但仍有部分患者对其应答不佳,新型药物如OCA,应用于对UDCA应答不佳的患者,疗效尚不确切。因此,研发新型、高效、高特异性的药物十分重要。目前,细胞因子疗法在类风湿关节炎、银屑病、系统性红斑狼疮中展现出良好的应用前景,而针对细胞因子的生物疗法如baricitinib、netakimab、Treg细胞疗法等在PBC中的研究及应用仍处于试验阶段,值得进一步深入研究。期待针对细胞因子的生物疗法早日成为临床治疗PBC的有效策略。
