不同甘薯品种及其辐射诱变后代基因组变异的分子标记评价
2020-02-27刘家榜冯俊彦屈会娟李建伟蒲志刚
刘家榜 ,赵 珊 ,张 聪 ,冯俊彦 ,李 明 ,屈会娟 ,黎 青 ,李建伟 ,林 杨 ,蒲志刚
(1.四川省农业科学院生物技术核技术研究所,四川成都610061;2.四川省农业科学院分析测试中心,四川成都610066)
甘薯(Ipomoea batatasLam.)俗称红薯、红苕、番薯等,属旋花科(Convolvulaceae)甘薯属(Ipomoea)蔓生多年生草本植物,是重要的粮食和饲料作物,具有较高的食用价值和经济价值[1-3]。2009年世界甘薯种植面积为677万hm2,薯干总产量为2 112万t[4]。甘薯也是我国主要栽培作物之一,常年种植面积在6×106hm2左右,我国甘薯栽培面积和总产量均居世界首位,而四川是我国甘薯种植面积最大的省份之一,每年稳定种植面积在47万hm2以上,鲜薯总产稳定在1 000万t左右[5-7]。
长期以来,我国主要通过选择优质甘薯种质资源或野生材料作为亲本进行杂交,从后代中筛选出具有优良性状的甘薯新品系(种)[8]。但由于甘薯可利用种质资源较少、不易开花、种间杂交亲和性较低等原因,杂交育种技术在甘薯育种上的应用存在较大局限性[9-10]。随着生物技术的不断发展,结合生物技术和辐射诱变技术进行甘薯种质资源创新和品种改良,在甘薯育种中呈现出巨大的应用前景[11]。
经过多年发展,分子标记技术已经在动物、植物、微生物研究中得到了广泛的应用,并取得了大量的研究成果[12-17],可以预见,在今后的研究中分子标记技术将发挥越来越重要的作用。但是目前在甘薯育种研究上可以使用的分子标记仍然较少[18]。
本研究利用目标起始密码子多态性分子标记技术(Start Codon Targeted Polymorphism,SCoT)[19]、重复序列区间扩增多态性标记技术(Inter-simple Sequence Repeat,ISSR)[20]、CAAT盒多态性标记技术(CAATBox-derivedPolymorphism,CBDP)[21]对甘薯品种川薯34和川紫薯2号及其60Co-γ辐射诱变后代进行基因组扫描,比较不同标记对甘薯诱变后代变异的扫描结果;同时利用标记扫描结果评价不同甘薯诱变后代的变异情况,旨在为今后分子标记技术和辐射诱变技术在甘薯育种中的应用提供参考。
1 材料和方法
1.1 试验材料
本研究从2个四川主栽甘薯品种川薯34和川紫薯2号悬浮细胞辐射诱变后代中[22]分别随机选取32株作为试验材料,并使用川薯34和川紫薯2号未诱变材料作为对照。参试材料均由四川省农业科学院生物技术核技术研究所生物育种中心提供;悬浮细胞辐射处理由四川省农业科学院生物技术核技术研究所辐照中心完成。
1.2 试验方法
1.2.1 甘薯基因组DNA提取 参试材料基因组DNA提取参照黄艳岚等[23]的方法进行,略有改进。称取0.5~1.0 g新鲜甘薯叶片,加入液氮研磨至粉末,转入2 mL离心管中,加入0.8 mL预热的CTAB,混匀后,65℃水浴45 min,期间上下颠倒4~5次;加入0.8 mL氯仿,上下颠倒混匀,12 000 r/min离心10min;吸取上清液,加入-20℃预冷的异丙醇1mL,上下颠倒沉淀除DNA后,依次用70%、95%、100%浓度的酒精各洗2遍,晾干后,用1×TE缓冲液(含有20 ng/μLRNA酶)溶解DNA;然后使用Scandrop(Analyticgena)微量核酸测定仪和1%琼脂糖电泳检测DNA的浓度和纯度。根据检测结果,将DNA原液稀释到50 ng/μL,-20℃保存备用。
1.2.2 PCR反应条件 使用的SCoT引物、ISSR引物、CBDP引物以及PCR反应程序及体系均参照已报道的方法[19-21,24],略有改进(表 1)。PCR 反应体系为:反应总体系均为20 μL,分别含有2 μL甘薯基因组 DNA、10 μL 的 2×TaqPCR Mix、3 μL 引物和5 μL ddH2O。PCR反应所需药品、试剂以及引物均购自生工生物工程(上海)股份有限公司。

表1 引物信息
SCoT引物PCR反应程序为:94℃预变性3 min;94℃变性1 min,45~62℃退火1 min,72℃延伸2 min,38个循环;最后72℃终延伸5 min,冷却至12℃保存。ISSR引物PCR反应程序为:94℃预变性5min;94℃变性 45 s,50~55℃退火 45 s,72℃延伸1min 30 s,35个循环;72℃最终延伸5 min,冷却至12℃保存。CBDP引物PCR反应程序为:94℃预变性1min,35 ℃退火 1 min,72 ℃延伸 1 min,5 个循环;94℃预变性1min,50℃退火1min,72℃延伸1min,35个循环;72℃最后延伸10 min,15℃保存。
1.2.3 PCR扩增产物检测 取PCR产物6 μL与5 μL DNA loading buffer混合,用2%的琼脂糖凝胶在110 V电压下进行电泳分离检测,于紫外成像仪上拍照分析。
1.3 数据处理及统计分析
根据检测样品中电泳条带的有无,采用二进位制记录,即在相同迁移率处有带记为1,无带记为0,记录所有引物扩增结果;然后使用NTSYSpc 2.11和Popgen 32软件对各品种及其诱变后代的遗传相似系数进行计算及聚类分析。
2 结果与分析
2.1 辐射诱变甘薯后代PCR扩增多态性分析
川紫薯2号和川薯34悬浮细胞经过低剂量辐射诱变后,后代植株在叶形、叶色、藤蔓长度、藤蔓颜色、薯块形状、薯块大小等方面均出现不同程度的变异(图1)。分别随机选取各品种诱变后代32株,进行分子标记扫描分析,结果表明,6条SCoT引物在参试材料中的PCR扩增产物主要集中在200~2 000 bp(图2),在川薯34及其突变后代中共扩增出条带38条,平均每条引物可产生6.33条条带,发现变异条带4条,变异率为10.5%;在川紫薯2号中共扩增出40条条带,平均每条引物扩增6.67条条带,其中发现变异条带7条,变异率17.5%(表2)。
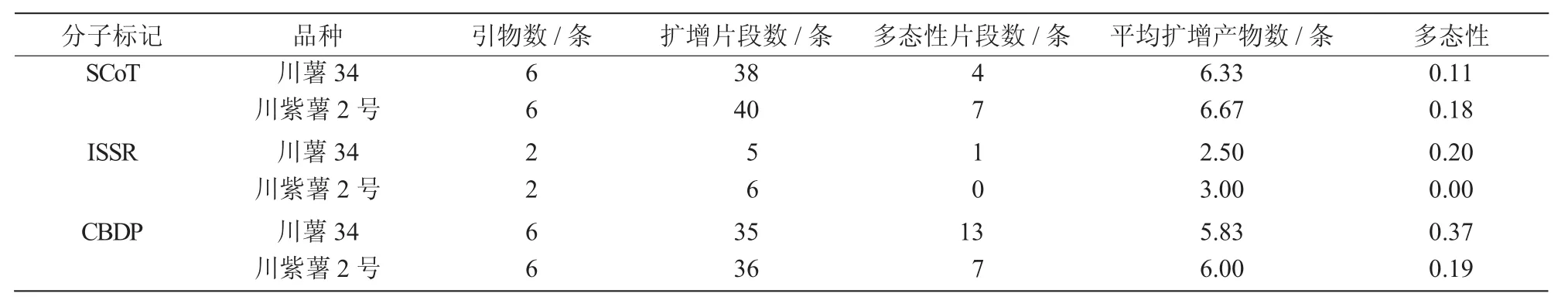
表2 3种分子标记扫描结果统计
2条ISSR引物在川薯34诱变后代材料中,共扩增得到5条条带,引物815扩增获得2条条带,引物873扩增获得3条条带;扩增片段主要处于100~2 500 bp;其中,变异条带1条,变异率20.0%。在川紫薯2号诱变后代中,共扩增获得6条条带,引物815、873扩增分别获得3条条带(表2),扩增产物主要处于600~2 500 bp,未检测到变异条带。
6条CBDP引物在参试材料中获得的扩增产物片段长度处于100~2 000 bp(图2)。在32份川薯34诱变后代中检测到35个扩增片段,平均每条引物获得5.83条条带,检测到变异条带13条,变异率为37.1%;在川紫薯2号材料中,共获到36条条带,其中,变异条带7条,变异率为19.4%(表2)。
2.2 遗传多样性分析
利用Popgen 32软件对3种分子标记在2个甘薯品种及其辐射诱变后代中的扫描结果进行分析,结果表明,在SCoT引物扫描结果中,川薯34的遗传相似性系数变异范围在0.94~1.00,平均遗传相似性系数为0.99,平均Nei's基因多样性指数为0.032 0,Shannon's多样性指数为0.019 5,平均等位基因效应为1.028 3;川紫薯2号的遗传相似性系数变异范围在0.92~1.00,平均遗传相似性系数为0.99,平均Nei's基因多样性指数为0.037 0,Shannon's多样性指数为0.061 1,平均等位基因效应为1.051 1。
在ISSR引物扫描结果中,川薯34的遗传相似性系数范围在0.80~1.00,平均遗传相似性系数为0.97,平均Nei's基因多样性指数为0.0742,Shannon's多样性指数为0.1116,平均等位基因效应为1.1180。由于在川紫薯2号诱变后代中未发现变异条带,其遗传相似性系数、平均Nei's基因多样性指数、Shannon's多样性指数、平均等位基因效应均未进行分析。
在CBDP引物扫描结果中,川薯34的遗传相似性系数变异范围在0.80~1.00,平均遗传相似性系数为0.95,平均Nei's基因多样性指数为0.099 2,Shannon's多样性指数为0.158 9,平均等位基因效应为1.147 9;川紫薯2号的遗传相似性系数变异范围在0.86~1.00,平均遗传相似性系数为0.98,平均Nei's基因多样性指数为0.048 2,Shannon's多样性指数为0.078 5,平均等位基因效应为1.067 0。
2.3 分子标记扫描结果的聚类分析
使用NTSYSpc 2.11软件中的UPGMA聚类方法,将SCoT引物、ISSR引物以及CBDP引物的扫描结果进行聚类分析,构建聚类图。对川紫薯2号及其诱变后代的分析结果表明,当遗传相似度为0.973时,34份参试材料被分别聚到4个类群中,其中,类群Ⅰ包含31份材料,剩余3个类群中分别包含1个材料。当遗传相似度为0.986时,31份材料又可划分为8个亚群,亚群Ⅰ包含24份材料,结果显示,这些诱变材料基本未发生变异;另外7个亚群分别包含1份材料,遗传相似性差异较大,差异明显。原始品种川紫薯2号与23份诱变后代被聚到类群Ⅰ中,另外8份材料被单独区分开,表明在甘薯品种川紫薯2号的悬浮细胞低剂量辐射诱变后代中发生了一定程度的较小变异,但绝大多数未发生变异(图3)。
对川薯34及其辐射诱变后代3种标记扫描结果的分析表明,当遗传相似度为0.97时,34份参试材料被分别聚到5个类群中,其中,类群Ⅰ、类群Ⅲ、类群Ⅳ和类群Ⅴ这4个类群内分别仅包含1份材料;类群Ⅱ包含30份材料,类群Ⅱ在相似度为0.98时,30份材料被分别聚到6个亚群中,其中,有13份材料与对照亲本的遗传相似性达到1.00,被完全聚到一起,此外,cs34-14和cs34-23以及cs34-8和cs34-9这2组(4个材料)虽然均发生了变异,但是它们之间的遗传相似性系数分别达到了1.00,也被完全聚到了一起。本研究结果表明,在川薯34辐射诱变后代中多数个体都发生了不同程度的变异,但整体变异程度较低。但是也有部分诱变后代变异不明显,在分子标记扫描结果中未发现变异位点,在聚类结果中这些个体与亲本被完全聚到了一起(图4)。从聚类图4也可以看出,部分诱变后代虽然发生了变异,但是也被完全聚到了一起,说明在甘薯基因组中可能存在易变位点。
3 结论与讨论
随着近年来生物技术的快速发展,分子标记技术已在生物分子育种、植物遗传指纹图谱构建、文库构建以及生物遗传多样性分析等多个领域得到了广泛的应用,并取得了显著的成效[25-27]。目前,分子标记技术根据技术和方法的不同,其检测技术和检测分辨率差异很大,可以分为三大类:以分子杂交为核心的标记技术,如RFLP技术;以PCR技术为基础的标记技术,如RAPD、AFLP、SSR等分子标记技术[28-29];基于测序技术的新型标记技术,如SNP等标记[30]。南文卓等[31]利用SSR分子标记技术对30份甘薯种质资源进行遗传多样性分析,11对SSR引物可扩增出57条清晰的条带,其中,多态性条带53条,多态性比率93.0%,平均每对引物5.18条。赵丽丽等[32]利用ISSR分子标记技术分析了辐射诱变白刺花M2,结果发现,20条多态性较好的ISSR引物扩增产生141条清晰谱带,多态性条带有75条,多态性比率为53.2%,表明在辐射诱变材料的后代中存在丰富的遗传多样性,为分子标记与辐射诱变技术在育种中的应用提供了参考。翟秀明等[33]和谢向誉等[34]运用SCoT分子标记技术分别对茶树和木薯的生长和突变体进行了分析,证明了SCoT分子标记技术可用于扫描分析植物突变体。
本研究使用SCoT、ISSR和CBDP分子标记技术,对2个甘薯品种及其辐射诱变后代进行了扫描分析,结果表明,SCoT、ISSR和CBDP等3种标记每条引物平均获得条带数最多的是CBDP引物,其次为SCoT引物,ISSR引物获得的条带数最少。SCoT、ISSR和CBDP等3种标记在突变体中获得的多态性片段占扩增总片段数的比例中,在川薯34及其诱变后代中分别为0.11、0.20和0.37;在川紫薯2号及其诱变后代中分别为0.18、0和0.19。说明无论在扩增条带数目上还是在获得的突变体后代的多态性上,目前在甘薯分子研究中使用较少的SCoT分子标记和CBDP分子标记的表现均优于ISSR分子标记,且CBDP分子标记结果最佳。此外,由于SCoT分子标记和CBDP分子标记均属于单引物标记,操作简单,因此,可以将其应用到甘薯分子标记研究中去,丰富甘薯分子标记种类。
本研究通过对2个甘薯品种及其辐射诱变后代的分子标记扫描及聚类分析发现,原始材料及辐射诱变后代之间的遗传相似性较高,而且存在多个与原始材料基本相同的突变后代,其原因可能与本研究的诱变材料是通过低剂量辐射诱变悬浮细胞获得的[33],其基因组变异较小有关。通过对比川薯34及其诱变后代以及川紫薯2号及其诱变后代的聚类结果,发现2个品种的诱变后代在基因组变异方面存在较为明显的区别,川薯34诱变后代的变异率及变异幅度均显著高于川紫薯2号,初步说明悬浮细胞对低剂量辐射诱变产生的变异大小与品种存在一定的关系。在川薯34辐射诱变后代中,有2组分别包含2个诱变材料被完全聚到了一起,可能与川薯34中存在容易发生诱变的位点有关。在今后的研究中,可以根据不同的甘薯品种选择最优的辐射剂量进行诱变。
