酶法制备紫马铃薯汁及其乳酸菌发酵特性
2020-02-18
(广东省农业科学院蚕业与农产品加工研究所/农业部功能食品重点实验室/ 广东省农产品加工重点实验室,广东广州 510610)
紫马铃薯又名紫色土豆、黑马铃薯、黑土豆,属于茄科茄属,薯型长椭圆型,表皮光滑,薯肉颜色独特呈紫黑色,含有蛋白质、脂肪、碳水化合物、有机酸等丰富的营养物质,具有极高的营养价值,紫马铃薯中除了普通马铃薯所含有的丰富的营养物质外,还富含具有增强人体免疫力、延缓衰老、抗氧化活性等生理活性功能的花色苷及多酚类物质[1],因此开发以紫马铃薯为原料的新型健康食品具有一定的实际意义。但目前紫马铃薯以鲜食为主,少数用于加工,综合经济效益较低。为顺应马铃薯主粮化战略,必须大力发展马铃薯制品深加工产业和丰富产品种类,以提高马铃薯经济附加值。
随着经济的发展,具有功能保健性的食品越来越受到青睐,富含多种营养的果蔬汁逐渐成为市场新宠,目前利用紫马铃薯为原料开发紫马铃薯饮料的相关研究已有报道,陈杰华等[2]通过酶法生产紫马铃薯饮料,确定紫马铃薯饮料的最佳酶解工艺条件;张佳丽等[3]通过感官评定法优化紫色马铃薯醋饮料配方,并以离心沉淀率为指标对其稳定剂进行优化,得到最佳工艺;邬婷[4]通过冷冻取汁技术确定紫色马铃薯的最佳处理条件,并在此基础上确定紫色马铃薯饮料配方、澄清及杀菌参数,但以上相关报道主要集中于紫色马铃薯饮料的工艺优化,且工艺较为单一。乳酸菌发酵能赋予果蔬良好的风味,提升果蔬汁的营养价值,紫色马铃薯中丰富的糖类物质可为乳酸菌的生长提供充足的碳源,是乳酸菌生长的良好基质[5]。
因此,本文以紫马铃薯为原料,通过烫漂护色酶法制备富含花色苷的紫马铃薯汁,经乳酸菌发酵后研制一种营养丰富、色泽鲜亮、风味独特的紫马铃薯发酵饮料,旨在为紫马铃薯的产业化深加工提供理论基础。
1 材料与方法
1.1 材料与仪器
紫马铃薯(黑金刚) 购于当地农贸市场,产于山东;乳酸菌种:干酪乳杆菌(Lactobacilluscasei,Lc)、保加利亚乳杆菌(Lactobacillusbulgaricus,Lb)及植物乳杆菌(Lactobacillusplantarum,Lp) 本实验室保存;糖化酶(100000 U/g) 上海阿拉丁生化科技股份有限公司;没食子酸 美国Sigma公司;高温α淀粉酶(20000 U/mL)、Folin-Ciocalteu试剂、果糖、葡萄糖、蔗糖、酒石酸、苹果酸、乙酸、乳酸、草酸和柠檬酸 上海源叶生物科技有限公司;其他试剂 均为国产分析纯。
RFM3400阿贝折光计 英国Bellingham+Stanley公司;PB-10型pH计 赛多利斯公司,HWS24型电热恒温水浴锅 上海一恒科技有限公司;UV-1800型分光光度计 日本岛津公司;UltraScan VIS型全自动色差仪 美国HunterLab公司;立式压力蒸汽灭菌锅 上海博迅实业有限公司医疗设备厂;Agilent 1200 series型高效液相色谱仪 美国安捷伦科技有限公司。
1.2 实验方法
1.2.1 制汁工艺流程 新鲜紫马铃薯→挑选→清洗、去皮→切块→烫漂→打浆→酶解→灭酶→离心→杀菌→冷却→成品
1.2.2 烫漂时间对马铃薯汁出汁率及花色苷含量的影响 取新鲜紫马铃薯清洗去皮切块(约1.5 cm×1 cm×1 cm),分别在沸水中烫漂0、1、2、2.5、3、4 min后,取出后立即用冷水将薯条表面的淀粉和泡沫冲洗干净,沥干,按料液比1∶1加水打浆,分别加入40 U/g高温α-淀粉酶于90 ℃加热60 min,待其冷却至55 ℃后,加入0.2%(200 U/g)的糖化酶水解120 min,灭酶后(沸水浴10 min)过滤离心(1500×g,10 min)取上清液,研究烫漂时间对紫马铃薯汁的出汁率及花色苷含量的影响。
1.2.3 高温α-淀粉酶用量对马铃薯汁出汁率、花色苷及还原糖含量的影响 经1.2.2优化得到的紫马铃薯浆,分别加入不同添加量(0、20、40、60 U/g)的高温α-淀粉酶,于90 ℃加热60 min,待其冷却至55 ℃后,加入0.2%(200 U/g)的糖化酶水解120 min,灭酶后(沸水浴10 min)过滤离心(1500×g,10 min)取上清液,研究高温α-淀粉酶用量对马铃薯汁出汁率、花色苷及还原糖含量的影响。
1.2.4 乳酸菌发酵对紫马铃薯汁理化特性的影响
1.2.4.1 乳酸菌培养物制备 把3种乳酸菌(Lc、Lb及Lp)的保藏培养物分别置于MRS肉汤中进行活化复壮,活化复壮后再在 MRS肉汤(30 ℃,静止发酵)中培养18 h。
1.2.4.2 紫马铃薯汁的乳酸菌发酵培养 经酶解制备的紫马铃薯汁煮沸10 min,置于无菌操作台上,分别在已灭菌的500 mL三角瓶中加入400 mL紫马铃薯汁,每瓶分别接入三种乳酸菌培养物(接种量 6.0lg CFU/mL左右),置于37 ℃培养箱中培养,每隔12 h取样1次,并分别测定相应的理化指标(pH、有机酸、糖组分、花色苷、总酚含量、抗氧化活性)。
1.2.5 测定方法
1.2.5.1 出汁率的测定 出汁率(%)=(汁液总质量-加入水质量)×100/紫马铃薯质量
1.2.5.2 花色苷含量的测定 花色苷含量采用pH示差法测定[6],取紫马铃薯汁,分别加入pH1.0和pH4.5的缓冲液,避光放置15 min,测定510和700 nm处的吸光值。
最终吸光值A=(A510-A700)pH1.0-(A510-A700)pH4.5
花色苷含量(mg/L)=(A×MW×稀释倍数×1000)/(ε×1)
以矢车菊素-3-葡萄糖苷计,其分子量MW为449.2,ε为26900 L/cm,1表示光径为1 cm的比色皿。
1.2.5.3 还原糖含量的测定 还原糖的测定采用3,5-二硝基水杨酸比色法(DNS)[7]。
葡萄糖标准曲线:先将葡萄糖在105 ℃干燥至恒重,用蒸馏水配制0~1 mg/mL 的不同浓度的葡萄标准溶液。取0.5 mL葡萄糖标准溶液于具塞试管中,加入1 mL DNS试剂,混合均匀后沸水浴3 min,冷却至室温测定其在540 nm下的吸光值。
样品的测定:先将酶解制备的紫马铃薯汁用蒸馏水稀释到合适的浓度,取0.5 mL样品于具塞试管中,后续步骤与标准品的测定相同。
1.2.5.4 pH的测定 pH用pH计直接测定。
1.2.5.5 有机酸的测定 参考袁星星等[8]的方法,采用HPLC法测定。色谱柱为Agilent ZORBAX SB-C18(4.6×250 mm)色谱柱;柱温为30 ℃;检测器为二极管阵列检测器;流动相:0.1 mol/L(NH4)2HPO4(磷酸调节pH=2.70);流速为1.0 mL/min;检测波长为210 nm。将样品用0.3%偏磷酸稀释至合适浓度后过膜,进样量为10 μL,并采用外标法(酒石酸、苹果酸、乙酸、乳酸、草酸和柠檬酸为标准品)定量。
1.2.5.6 糖组分测定 糖组分的测定:采用HPLC法测定,包括葡萄糖、蔗糖、果糖。色谱柱为ShodexAsahipak NH2P-50 4E(4.6 mm×250 mm)色谱柱,检测器为蒸发光(ELSD)检测器,柱温40 ℃,漂移管温度为50 ℃,流动相为70%乙腈,流速1 mL/min,取1 mL发酵紫马铃薯汁加3 mL无水乙醇离心取上清液过膜,进样量为10 μL。
1.2.5.7 总酚含量的测定 采用福林酚法测定[9],结果以没食子酸当量计。
1.2.5.8 清除DPPH自由基能力的测定 参考Sokolletowska[10]等,取50 μL 50、100、200、300、400、500 μmol/L Trolox标准溶液或稀释后的样品混合150 μL DPPH溶液共同置于96孔细胞板中,暗处放置30 min后,于517 nm测试吸光强度。结果以Trolox当量计算。
1.3 数据处理
采用SPSS 17.0软件中的ANOVA方法对数据进行差异显著性检验分析,以P<0.05为差异显著,数据以平均值±标准差的形式来表示。
2 结果与分析
2.1 烫漂时间对紫马铃薯汁出汁率、花色苷含量的影响
不同烫漂时间对紫马铃薯汁的出汁率及花色苷含量的影响如图1所示,随着烫漂时间从1 min增加到4 min,紫马铃薯汁的出汁率先增加后减小,其中烫漂2.5 min时出汁率最高为69.53%。而烫漂时间对紫马铃薯汁的花色苷含量影响极为显著,未经烫漂处理得到的紫马铃薯汁的花色苷含量仅为27.72 mg/L,因紫马铃薯极易发生酶促褐变,烫漂后可钝化酶活性,从而抑制营养物质的氧化损失、酶褐变等一系列不良变化[11]。随着烫漂时间的增加,紫马铃薯汁的花色苷含量显著上升后有所下降,烫漂2.5 min时花色苷含量高达213.58 mg/L,比未经烫漂处理的花色苷含量提升了7.7倍,但烫漂时间大于2.5 min时,出汁率和花色苷含量均呈现下降的趋势,可能由于烫漂时间过长引起汁液流失,影响了水分和花色苷的保存。另一方面从实物中也能直观看出色泽的变化,烫漂时间为0和1 min 的马铃薯汁呈深褐色,而其他烫漂时间为2、2.5、3、4 min处理后的马铃薯汁则呈现清亮均一的紫红色,与前者色泽差异明显。综合考虑出汁率、花色苷含量及汁液色泽,2.5 min为紫马铃薯最佳烫漂时间。
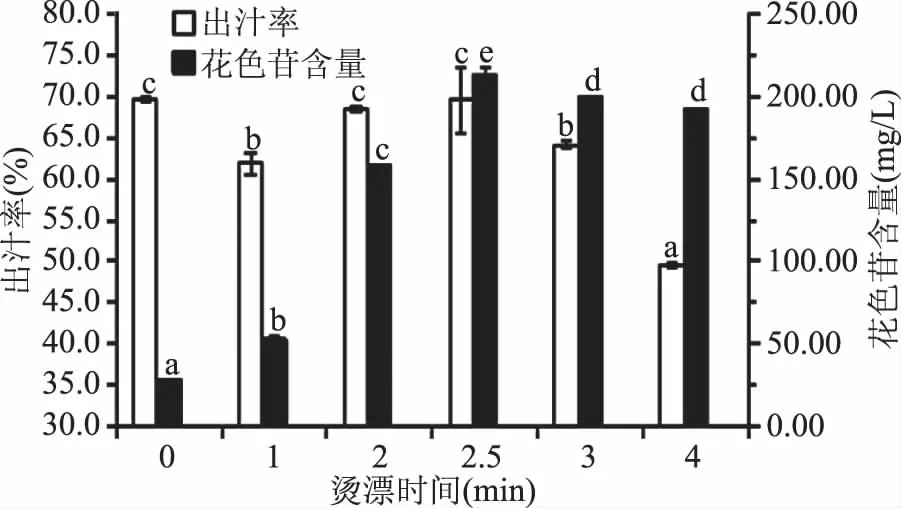
图1 烫漂时间对紫马铃薯汁出汁率、花色苷含量的影响Fig.1 Effects of blanching time on yield and anthocyanin content of purple potato juice注:同一指标不同小写字母表示差异显著(P<0.05)。
2.2 高温α-淀粉酶用量对紫马铃薯汁出汁率、花色苷及还原糖含量的影响
不同高温α-淀粉酶添加量对紫马铃薯汁的出汁率及花色苷含量的影响如表1所示,未添加高温α-淀粉酶,只经过糖化酶水解的马铃薯浆较粘稠,出汁率较低为48.19%±2.36%,花色苷含量也最低,经高温α-淀粉酶先液化再糖化的马铃薯汁出汁率显著增加,花色苷含量亦随之升高,高温α-淀粉酶添加量为20 U/g时,出汁率和花色苷含量均达到最大值分别为69.80%±3.85%和218.25±1.89 mg/L。从还原糖含量变化来看,未添加高温α-淀粉酶,只经过糖化酶水解得到的马铃薯汁还原糖含量与其他组差异显著。在0~20 U/g用量范围内,随着酶用量的增大,马铃薯汁中还原糖含量显著提高;当酶用量大于20 U/g时,继续增大酶用量,还原糖含量变化不显著,说明此时马铃著浆中的淀粉已经基本被水解完全。α-淀粉酶使得淀粉分子内部的α-1,4-糖苷键发生改变,将淀粉水解为糊精、低聚糖和单糖;再加入糖化酶可以进一步水解糊精和多糖[12]。从而充分利用紫马铃薯中大量的淀粉,改善饮料的稳定性和口感,使细胞内的花色苷更完全地释放出来。

表1 高温α-淀粉酶用量 对紫马铃薯汁出汁率、花色苷及还原糖含量的影响Table 1 Effect of high temperature α-amylase dosage on the juice yield,antocyanin and sugar content of purple potato juice
注:同列不同小写字母表示差异显著(P<0.05),表2、表3同。
2.3 不同乳酸菌发酵期间紫马铃薯汁中pH的变化
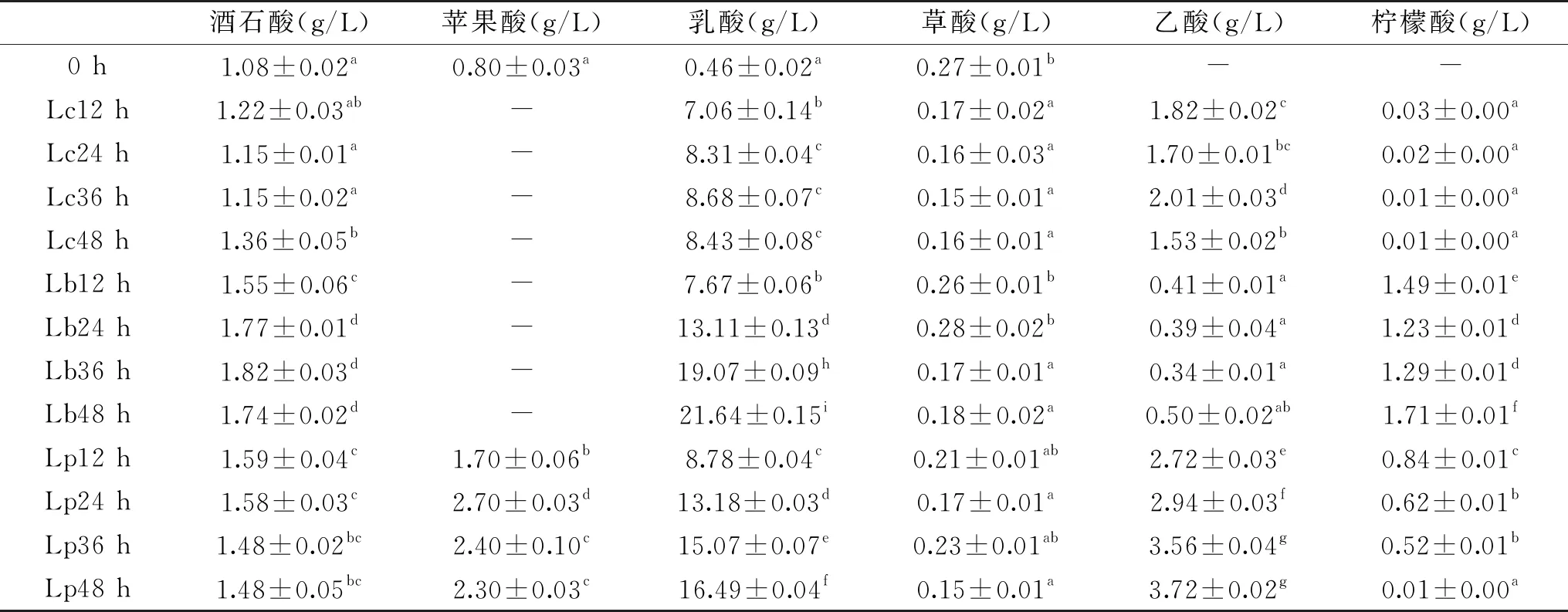
表2 发酵期间紫马铃薯汁中有机酸的变化Table 2 Changes of organic acids in purple potato juice during fermentation
由图2可知,酶法制备的紫马铃薯汁的最初pH约为5.98。在48 h 内,随着发酵时间的延长,3种乳酸菌发酵的紫马铃薯汁的pH均呈下降趋势;其中,0~12 h下降幅度最大,从5.98下降至4.0左右;主要是乳酸菌的快速增殖消耗糖代谢产酸的原因[13];12 h后Lc发酵的紫马铃薯汁的 pH变化不大,而Lb及Lp发酵的紫马铃薯汁的pH仍然缓慢下降,48 h时pH分别下降至3.44和3.67。随着发酵的进行,样品中累积大量有机酸,酸性的样品环境和高浓度的H+,会抑制乳酸菌生长,菌的产酸能力受到影响,发酵后期pH变化不大。

图2 发酵期间紫马铃薯汁中pH的变化Fig.2 Changes of pH value in purple potato juice during fermentation
2.4 不同乳酸菌发酵期间紫马铃薯汁中有机酸的变化
利用HPLC对发酵期间紫马铃薯汁中有机酸进行测定,结果如表2所示。有机酸是果蔬的主要风味营养物质,对发酵果蔬的品质有着重要的影响[14]。紫马铃薯汁中含有酒石酸、苹果酸、乳酸、草酸等有机酸,经乳酸菌发酵后有机酸含量增加,其中乳酸含量变化最显著,发酵48 h后,Lc、Lb及Lp发酵后的乳酸含量分别从0.46 g/L提升至8.43、21.64、16.49 g/L;酒石酸含量亦有显著的增加,经Lc、Lb及Lp发酵后分别从1.08 g/L提升至1.36、1.74、1.48 g/L;苹果酸的变化趋势与乳酸菌的种类有关,经Lc、Lb发酵后苹果酸完全被消耗,可能是由于在乳酸菌苹果乳酸酶的作用下发生脱羧反应生成了乳酸和CO2,使苹果酸含量逐渐减少;但经Lp发酵24 h后苹果酸含量从0.80 g/L增加到2.70 g/L。草酸在发酵期间变化量较小,且三种菌差异不大,可能是微生物发酵未对紫马铃薯汁中的草酸进行转化。乙酸和柠檬酸均为从无到有的积累,发酵后乙酸含量从高到低依次为:Lp>Lc>Lb,发酵后柠檬酸含量从高到低依次为:Lb>Lp>Lc,发酵过程中有机酸含量的增加有利于风味的增加,缩短发酵时间,抑制腐败菌的产生。
2.5 不同乳酸菌发酵期间紫马铃薯汁中糖含量的变化
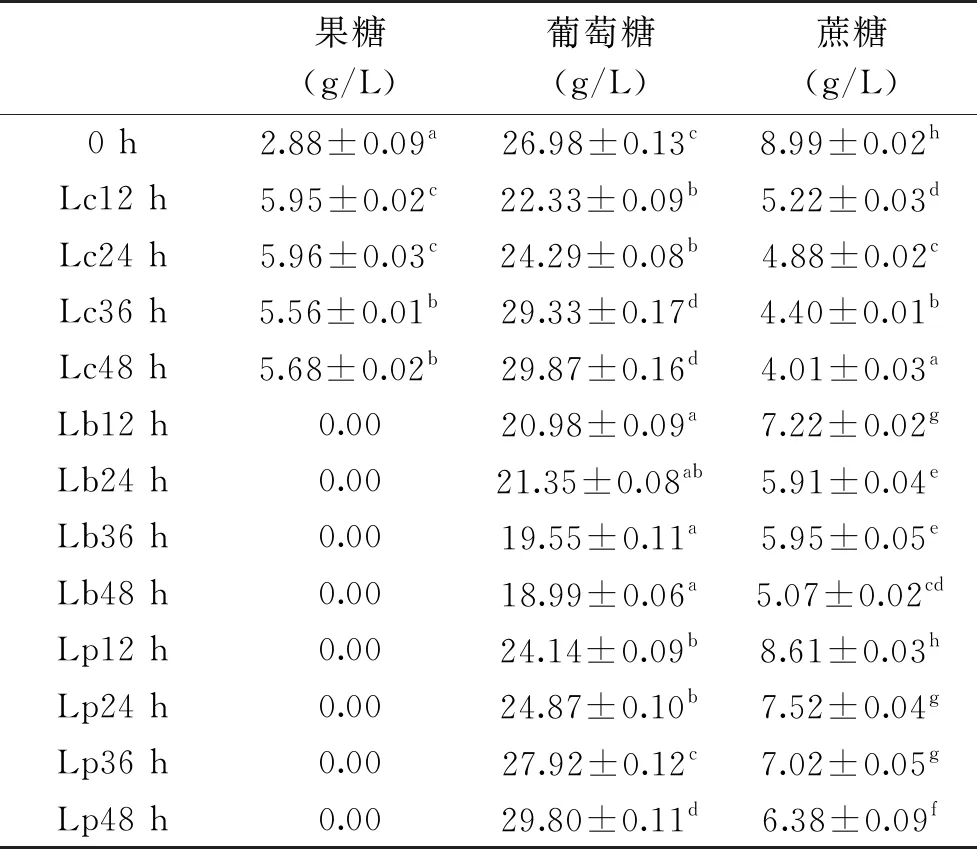
表3 发酵期间紫马铃薯汁中糖组分的变化Table 3 Changes of sugar component in purple potato juice during fermentation
由表3可知,紫马铃薯汁的主要糖组成为葡萄糖(26.98±0.13 g/L)、蔗糖(8.99±0.02 g/L)、果糖(2.88±0.09 g/L)。对于Lc组,发酵48 h时,蔗糖由发酵前的8.99±0.02 g/L显著降低到4.01±0.03 g/L(P<0.05),葡萄糖由26.98±0.13 g/L增加到29.87±0.16 g/L,果糖由2.88±0.09 g/L增加至5.68±0.02 g/L,蔗糖含量的减少可能是在蔗糖酶的作用下被转化为葡萄糖和果糖;葡萄糖和果糖的变化趋势相似,发酵后两种糖含量均稍有升高,可能是由于蔗糖的转化所致;对于Lb组,发酵48 h时,蔗糖由发酵前的8.99±0.02 g/L显著降低到5.07±0.02 g/L(P<0.05),葡萄糖由26.98±0.13 g/L减少到18.99±0.06 g/L,果糖完全被消耗,Lp对糖的利用与Lb相似,这两种菌对糖类的消耗大于Lc,与其产酸能力相对应。减少的糖类主要用于乳酸菌的生长以及参与代谢过程被转化成有机酸等其他物质。
2.6 不同乳酸菌发酵期间紫马铃薯汁中花色苷、总酚含量及抗氧化性(DPPH)的变化
如图3所示,紫马铃薯汁经乳酸菌发酵后花色苷含量均呈下降的趋势,经Lc、Lb及Lp发酵48 h后分别从194.54±3.07 mg/L下降至161.81±1.65、172.50±4.96、168.83±3.07 mg/L,降解率分别为17.82%、11.33%、13.22%。花色苷含量下降可能是由于花色苷稳定性差,在发酵过程中其自身会发生降解,也会受到乳酸菌转化作用的影响。
如图4所示,紫马铃薯汁经乳酸菌发酵后总酚含量均呈略微下降的趋势,经Lc、Lb及Lp发酵后分别从1136.67±33.76 mg/L下降至1065.95±22.93、1048.83±38.22、1063.24±22.63 mg/L,保留率分别为93.78%、92.27%、93.54%。总酚与花色苷含量下降幅度有所差异,且总酚下降程度低于花色苷,表明发酵过程中会有某些酚酸类物质的增加,且发酵期间花色苷、酚酸的合成和降解与乳酸菌种类有关。一些乳酸菌(如Lp)在发酵过程中会产生酚酸脱羧酶,实现酚类物质的相互转化,乳酸菌产生的酚酸脱羧酶,可以把复杂的大分子酚类物质转化成小分子酚类物质,从而使总酚含量增加[15]。

图3 发酵期间紫马铃薯汁中花色苷含量的变化Fig.3 Changes of anthocyanin content in purple potato juice during fermentation
如图5所示,紫马铃薯汁经乳酸菌发酵后抗氧化活性呈先下降后趋于平稳的趋势,经Lc、Lb及Lp发酵48 h后分别从4.09±0.31 μmol TE/mL下降至3.09±0.19、3.10±0.12、2.96±0.25 μmol TE/mL,降解率分别为24.41%、24.23%、27.62%。紫马铃薯汁的抗氧化活性下降的原因可能是花色苷和总酚含量的减少,这与李丰廷等的研究结果一致[16]。

图4 发酵期间紫马铃薯汁中总酚含量的变化Fig.4 Changes of total phenolic content in purple potato juice during fermentation
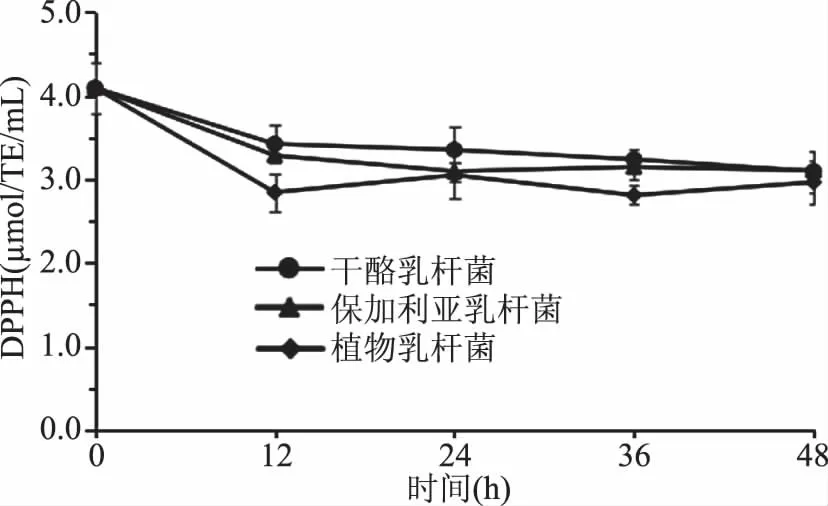
图5 发酵期间紫马铃薯汁的 DPPH自由基清除能力的变化Fig.5 Changes of DPPH· scavenging ability of purple potato juice during fermentation
3 结论
紫马铃薯经烫漂护色2.5 min时出汁率最高。烫漂时间对紫马铃薯汁的花色苷含量影响极为显著,烫漂2.5 min时花色苷含量比未经烫漂处理的提升了7.7倍。经高温α-淀粉酶(20 U/g)、糖化酶(200 U/g)酶解处理后的紫马铃薯汁出汁率为69.80%±3.85%,总酚含量1136.7±33.76 mg/L,花色苷含量为218.25±1.89 mg/L。紫马铃薯汁经乳酸菌发酵过程中pH逐渐下降,并产生大量的乳酸,产酸能力大小依次为Lb>Lp>Lc,蔗糖、葡萄糖和果糖在发酵过程中均作为底物被乳酸菌消耗,用于乳酸菌的生长以及在发酵代谢中转化成其他的有机酸等营养物质,发酵48 h后花色苷、总酚、DPPH·清除能力分别下降了11.33%~17.82%、6.22%~7.73%、24.23%~27.62%。发酵期间花色苷、酚酸的合成和降解与乳酸菌种类有关,抗氧化活性下降与花色苷和总酚含量的减少有关。
