小肠出血损伤对大鼠肠黏膜内跨细胞白蛋白转运的影响
2020-02-15李雪莲王岚杨杰陈晓琴刘琦
李雪莲 王岚 杨杰 陈晓琴 刘琦
(贵州医科大学附属医院消化内科,贵州 贵阳 550004)
胃肠功能紊乱可导致营养吸收障碍,降低机体防御功能〔1,2〕。当肠黏膜发生破坏时,会使机体发生炎症反应及多器官功能失常等〔3〕。临床上,非甾体类抗炎药(NSAIDs)是常用的抗炎药物之一,被广泛用于关节炎、伤寒类、炎症、腰痛和胶原类等疾病的治疗〔4〕。其通过抑制花生四烯酸代谢过程中的环氧化酶来发挥药效,包括抗炎、镇痛及解热等药效〔5〕。但NSAIDs能够诱发胃肠道损伤、溶血、穿孔及肾损害等〔6,7〕。尽管NSAIDs具有十分重要的临床价值,但其不良反应,尤其是对小肠黏膜出血及损伤作用需要被重视〔8〕。白蛋白的跨细胞转运是机体重要的生理功能。首先,可以维持内皮屏障的完整性,使内膜屏障得到增强〔9〕。其次,其具有协同转运的作用,白蛋白会与机体内的多种物质结合,包括与药物的结合,协助物质跨细胞转运〔10〕。白蛋白的跨细胞转运与机体的防御功能有密切关系〔11〕。研究证实,白蛋白与转化生长因子的氨基酸序列十分相似,因此具有重要的生理意义〔12〕。本研究探讨小肠出血损伤对大鼠肠黏膜内跨细胞白蛋白转运的影响,从而为研究NSAIDs肠黏膜损伤的发生机制及其对肠黏膜中白蛋白跨细胞转运的影响提供实验依据。
1 材料与方法
1.1实验材料 40只SD雄性大鼠,体重240~280 g,购自北京维通利华公司。双氯芬酸(商品名:戴芬)购自德国克林格公司;一氧化氮(NO)试剂盒购自南京建成生物工程研究所;牛血清白蛋白购自北京索莱宝生物技术公司;异硫氰酸荧光素购自上海朝晖制药厂。
1.2实验分组及给药 采用随机法分为对照组和模型组,每组20只。每组再随机分为急性期(T1)亚组和亚急性期(T2)亚组,每组10只。对照组以1 ml纯化水灌胃;模型组以7.5 mg/kg双氯芬酸灌胃建立肠黏膜损伤模型。T1亚组灌胃1 d断颈处死;T2亚组灌胃5 d断颈处死。大鼠禁食,不禁水24 h,用1%戊巴比妥钠腹腔内注射麻醉后断颈处死,肉眼观测全小肠黏膜损伤情况并评分。实验结束取下腔静脉血10 ml,2 000 r/min离心10 min后取上清液,-20℃保存,用于后续血液指标的测定;用肝素化生理盐水30 ml(25 kU/L)经肠系膜上动脉冲洗小肠血管,收集小肠黏膜标本用于后续检测。
1.3小肠损伤程度大体评分 依据Reuter评分法对大鼠小肠损伤程度进行大体评分。主要分为溃疡和粘连两种评价标准。粘连:0分为无粘连;1分为粘连较轻;2分为粘连较重。溃疡评分标准:0分为未出现溃疡;1分为小肠局部充血,然而未见溃疡;2分为小肠溃疡不伴充血或肠壁增厚;3分为一个部位出现溃疡与炎症;4分为两个或更多部位有溃疡或炎症;5分为存在小肠穿孔。溃疡评分和粘连评分之和为总分值。
1.4小肠损伤的病理评分 利用Chiu氏评分法对小肠损伤程度进行病理评分。分为5个等级,即0~5分。5分为小肠绒毛脱落,出血和溃疡形成;4分为小肠上皮细胞脱落坏死,部分绒毛脱落,毛细血管充血或扩张;3分为小肠固有层有水肿,小肠黏膜上皮细胞发生坏死,少数小肠绒毛顶端发生脱落;2分表示小肠中度固有层水肿,小肠上皮间隙扩大,中央乳糜管扩张;1分表示小肠毛细血管充血,并伴有绒毛顶端上皮下出现囊状间隙;0分表示小肠黏膜绒毛正常。样本在光学显微镜下观察,每个样本取20个视野。
1.5检测血清NO含量 利用硝酸还原酶法测定NO含量。严格按照试剂盒说明书进行。NO含量(μmol/L)=(测定管的吸光度-空白管的吸光度)/(标准管的吸光度-空白管的吸光度)×标准品的浓度(100 μmol/L)×样本测试前的稀释倍数。
1.6血清白蛋白水平检测 实验结束后,取下腔静脉血10 ml,2 000 r/min离心10 min后取上清液。采用溴酚绿法测定。
1.7测定大鼠小肠血管壁的通透性 取500 mg大鼠小肠空肠组织,加入生理盐水(5 ml/g组织)后匀浆,3 500 r/min离心10 min后取上清液,加入等量饱和硫酸铵混匀,4℃放置12 h,3 500 r/min离心15 min后取上清液测荧光值,据此推算小肠组织荧光白蛋白含量,以此反映小肠血管壁的通透性。
1.8统计学分析 采用SPSS20.0统计软件行LSD-t检验、χ2检验。
2 结 果
2.1实验动物存活情况 对照组中的T1和T2亚组大鼠全部存活;模型组中的T1亚组全部存活,T2亚组在第5天死亡3只。死亡原因为肠道穿孔和腹腔感染。
2.2小肠损伤程度大体评分 模型组小肠大体损伤指数评分明显高于对照组(T1、T2亚组均为0.0分)(P<0.05);与T1模型组(3.0分)相比,T2模型组(5.5分)小肠的损伤情况明显加重(P<0.05),见图1。
2.3小肠损伤程度病理评分 模型组(T1、T2亚组分别为2.5分、5.0分)小肠黏膜损伤病理指数评分显著高于比对照组(T1、T2亚组均为0.0分,P<0.05);T1模型组小肠黏膜见溃疡、糜烂、红斑,局部见肠腔囊样扩张;T2模型组3只大鼠小肠黏膜存在窦道形成、肠穿孔、肠腔狭窄和溃疡。T2模型组小肠黏膜的损伤情况比T1模型组更严重(P<0.05)。
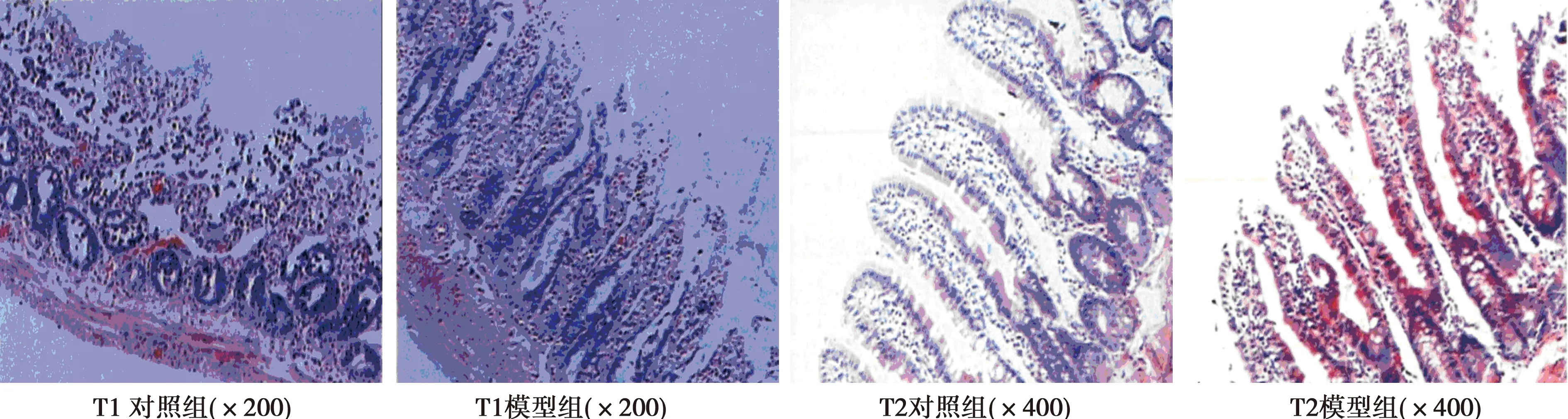
图1 各组小肠损伤程度光学显微镜下观察
2.4各组血清NO和白蛋白含量比较 T1模型组血清NO含量显著低于T1对照组(P<0.05);T2模型组显著高于T1对照组和T1模型组(P<0.05)。T1、T2模型组血清白蛋白含量显著低于T1、T2对照组(P<0.05),与T1模型组相比,T2模型组显著降低(P<0.05),见表1。
表1 各组血清NO、白蛋白含量比较
与T1对照组比较:1)P<0.05;与T1模型组比较:2)P<0.05;与T2对照组比较:3)P<0.05
2.5各组小肠血管壁通透性比较 与T1、T2对照组〔荧光标记白蛋白(0.853±0.091)、(0.826±0.094)μmol/g〕相比,T1、T2模型组通透性〔(1.213±0.114)、(1.563±0.207)μmol/g〕明显增加(P<0.05),与T1模型组相比,T2模型组显著升高(P<0.05)。
3 讨 论
NSAIDs可诱发肠黏膜损伤,其导致的肠道损伤包括黏膜炎症、吸收障碍、黏膜溃疡、腹泻、出血穿孔及肠腔狭窄等〔13〕。肠道黏膜屏障由生物屏障、机械屏障、免疫屏障和化学屏障构成。相互连接紧密的肠黏膜上皮构成肠道黏膜的机械屏障。由肠黏膜上皮细胞分泌的肠腔内正常菌群及消化液、黏液组成。肠道内的分泌型抗体及分布在肠黏膜淋巴组织构成肠道黏膜屏障的免疫屏障。肠内正常菌群对外来菌株的抵抗作用构成了肠道黏膜屏障的生物屏障。本研究结果证实,双氯芬酸会导致小肠黏膜损伤,且随着时间延长,会加重小肠黏膜的损伤程度。由于双氯芬酸是肠溶性药物,主要在肠道被吸收,因此会造成明显的肠道损伤,肠黏膜可见细胞脱落和糜烂,且进一步检测可发现由氧化应激引起的内质网扩张、空肠细胞自噬形成、绒毛减少及线粒体损伤。
NO可以修复胃肠黏膜溃疡,从而保护胃肠道。同时,NO对NSAIDs导致的肠黏膜溃疡也具有保护作用,主要通过抑制肠道运动过强、阻止细菌转移、增加黏液的分泌量来完成。NSAIDs会导致结构性NO合酶活性降低,从而减少NO的生成量,使细胞发生凋亡,延迟了修复的过程〔14〕。研究发现,NO产量过高时,会引起细胞的毒性作用,可以抑制细胞内线粒体的呼吸作用,该过程造成黏膜细胞氧化损伤,最终损伤肠道黏膜〔15〕。本实验结果表明NO参与双氯芬酸诱发的小肠黏膜损伤过程。本研究还发现,在小肠黏膜损伤后,大鼠血清白蛋白的含量也出现下降趋势,血清白蛋白下降的主要原因可能是由于毛细血管通透性的增加,而后期则可能是由于血容量增加和白蛋白合成速率降低的共同作用。同时,在对大鼠注射荧光标记白蛋白后,发现双氯芬酸导致小肠出血损伤后,会使小肠血管壁的通透性增加。
综上所述,双氯芬酸能够诱发急性或亚急性的肠黏膜损伤,导致小肠黏膜出血、糜烂甚至溃疡。并证实NO可能参与肠黏膜的损伤过程,同时小肠出血会导致血清中白蛋白含量降低,使小肠血管壁的通透性增加。
