干细胞标志物Nanog基因检测在肺癌免疫诊断及预后中的意义
2020-02-15郭婧澜谭蓓蓓叶婷刘靳波
郭婧澜 谭蓓蓓 叶婷 刘靳波
(西南医科大学附属医院 1检验科,四川 泸州 646000;2核医学科)
近几年我国在肿瘤干细胞领域上做出许多大的突破,干细胞理论逐渐成熟,引起肿瘤的主要原因是干细胞异常〔1〕。目前研究认为,恶性肿瘤发病时,干细胞取决于肿瘤的发展,其表达分子在基因产物上起重要作用〔2〕。目前对Nanog基因的研究主要集中在诱导细胞及肿瘤研究〔3〕,但对肺癌方面的研究相对较少〔4〕。本文拟分析Nanog基因检测在肺癌免疫诊断及预后中的意义。
1 资料与方法
1.1一般资料 选取西南医科大学附属医院2016年4月至2017年5月收治的肿瘤患者100例,年龄22~76岁,平均(58.43±10.44)岁;男50例,女50例。所有患者进行肺部CT、磁共振成像(MRI)、胸部X线片、纤维支气管镜检查与痰液细胞学检查等确定为肺癌,排除其他疾病。其中肺腺癌组50例,男27例,女23例,年龄22~75〔平均(58.42±10.42)岁〕;40岁以下17例,40~60岁16例,60岁以上17例;Ⅰ期9例,Ⅱ期13例,Ⅲ期11例,Ⅳ期17例;21例出现淋巴结转移。肺鳞癌组50例,男32例,女18例,年龄23~74〔平均(58.53±9.58)〕岁;40岁以下16例,40~60岁17例,60岁以上17例;Ⅰ期10例,Ⅱ期11例,Ⅲ期15例,Ⅳ期14例。两组一般资料差异无统计学意义(P>0.05)。
1.2肿瘤干细胞Nanog基因检测 采用RT-PCR实时定量检测Naong,将两组mRNA使用琼脂糖凝胶电泳进行完整性检测,使用1 μg RNA逆转录基因。具体操作流程:使用20 μl体系加入PrimeScript逆转录酶在42℃下进行逆转录,反应45 min,70℃保温10 min,逆转录酶灭活后在冰上冷却。随后把合成的cDNA -20℃保存备用。以Genebank数据为标准,以BLAST程序进行引物特异性检测,同时选用β-actin为内参考。Nanog正义链:5′-ATGCCTGCATTTTTCATCC-3′;反义链5′-GAGGCAGGTCTTCAGAGGAA-3′,长度189 bp;β-actin正义链:5′-CAGAGCAAGAGAGGCATCC-3′;反义链:5′-CTGGGGTGTTGAAGGTCTC-3′,长度217 bp。PCR在反应管中配备,Naong、2×SYBR Premi×E×Tag 10 μl,cDNA模版2 μl,β-actin上游物引物0.4 μl,然后加入灭菌水,总体积为20 μl。采用临床SYRBGreeenI燃料法针对RealtimePCR进行扩张,操作过程中使用全自动荧光定量PCR仪AB17500 RealTimePCR System,温度58℃,进行39个循环,观察结束后可根据电脑自行操作,并及时记录数据。详细参照β-actin的相关CT值〔5~8〕。
1.3观察指标 比较两组年龄、性别、疾病分期、有无淋巴结转移等,采取实时定量RT PCR反应检测两组癌组织与癌旁组织中Nanog基因表达。并比较不同分化程度各组织中Nanog基因表达量。采用RT-PCR凝胶电泳,检测肺癌干细胞中Nanog基因的表达;采用生存曲线比较两组5年内生存率。采用免疫细胞化学染色对患者肺癌细胞进行染色。
1.4统计学分析 采用SPSS15.0软件进行t检验、χ2检验及非参数检验。
2 结 果
2.1Nanog在肺癌干细胞CD44+细胞中的表达 在肺癌干细胞CD44+细胞中,Nanog表现出高表达状态,见图1。

图1 Nanog在肺癌干细胞CD44+细胞中的表达
2.2癌旁组织与良性病变癌组织中Nanog表达 Nanog蛋白在肺癌中的阳性颗粒主要位于胞质,胞核几乎无表达,其在阳性对照精原细胞瘤中主要表达于胞核,胞质几乎不表达。Nanog蛋白在肺癌中的表达显著高于癌旁正常肺组织和良性病变肺组织。见图2。

图2 Nanog在癌组织、癌旁组织与良性病变肺组织中表达(免疫细胞化学染色,×400)
2.3Nanog基因表达 肺腺癌组癌组织Ⅲ、Ⅳ期Nanog表达显著高于Ⅰ期(t=3.269、5.212)、Ⅱ期(t=3.265、5.231,均P<0.05),癌旁组织Nanog基因表达在Ⅰ、Ⅱ、Ⅲ、Ⅳ期均明显低于癌组织(P<0.05)。肺鳞癌Ⅰ期、Ⅱ期癌组织中较Ⅲ期、Ⅳ期明显降低(P<0.05),癌旁组织Ⅰ~Ⅳ期均明显低于癌组织(P<0.05),见表1。
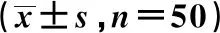
表1 肺鳞癌、 肺腺癌两者在不同时期Nanog基因的表达
与Ⅰ、Ⅱ期比较:1)P<0.05;与同期癌组织比较:2)P<0.05
2.4不同分化状态Nanog检出率比较 肺腺癌组中分化与高分化Nanog检出率〔25.0%(4/16)、37.5%(3/8)〕显著低于未分化与低分化〔88.9%(8/9)、41.1%(7/17),P<0.05〕,肺鳞癌组中分化与高分化〔36.3%(4/11)、28.5%(2/7)〕显著低于未分化与低分化〔57.14%(8/14)、50.0%(9/18),P<0.05〕。
2.5两组生存率比较 Nanog高表达组中位生存率(44%)显著低于低表达组(60%,χ2=4.69,P<0.05)。
3 讨 论
临床研究表明,细胞异质是导致肿瘤发生的主要原因〔8〕,而存在人体的一些特异性细胞是具有一定的自我更新与分化的潜能〔9〕,这类细胞存在人体中具有抗药性与耐药性等〔10〕,表现出了干细胞的一些特性〔11〕。肿瘤干细胞在临床上属于肿瘤细胞中的一种,本身具有更新增殖的能力〔12〕。可间接影响患者身体中的肿瘤生长,因此对肿瘤控制及预防存在重要意义〔13〕。Nanog是胚胎干细胞(ESCs)的表达转录因子,也属于一种原始性生殖细胞,存在于ESCs及生殖干细胞等相关肿瘤细胞中。相关研究表明,存在于人体的癌细胞会无限生长产生低分化性〔14〕,本次实验表明Nanog基因的介入可以有效调节肿瘤患者的人体机制,在治疗过程中Nanog起到了至关重要的作用。Nanog可以直接参与人体修复治疗〔15〕。实验发现Nanog、OCt4除正常保持修复人体干细胞的同时〔16~18〕,还可自行更新、调控,在分化上也起到了相关作用,如数据显示越高,其干细胞在低分化及未分化的能力上表现就越强〔19,20〕。本研究结果说明肺癌组织中含有可以表达Nanog基因的肺癌干细胞。数据检测发现胃癌干细胞(GCSCS)同时具有维持肺癌干细胞的能力,还可进行自我繁殖不断更新活性。研究过程中还发现6例Nanog基因的阳性表达,显示这部分癌旁组织当中有可能含有肺干细胞,当肺上皮细胞进行精原干细胞(GSSCS)转变时,干细胞肿瘤将高于中分化组与高分化组,Oct4、Sox2及Nanog基因都将处于干细胞自我调控状态,分化有关下游基因。本研究在肺腺癌、肺鳞癌与Nanog的基因表达上发现两者相关性一致,人体细胞分化达到最低时,Nanog基因就越强。
