lncRNA BC002811慢病毒载体构建及对胃癌细胞增殖的影响
2020-02-14符伟玉林小聪陈小谊余华军兰柳波
符伟玉,林小聪,陈小谊,余华军,兰柳波
长链非编码 RNA (long non-coding RNA, lncRNA) 是一类不编码蛋白质的内源性RNA 转录本,长度大于200个核苷酸,可在转录及转录后水平调控基因表达,广泛参与细胞增殖、分化、凋亡和衰老等重要的生物学过程[1]。研究[2]表明,lncRNA在胃癌发生、发展、转移、耐药及预后中均具有重要作用,可能成为胃癌诊断标志物及治疗靶点。
通过高通量的lncRNA芯片检测,本研究已经从胃癌组织样本中筛选出多个差异表达的lncRNA分子;lncRNA BC002811在芯片结果中呈明显的表达上调[3]。本研究通过构建BC002811重组慢病毒载体,筛选出BC002811稳定表达的胃癌HGC-27细胞系,并观察BC002811对HGC-27细胞增殖的影响,为进一步探讨BC002811在胃癌中的作用及其分子机制提供有力的支持。
1 材料与方法
1.1 材料BC002811全长基因序列由苏州金唯智生物科技公司合成;pLVX-EGFP-IRES-neo载体,pHelper 1.0及2.0辅助包装质粒购自广州莱德联康生物公司;人胚肾HEK293T细胞和胃癌HGC-27细胞由本实验室保存;DH5α感受态细胞为北京鼎国昌盛生物公司产品;RPMI-1640和DMEM培养基以及胎牛血清均由美国Hyclone公司生产; LipofectamineTM2000、Opti-MEM培养基、TRIzol试剂和qPCR试剂盒购自美国Invitrogen公司;XhoⅠ和NotⅠ限制性核酸内切酶为上海碧云天生物技术公司产品;T4 DNA连接酶由日本TaKaRa公司生产;高纯度质粒小量提取试剂盒及DNA凝胶回收试剂盒为广州东盛生物公司产品;M-MLV逆转录酶和MTS试剂购自美国Promega公司。
1.2 方法
1.2.1BC002811全基因序列的PCR扩增 根据BC002811全基因序列设计含有XhoⅠ和NotⅠ限制性内切酶酶切位点的引物,并进行PCR扩增。正向引物序列:5′-CCGCTCGAGGTGCAATTTCAGCTCAC TGCAAC-3′,反向引物序列:5′-ATAAGAATGCGGCCGCTTTTTTTTTTTTTTTTTTGACTTGATGG-3′。PCR的反应条件为:94 ℃预变性3 min;随后98 ℃变性30 s,58 ℃退火30 s以及68 ℃延伸110 s,重复30个循环;68 ℃最后延伸5 min。扩增片段经琼脂糖凝胶电泳分离并切胶回收。
1.2.2BC002811 重组慢病毒载体的构建及鉴定 使用限制性核酸内切酶XhoⅠ和NotⅠ双酶切BC002811全基因序列的PCR扩增产物以及pLVX-EGFP-IRES-neo载体,经T4 DNA 连接酶16 ℃连接反应2 h。连接产物随后转化DH5α感受态细胞,收集转化后的菌液,接种至LB琼脂培养基(含100 mg/L氨苄青霉素),37 ℃倒置培养16 h。继而,挑选抗性菌落转移至液体LB培养基中进行扩增培养,提取质粒进行酶切鉴定和琼脂糖凝胶电泳检测。最后,将酶切鉴定正确的质粒送测序验证。
1.2.3慢病毒包装、浓缩及滴度测定 将重组慢病毒质粒pLVX-BC002811-EGFP-IRES-neo与pHelper 1.0及pHelper 2.0两种病毒辅助包装质粒经LipofectamineTM2000共转染HEK293T细胞。8 h后,以DMEM完全培养基更换旧的培养基,继续培养48 h。1 000 r/min离心5 min收集病毒上清液,0.45 μm滤器过滤。再经4 ℃、53 125 r/min高速离心和0.22 μm滤器过滤,收集病毒浓缩液,应用倍比稀释法测定病毒的滴度[4]。
1.2.4实时定量PCR (qPCR)检测 TRIzol法抽提细胞总RNA;参照逆转录酶M-MLV说明书合成cDNA;以U6 snRNA为内参照,qPCR检测BC002811的表达水平。BC002811正向引物序列:5′-GATGAGAAAGCCAAGTTCCA-3′,反向引物序列:5′-GGTTGACAATCAGTATGGAC-3′;U6 snRNA正向引物序列:5′-CTCGCTTCGGCAGCACA-3′,反向引物序列:5′-AACGCTTCACGAATTTGCGT-3′。qPCR反应条件为:95 ℃、10 min预变性;95 ℃、10 s变性,60 ℃、60 s退火及延伸,重复40个循环。参照2-△△Ct法计算BC002811相对表达水平。
1.2.5慢病毒感染HGC-27细胞 将HGC-27细胞接种于96孔板,每孔加入2×104个细胞,常规37 ℃、5% CO2培养过夜。以100 μl完全培养基稀释的病毒液更换旧培养基,再加入聚凝胺(终浓度为6 mg/L),混匀后继续常规培养。8 h后,弃旧培养基,加入不含聚凝胺的完全培养基。72 h后,荧光显微镜观察病毒感染效率。1~2周后,可将细胞转至6 cm培养皿继续扩大培养,然后构建BC002811稳定表达的细胞系。
1.2.6稳定表达细胞系的构建 取重组病毒感染的HGC-27细胞,胰酶消化后调整细胞数浓度为(5~6)×104/L,以100 μl细胞悬液/孔接种于96孔板。有限稀释法筛选单个细胞并能表达GFP的阳性孔,然后逐级扩大培养[5]。在此基础上,qPCR检测BC002811表达水平,进一步验证稳定表达细胞系是否构建成功。
1.2.7MTS法检测细胞增殖 取对照组和BC002811组的HGC-27细胞接种于96孔板,每孔接种1×104个细胞,常规培养1、2、3、4、5 d后分别加入10 μl MTS,继续孵育4 h,以酶标仪在490 nm波长处测定吸光度(A490)值。
1.3 统计学处理应用SPSS 16.0统计软件对实验数据进行统计学分析,组间均值比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 PCR扩增目的基因片段以BC002811的全基因序列作为模板,在引物中分别引入XhoⅠ和NotⅠ的酶切位点,进行PCR扩增。琼脂糖凝胶电泳结果显示,其PCR产物的条带位于1 500~2 000 bp(见图1),大小与预期相符,表明已成功获取了BC002811目的基因片段。
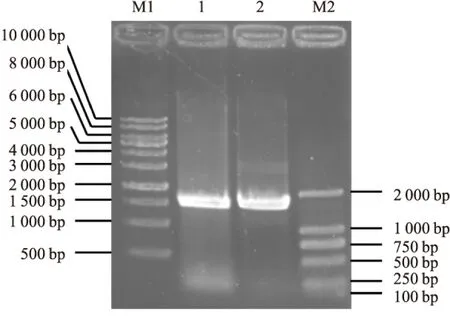
图1 BC002811 PCR扩增产物的琼脂糖凝胶电泳结果
M1:1 kb DNA分子量标准;M2:DL2000 DNA分子量标准;1、2 :BC002811全基因序列的PCR产物
2.2 重组慢病毒质粒的鉴定重组质粒pLVX-BC002811-EGFP-IRES-neo转化大肠杆菌DH5α后,挑取4个阳性克隆分别提取质粒进行XhoⅠ和NotⅠ双酶切鉴定。结果表明,2号和3号质粒酶切后均可观察到一条1 500~2 000 bp的目的条带(见图2),电泳结果与理论值1 686 bp相符,初步鉴定质粒正确。因此,选取2号和3号重组质粒送测序验证。结果显示,重组质粒中插入的目的片段与BC002811基因序列完全一致,无碱基突变以及碱基插入、缺失等异常(见图3),表明BC002811慢病毒表达载体构建成功。
2.3 慢病毒包装及病毒滴度测定HEK293T细胞经慢病毒包装三质粒系统共转染后48 h,荧光显微镜下可观察到细胞发出较强的绿色荧光(见图4),qPCR检测显示BC002811组质粒在HEK293T细胞中的BC002811相对表达水平(1 352.94±84.82)较对照组(1.00±0.05)显著升高(t=27.61,见图5),提示BC002811重组慢病毒质粒可在HEK293T细胞中实现BC002811的高效表达。采用逐孔倍比稀释法测定其病毒滴度为2.2×1011TU/L,表明慢病毒已包装成功。
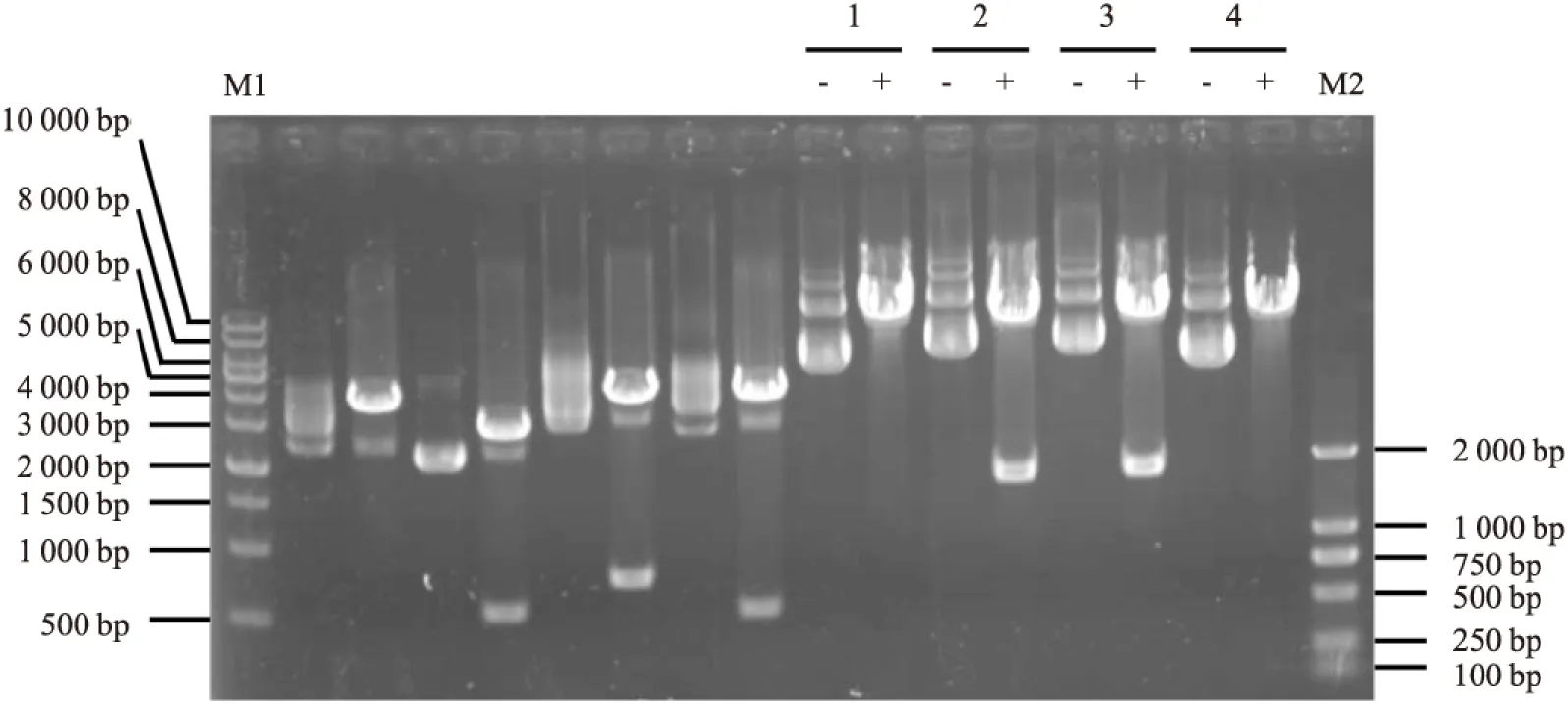
图2 重组质粒的XhoⅠ和NotⅠ双酶切鉴定
M1:1 kb DNA分子量标准;M2:DL2000 DNA分子量标准;1、2、3、4:1号、2 号、3 号、4号阳性克隆菌落提取的重组质粒;-:酶切前的质粒;+:质粒经XhoⅠ和NotⅠ双酶切后的产物
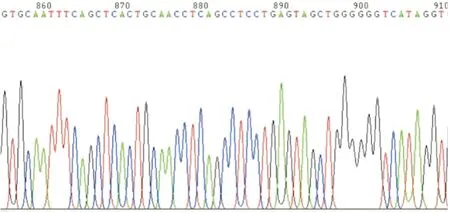
图3 重组慢病毒质粒中BC002811插入片段的部分测序图谱
2.4 建立稳定表达BC002811的HGC-27胃癌细胞系经有限稀释法筛选,本项目组得到了稳定表达BC002811的单克隆HGC-27细胞系。该细胞系与未经处理的正常HGC-27细胞在形态学上无明显的差异,且能稳定表达绿色荧光(见图6)。qPCR结果表明,BC002811组细胞的BC002811相对表达水平(49.78±4.55)较对照组(1.00±0.07)明显上调(t=18.57,见图7),提示稳定表达BC002811的HGC-27胃癌细胞系构建成功。
2.5 稳定表达BC002811对HGC-27细胞增殖的影响由图8可见,1、2、3、4、5 d,对照组细胞所测定的A490值分别为(0.58±0.02)、(0.90±0.02)、(1.35±0.15)、(1.81±0.13)、(2.12±0.17),而BC002811组细胞的A490值分别为(0.66±0.02)、(1.11±0.11)、(1.79±0.14)、(2.54±0.29)、(3.02±0.32),BC002811组细胞的A490值均高于对照组(P<0.05),即上调BC002811表达可提高HGC-27细胞的增殖能力。
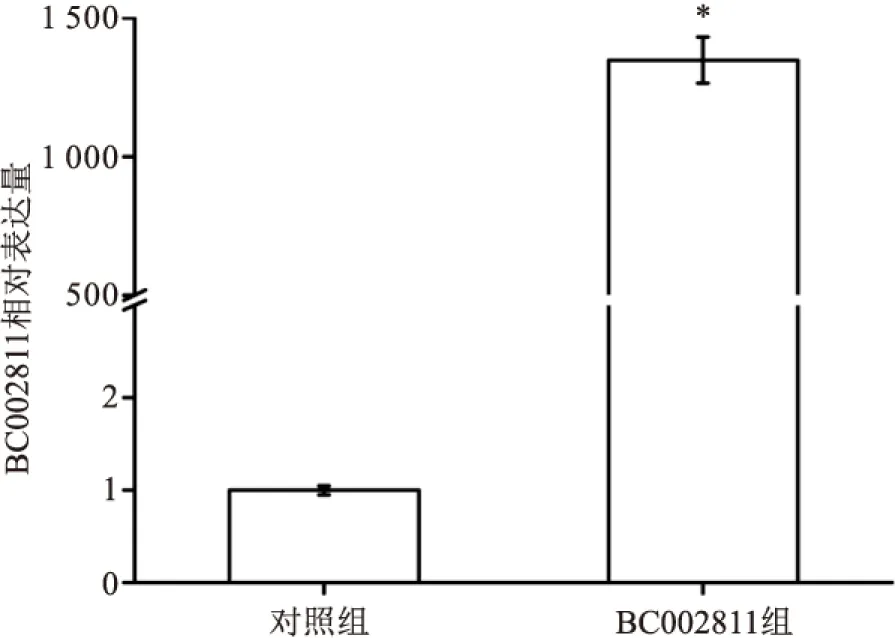
图5 qPCR检测HEK293T细胞中BC002811的表达水平
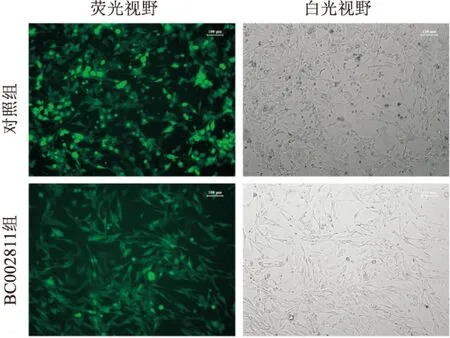
图6 荧光显微镜下观察稳定表达BC002811的HGC-27胃癌细胞系 ×100
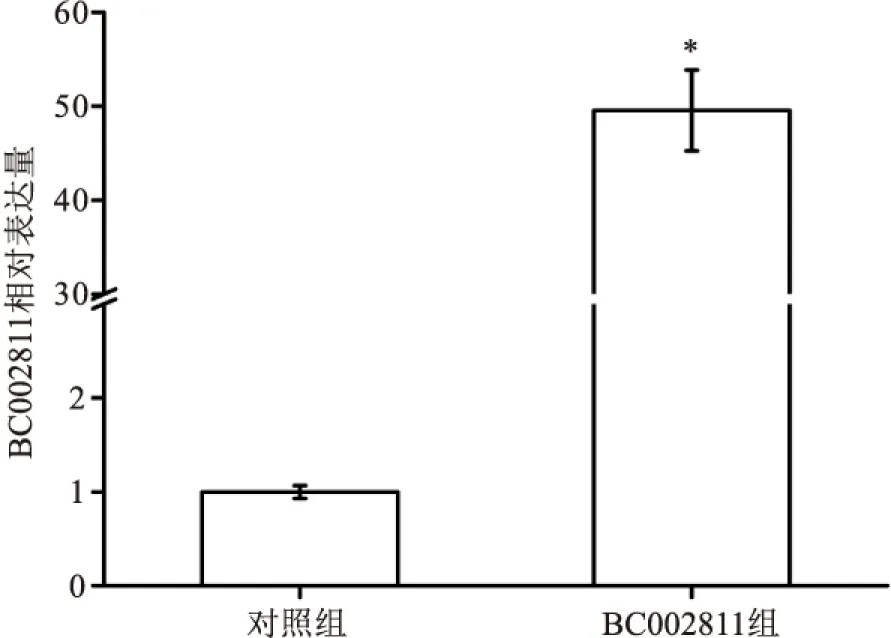
图7 qPCR检测胃癌HGC-27稳定表达细胞系中BC002811的表达水平
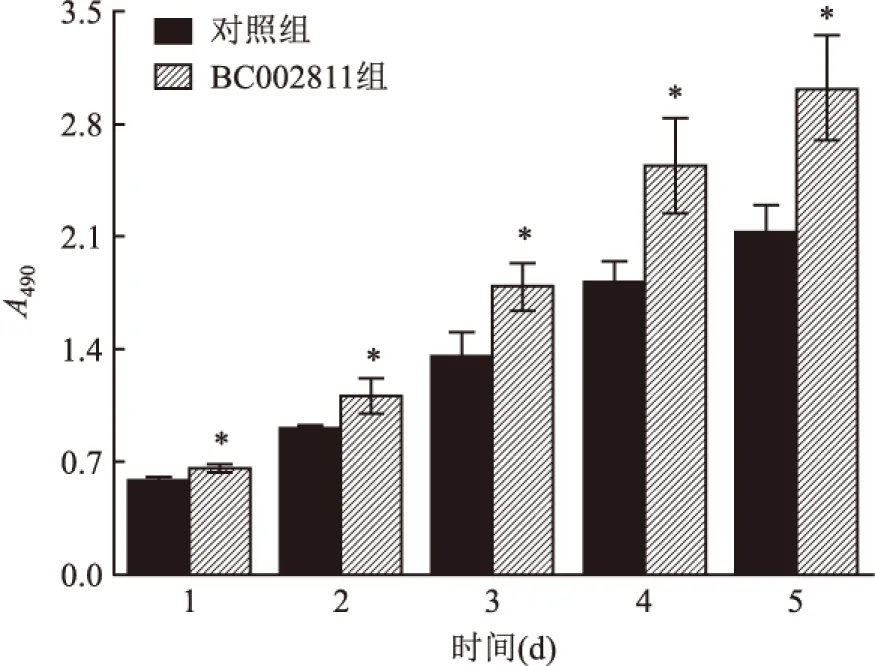
图8 MTS法检测稳定表达BC002811对HGC-27细胞增殖的影响
3 讨论
作为一种在非编码RNA转录本中片段长度最大的RNA分子,lncRNA具有基因表达调控的功能。与miRNA 相比,lncRNA的序列更长,携带的遗传信息更为丰富,核苷酸分子通过折叠形成更为复杂的空间结构,可提供较大的空间位置与DNA、mRNA、miRNA以及蛋白质等多种分子结合,故其分子调控机制也更加多样化[6]。lncRNA与胃癌关系密切,在胃癌患者组织以及血浆标本中均发现lncRNA的表达失调[2]。H19、HOTAIR、LINC00152、GAS5、MEG3等多种lncRNA具有致癌或抑癌活性,在胃癌发生、发展过程均具有重要作用[2,6]。但目前对于lncRNA在胃癌中的作用及其分子机制的研究还比较少。由于基因组中lncRNA的数量庞大、调控方式多样,因此绝大多数与胃癌相关的lncRNA其功能和作用机制仍不清楚,有待进一步研究。既往本项目组应用lncRNA芯片技术对胃癌患者的lncRNA表达谱进行了探讨,发现lncRNA BC002811在胃癌组织中呈明显的表达上调[3]。BC002811是一种片段长度为1 686 bp的lncRNA,其基因在染色体上定位于17q25.1。近来的研究表明,BC002811表达水平与胃癌淋巴结转移及微血管密度呈正相关[7]。但目前尚无相关研究报道慢病毒所介导的BC002811过表达效应及其对胃癌细胞生物学行为的影响。
慢病毒是在人类免疫缺陷Ⅰ型(HIV-Ⅰ)病毒基础上改造而成的一类病毒载体,属于逆转录病毒科;其可将自身的病毒RNA通过逆转录转变为DNA ,然后整合到宿主细胞染色体,从而实现目的基因在宿主细胞内长期而稳定地表达[8]。与质粒以及腺病毒等其他病毒载体相比,慢病毒可感染分裂期及非分裂期细胞,具有感染效率高、转移基因片段容量大(可容纳10 kb左右的外源基因)、免疫原性弱和细胞毒性低等诸多优点,是携带目的基因的理想载体[9]。为此,本研究选用慢病毒作为载体来携带BC002811基因,以实现BC002811在胃癌细胞内持续稳定地表达。HGC-27细胞来源于未分化胃腺癌组织,可分泌黏液素,恶性程度高,具有较强的体外增殖活性以及高侵袭、高转移能力,是研究胃癌很好的细胞模型[10]。因此,本项目组选择HGC-27细胞作为慢病毒感染的受体细胞来筛选稳定表达BC002811的细胞系。
最近,本项目组的研究发现,通过慢病毒所介导的BC002811 shRNA载体靶向干扰BC002811表达,可抑制胃癌SGC-7901细胞增殖;提示BC002811具有潜在的促进胃癌细胞增殖的功能[11]。为了验证这一结果,本项目组应用慢病毒所介导的基因过表达技术在另一胃癌细胞系HGC-27中观察了BC002811对细胞增殖的影响。结果表明,BC002811过表达可提高HGC-27细胞的增殖活性,与上述研究结果相符。
综上,本研究成功构建了BC002811的重组慢病毒载体,并建立了BC002811稳定表达的HGC-27胃癌细胞系。BC002811过表达后, HGC-27细胞的增殖能力增强。因此,本研究为后续进一步探讨BC002811在胃癌中的生物学功能及其作用机制奠定了基础。
