TET1过表达对宫颈癌细胞增殖迁移能力的影响
2020-02-14周君阳陈秀英罗心霞黄宽明朱名安
周君阳,于 莉,陈秀英,成 健,罗心霞,王 珏,黄宽明,朱名安,丁 妍
宫颈癌在女性中高发,是常见的妇科恶性肿瘤之一,严重威胁着女性的生命健康[1]。早期研究认为人类乳头状瘤病毒(human papilloma virus, HPV)感染是宫颈癌的主要致病因素之一,近年来,多项研究表明,宫颈癌细胞表观遗传学的改变是影响其发生及演进的重要因素[2]。
TET1作为体内一种加氧酶,具有高效催化5-甲基胞嘧啶(5-mC)转化为5-羟甲基胞嘧啶(5-hmC)的作用[3]。TET1在多种恶性肿瘤组织中低表达,如前列腺癌、肺癌、膀胱癌、肝癌,具有明显的去甲基化作用[4]。研究[5]表明,TET1的表达水平与肿瘤的侵袭和转移密切相关,而且TET1表达水平的下调可以活化致癌基因,促进肿瘤细胞增殖,促进肿瘤发生和转移。该研究拟通过构建TET1过表达HeLa细胞,通过细胞增殖试验、划痕试验、Transwell试验检测其增殖、侵袭、迁移等能力的变化,探究TET1过表达对宫颈癌细胞生物学行为的影响。
1 材料与方法
1.1 材料
1.1.1质粒 p57TALE-VP64过表达质粒购于上海泰冷生物技术有限公司。
1.1.2细胞 选用人宫颈癌细胞系HeLa细胞系(胚胎干细胞研究湖北省重点实验室保存)。
1.1.3主要试剂 DMEM高糖培养基(美国Gibco,11965-092)、胎牛血清(美国,Gibco公司,10099-141);Lipo3000转染试剂(美国Thermo Fisher公司,L3000001);Transwell小室(美国Corning公司,3422);TET1抗体(美国Aviva Systems Biology公司,OAAB19195);小鼠抗人GAPDH抗体(AF0006)、辣根过氧化物酶标记山羊抗小鼠IgG(H+L)(A0216)、四唑盐 (thiazolyl blue tetrazolium bromide,MTT)细胞增殖及细胞毒性检测试剂盒、BeyoECL Star (特超敏ECL化学发光试剂盒,P0018AS,上海碧云天生物技术公司)。
1.2 方法
1.2.1细胞培养 HeLa细胞置于5% CO2、37 ℃恒温培养箱中培养,完全培养基配制:90% DMEM培养基+10%胎牛血清(fetal bovine serum,FBS)。
1.2.2TET1过表达质粒构建 根据转录激活样效应因子(transcription activator-like effectors, TALE)设计原则,选取TET1启动子区不同区域设计6条TALE臂,根据TALE臂碱基序列,将相应的模块与骨架载体进行连接,转化后挑取菌落培养,提取质粒,选出序列正确的质粒进行后续细胞转染。
1.2.3细胞转染 选取生长状态良好的HeLa细胞,计数后接种至6孔板内,调节细胞密度至1×105/ml,培养过夜。次日进行转染,取2支灭菌的1.5 ml离心管,1管加入TALE-VP64-TET1质粒2 μg,优化培养基(opti-minima essential medium, Opti-MEM) 50 μl,轻轻吹打混匀;另1管加入2 μl Lipo-fectamine 3000和50 μl Opti-MEM培养基,轻轻吹打混匀,室温孵育5 min。将两管液体混合,室温下温育5 min,最后将转染复合物均匀滴加到待转染的细胞培养板中。转染24 h后,用嘌呤霉素筛选稳转株,待细胞长到一定密度后检测过表达效率。
1.2.4细胞增殖试验 取野生型和过表达型HeLa细胞,接种至96孔板内,每孔200 μl完全培养基,细胞密度1×104/ml,每组5个重复,置于37 ℃恒温培养箱内培养。于培养第1、3、5、7天进行MTT检测。
1.2.5划痕试验 取野生型和过表达型HeLa细胞,计数后调整细胞密度至0.5×106/ml,接种至12孔板内,37 ℃培养箱内恒温培养。划痕前1天晚上将培养液换为DMEM无血清培养基培养。次日用小枪头在培养皿底划出水平划痕,用PBS洗去多余的细胞,继续用DMEM无血清培养基培养细胞。分别在划后0、24、48 h拍照记录。
1.2.6Transwell试验 将DMEM基础培养基和Matrigel胶按5 ∶1的比例稀释,以50 μl/孔的浓度均匀铺在Transwell小室上室内,37 ℃静置2 h,使Matrigel胶凝固。取不同TET1基因型HeLa细胞,计数后调整细胞密度到1×106/ml。向上室加入100 μl/孔细胞悬液,下室内每孔加入500 μl/孔DMEM完全培养基。培养48 h后取出小室,加入4%多聚甲醛室温固定30 min,PBS充分水洗,1%结晶紫染液室温染色15 min,PBS充分水洗,擦去上室中的Matrigel胶及细胞,显微镜下观察拍照。
1.2.7Western blot 提取不同组别HeLa细胞总蛋白,进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis, SDS-PAGE)电泳。15 V恒压转膜1 h,5%脱脂奶粉室温封闭1 h,加入一抗(TET1,稀释度1 ∶500;GAPDH,稀释度1 ∶1 000),4 ℃摇床过夜,洗涤缓冲液 (tris buffered saline tween, TBST) 洗膜后,加入辣根过氧化物酶标记山羊抗小鼠二抗,室温孵育1 h,TBST洗膜后显影。
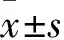
2 结果
2.1 TET1过表达质粒的构建和鉴定因为TET1的 CDS序列比较长,常规的克隆方法存在困难,采用TALE特异性识别并结合靶基因的启动子,再与VP64增强子结合,从而增强靶基因的表达(图1A)。本研究中,针对TET1启动子区域,共选择了6个靶位点。将构建成功并测序正确的质粒转染293细胞,通过效率检测最终确定2号(TALE靶序列为转录起始位点上游-231至-216)质粒用于后续实验。将2号质粒转染HeLa细胞后,嘌呤霉素筛选10 d,最后采用反转录·聚合酶链反应 (reverse transcription-polymerase chain reaction, RT-PCR)及Western blot检测TET1过表达效率,发现有2个克隆(Clone 1、Clone 2)稳定的过表达TET1(图1B),并将这2个克隆用于后续实验。
2.2 TET1过表达对HeLa细胞增殖能力的影响为了检测TET1过表达对HeLa细胞增殖能力的影响,本研究采用MTT检测HeLa细胞增殖状况。连续监测7 d后,得到3组细胞的增殖曲线(图2),TET1过表达的Clone 1和Clone 2细胞增殖能力明显弱于野生型HeLa细胞(tday 5=2.6,tday 7=3.03,P<0.05)。
2.3 TET1过表达HeLa细胞侵袭能力的影响对过表达TET1的HeLa细胞,采用Transwell侵袭试验检测其侵袭能力的变化情况。如图3所示,Transwell小室培养48 h后, Clone 1及Clone 2穿过magtrigel胶及小室的细胞分别是(21±5)和(22±6)个/视野,而野生型细胞组为(38±7)个/视野,与野生型细胞组比较,差异有统计学意义(P<0.05,t值分别为4.42和3.88)。 结果显示,过表达TET1明显降低了HeLa细胞的侵袭能力。
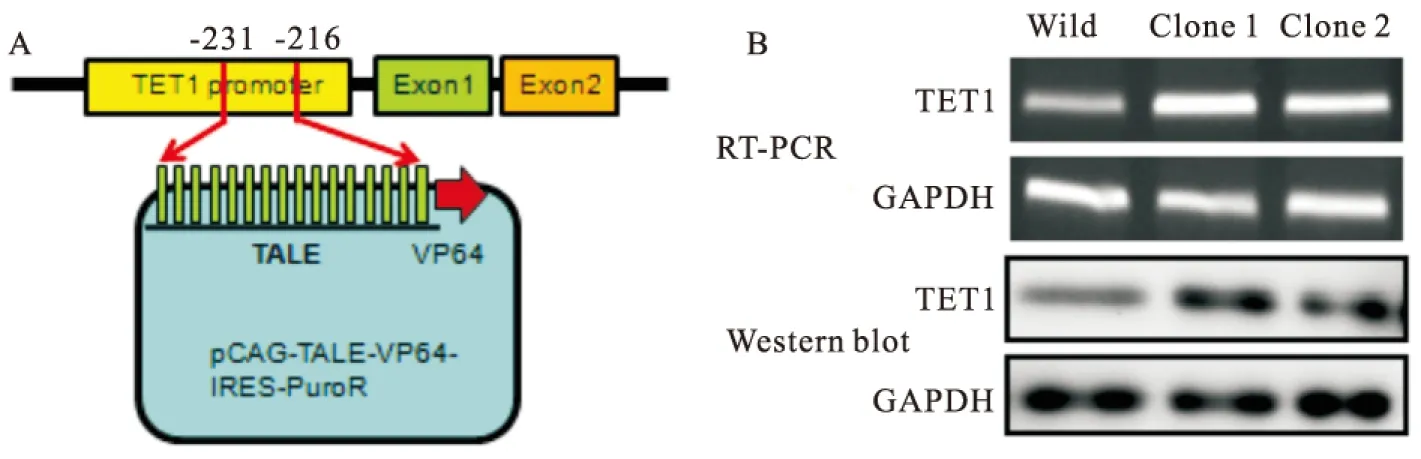
图1 TET1 过表达质粒构建和鉴定
A: TET1 过表达质粒构建示意图;B: RT-PCR及Western blot检测TET1过表达质粒鉴定;Clone 1和Clone 2:分别为TET1过表达HeLa细胞克隆1和克隆2;Wild:野生型HeLa细胞
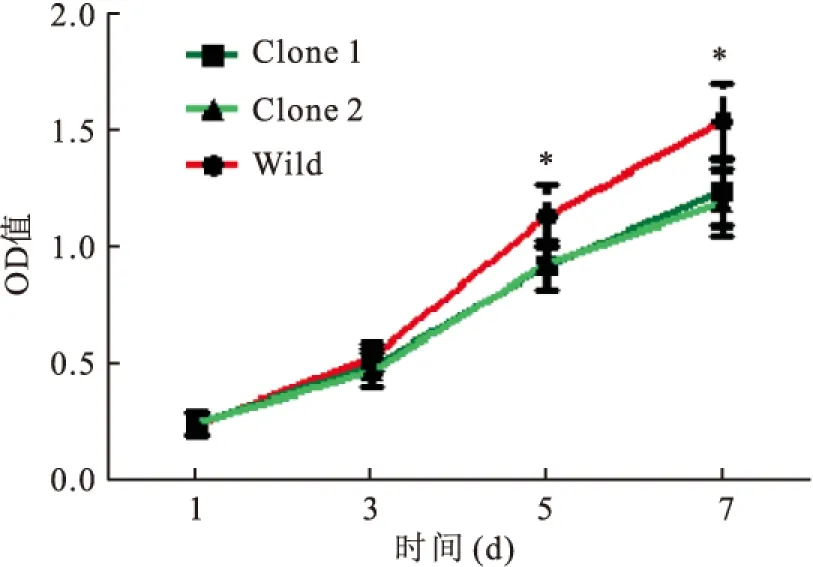
图2 TET1过表达对HeLa细胞增殖能力的影响
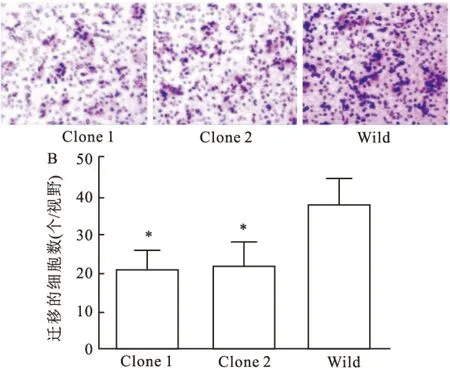
图3 TET1过表达对HeLa细胞侵袭能力的影响
A: TET1过表达对HeLa细胞侵袭能力的影响 ×10;B: 柱状图分析不同组别迁移的细胞数;与Wild细胞比较:*P<0.05
2.4 TET1过表达对HeLa细胞迁移能力的影响划痕试验是判断细胞迁移能力的经典试验。本研究采用划痕试验检测TET1过表达对HeLa细胞迁移能力的影响。结果表明,TET1过表达组(Clone 1、Clone 2)细胞24 h及48 h的迁移率分别为(17.48±3.12)%、(18.23±3.57)%及(51.68±6.35)%、(53.25±7.16)%,而野生型HeLa组细胞24 h及48 h的迁移率分别为(29.68±4.63)%及(75.83±8.42)%,后者明显高于前者(P<0.01, 24 ht值分别为2.75、2.68, 48 ht值分别为4.25、3.78),见图4。
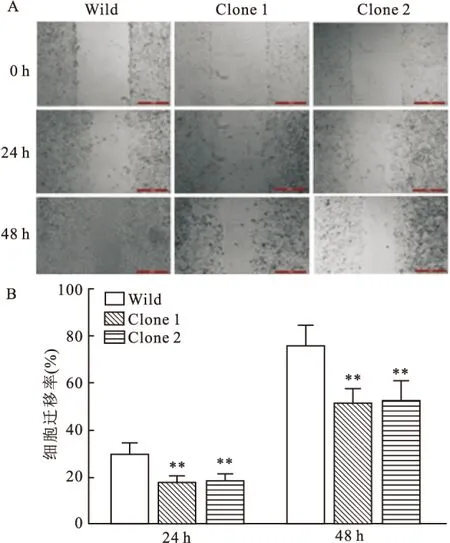
图4 TET1过表达对HeLa细胞迁移能力的影响
A: 划痕试验检测24 h及48 h迁移状况图 ×10;B:不同组HeLa细胞24 h及48 h迁移率柱状统计图;与Wild细胞比较:**P<0.01
3 讨论
TET1是TET家族最重要的成员之一,属于含有α-酮戊二酸及Fe2+的双加氧酶[6]。TET1能够催化5-mC转化为5-hmC,进而转化为5-甲酰胞嘧啶和5-羧基胞嘧啶,从而实现DNA去甲基化,发挥生物学效应[7]。许多肿瘤中存在自噬相关调节基因的甲基化异常现象,TET1作为一种新的去甲基化转录因子,在多种疾病具有重要的调控作用。研究发现TET1具有抑癌作用[8],在肺癌[9]、结肠癌[10]、乳腺癌[11]组织中,TET1表达明显减少。多项成瘤实验表明,如果TET1低水平表达,那么肿瘤细胞侵袭性增强,生长速度加快,癌细胞更易转移;若TET1过表达,肿瘤细胞的侵袭性明显降低,异种移植瘤的生长受到抑制。最新的研究发现,TET1可以通过促进Wnt通路拮抗剂肿瘤抑制因子β-连环蛋白抑制基因2和分泌型卷曲相关蛋白2的DNA去甲基化,抑制Wnt/catenin信号通路,在鼻咽癌中发挥抗肿瘤能力[12];还可以通过抑制分泌性蛋白Dikkopf-1及SFRP2从而抑制卵巢癌细胞上皮间质转化[13]。综上,TET1的低水平表达与肿瘤的侵袭、转移密切相关。对TET1与宫颈癌细胞生物学行为的影响的研究,必将对宫颈癌的早期诊断、预后及治疗具有重要意义。
TALE是一种具有高度特异性的调节基因。由多个串联的氨基酸重复序列构成DNA结合域,一个重复序列通常可以识别一个特定碱基。根据靶基因特异的碱基序列,将相应的功能模块连接在一起,构成识别该特异核酸序列的TALE蛋白分子。TALE蛋白分子具有很高的特异性,因为即便有2个碱基错配,也不能被TALE识别。在分子生物学领域中,如果将特异的DNA结合域与蛋白的功能结构域(比如核酸酶、增强子等)连接后导入细胞,就可以影响细胞相应基因的表达[14]。
前期研究[15]表明,TET1基因敲除的宫颈癌HeLa细胞增殖能力、侵袭能力增强,TET1基因敲除能增加宫颈癌HeLa细胞的恶性行为。为探讨TET1基因过表达的HeLa细胞生物学行为的影响,本研究采用TALE-VP64系统构建TET1过表达质粒,再将其转染人HeLa细胞,得到了2个TET1过表达的单克隆HeLa细胞。分别用MTT法、Transwell侵袭试验、划痕试验检测不同组别HeLa细胞增殖、迁移及侵袭能力的变化情况。与野生型HeLa细胞相比,TET1基因过表达的HeLa细胞的增殖、侵袭、迁移能力明显降低。本研究表明TET1基因过表达对宫颈癌HeLa细胞有抑癌基因的作用,这一结果与TET1基因在其他肿瘤疾病中的作用类似,将为治疗宫颈癌提供新的作用靶点。
本研究结果与前期研究结果相互印证,证明了TET1基因对HeLa细胞增殖、侵袭、迁移等生物学行为具有重要的调控作用,为研究 TET1 的作用机制及宫颈癌的靶向治疗提供了理论基础,但具体的分子机制需要进一步研究。后续研究将会探讨TET1基因调控宫颈癌恶性行为的具体机制,以期为临床治疗宫颈癌提供新的治疗方案。
