PI3K/Akt信号通路参与LPS诱导大鼠肺微血管内皮细胞表达RACK1及rac1
2020-02-14尤青海王巾枚孙耕耘蒋丽娟李文妹
尤青海,王巾枚,孙耕耘,蒋丽娟,李文妹
肺微血管内皮细胞(pulmonary microvascular endothelial cells, PMVEC)损伤致弥漫性肺间质及肺泡水肿是急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)病理学特征,多种信号通路参与调控[1]。磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)/丝氨酸-苏氨酸蛋白激酶(protein kinase B, Akt)信号通路通过调控炎症细胞活化和炎症介质释放参与脂多糖(lipopolysaccharide, LPS)介导的细胞损伤过程,但机制尚不明确[2];活化的蛋白激酶C受体1(receptor for activated C kinase 1, RACK1)是细胞支架蛋白,与多种蛋白结合,整合来自不同信号途径的信息[3];ras 相关C3 肉毒菌毒物底物1 (ras-related C3 botulinum toxin substrate 1, rac1)作为小G蛋白成员参与内皮细胞屏障功能调控[4]。研究[5]发现Akt调控rac1活化,而RACK1与rac1活化关系密切,因此,推测PI3K/Akt信号通路可能通过调控RACK1/rac1参与LPS致PMVEC损伤。
1 材料与方法
1.1 试剂与仪器DMEM培养基(美国,Hyclone公司),胎牛血清(澳大利亚,Gibco公司),p-Akt单克隆抗体、RACK1单克隆抗体及rac1单克隆抗体(英国,Abcom公司)、辣根过氧化物酶标记的羊抗兔IgG(北京,中杉金桥),LY294002(PI3K/Akt信号通路特异抑制剂,美国,Selleck公司),IGF-1(PI3K/Akt信号通路特异激动剂,美国,CST公司),其余实验试剂均为国产分析纯,SD大鼠购自安徽医科大学动物实验中心[SPF级,合格证号:SCXK(皖)2011-002]。
1.2 方法
1.2.1大鼠PMVEC分离培养及鉴定 按照本实验室建立的方法及参考文献进行[6]。
1.2.2Western blot检测RACK1、rac1及p-Akt蛋白表达 裂解3代大鼠PMVEC 30 min后收集蛋白。选择10%分离胶和5%浓缩胶进行电泳,蛋白转移至PVDF膜上,封闭液中室温封闭2 h后,TBS-T溶液洗膜,与RACK1、rac1或p-Akt单克隆抗体(1 ∶1 000)4 ℃过夜,辣根过氧化物酶标记的山羊抗兔IgG溶液(1 ∶20 000)室温90 min孵育,底物化学发光法显影,扫描仪扫描存盘,Quantity One软件分析、测定各组目的蛋白与同一样本中的内参β-actin(武汉博士德生物工程有限公司)积分光密度,比值衡量蛋白表达量的相对变化。
1.2.3实验分组和处理 (1)量效实验:分别以0、1、5、10 mg/L LPS与PMVEC孵育12 h;(2)时效实验:以10 mg/L LPS或100 ng/ml IGF-1分别与PMVEC孵育0、3、6、8、12、24 h;(3)LPS+LY294002干预组:以100 ng/ml LY294002孵育1 h后继续加入10 mg/L LPS预孵育12 h,设空白组、LPS组和LY294002组为对照。干预结束后均检测RACK1、rac1及p-Akt蛋白表达。
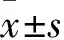
2 结果
2.1 不同浓度LPS诱导大鼠PMVEC表达RACK1、rac1及p-AktPMVEC低表达RACK1和rac1,0、1、5、10 mg/L LPS刺激上调rac1表达(F=165.813,P<0.001);0、1、5、10 mg/L LPS刺激后,RACK1表达上调,各组间比较差异有统计学意义(F=120.455,P<0.001)。LPS未刺激时,PMVEC低表达p-Akt,0、1、5、10 mg/L LPS诱导p-Akt表达增加,各组间比较差异有统计学意义(F=309.346,P<0.001)。见图1、表1。
2.2 LPS刺激不同时间诱导大鼠PMVEC表达rac1、RACK1及p-Akt10 mg/L LPS刺激3 h后rac1表达增加,24 h达最高,组间差异有统计学意义(F=423.630,P<0.001);10 mg/L LPS刺激3 h后,RACK1表达上调,组间差异有统计学意义(F=454.034,P<0.001);10 mg/L LPS刺激3 h后,p-Akt表达上调,12 h达最高,24 h开始降低,组间差异有统计学意义(F=137.726,P<0.001)。见图2、表2。
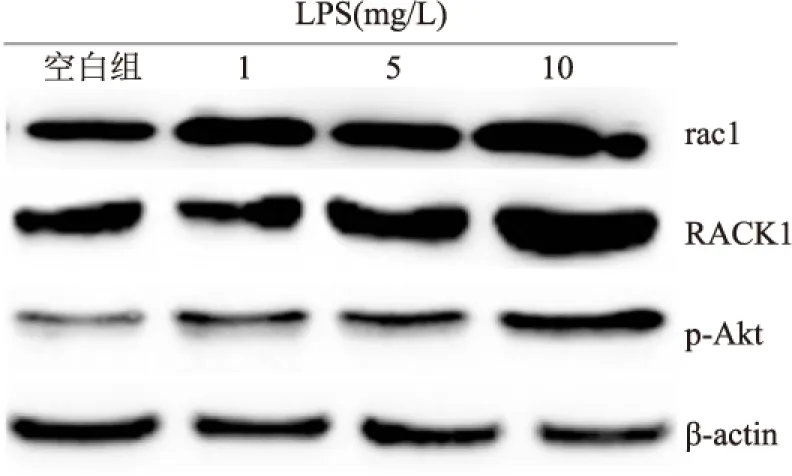
图1 不同浓度LPS诱导PMVEC表达RACK1、rac1及p-Akt
表1 不同浓度LPS与PMVEC孵育后rac1、RACK1及p-Akt的相对表达量
与0 mg/L组比较:aP<0.05;与1 mg/L组比较:bP<0.05;与5 mg/L组比较:cP<0.05
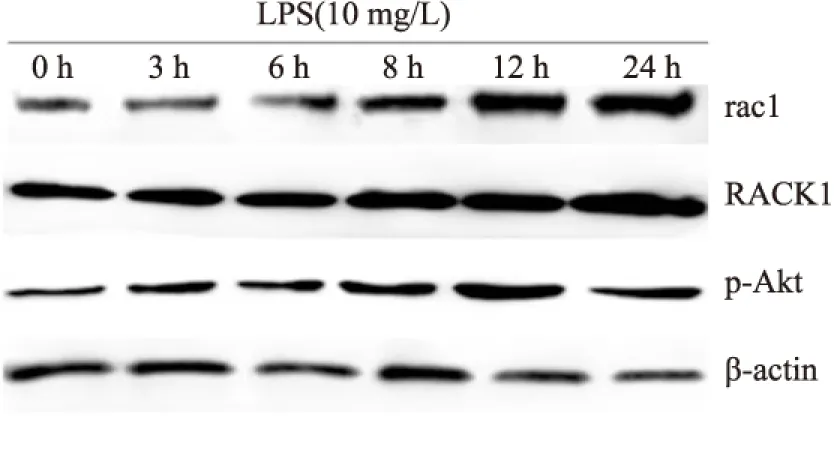
图2 LPS刺激不同时间诱导PMVEC表达RACK1、rac1及p-Akt
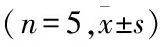
表2 LPS与PMVEC孵育不同时间后rac1、RACK1及p-Akt的相对表达量
与0 h组比较:aP<0.05;与3 h组比较:bP<0.05;与6 h组比较:cP<0.05;与8 h组比较:dP<0.05;与12 h组比较:eP<0.05
2.3 IGF-1刺激不同时间诱导大鼠PMVEC表达rac1、RACK1及p-Akt100 ng/ml IGF-1刺激3 h后rac1表达上调,组间比较差异有统计学意义(F=115.071,P<0.001);100 ng/ml IGF-1刺激3 h后RACK1表达上调,组间比较差异有统计学意义(F=188.293,P<0.001);100 ng/ml IGF-1刺激后,p-Akt表达自3 h开始上调,组间比较差异有统计学意义(F=60.175,P<0.001)。见图3、表3。
图3 IGF-1刺激不同时间诱导PMVEC表达RACK1、rac1及p-Akt
表3 IGF-1与PMVEC孵育不同时间后rac1、RACK1及p-Akt的相对表达量
与0 h组比较:aP<0.05;与3 h组比较:bP<0.05;与6 h组比较:cP<0.05;与8 h组比较:dP<0.05;与12 h组比较:eP<0.05
2.4 LY294002对LPS诱导大鼠PMVEC表达RACK1、rac1及p-Akt的影响与LPS组比较,LPS+LY294002组PMVEC表达RACK1、rac1及p-Akt均显著下调,差异有统计学意义(P<0.001);LY294002单独刺激PMVEC后,RACK1、rac1和p-Akt表达较空白组下调,差异有统计学意义(P<0.001)。见图4、表4。
3 讨论
研究发现激活的PI3K磷酸化Akt,p-Akt移动到胞质及胞核,再结合NF-κB、Bcl-2和mTOR等,调控炎症细胞活化和炎症介质释放,故p-Akt可作为PI3K/Akt信号通路活化的标志物[2, 7-8];另外,研究证实p-Akt作为LPS下游信号通路,上调IL-1、IL-6和TNF-α等参与LPS损伤过程[2, 8]。本研究显示在LPS刺激PMVEC过程中,p-Akt表达水平呈时间及浓度依赖性增加,因此,PI3K/Akt信号通路参与LPS致PMVEC损伤过程,但其下游信号传导机制尚不明确。
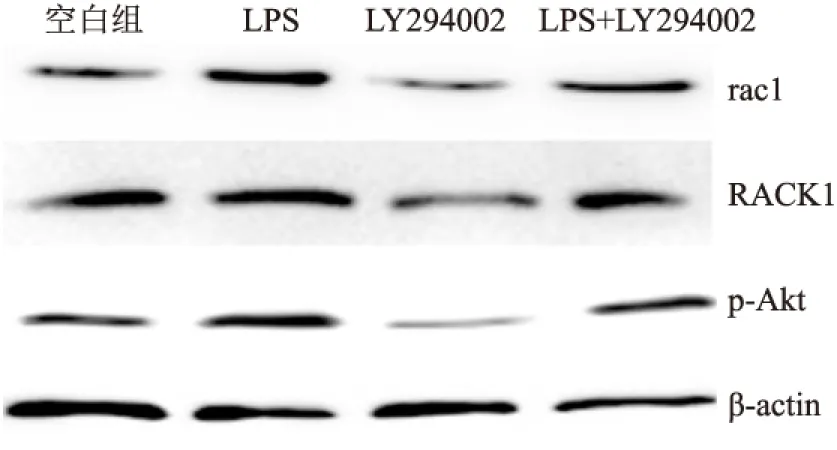
图4 LY294002对LPS诱导PMVEC表达RACK1、rac1及p-Akt干预作用
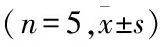
表4 LY294002影响LPS诱导PMVEC的rac1、RACK1及p-Akt相对表达量
与空白组比较:aP<0.05;与LPS组比较:bP<0.05;与LY294002组比较:cP<0.05
具有7个WD40位点的RACK1是G蛋白β亚基的同族体,可结合蛋白激酶C、Src等[9],维持细胞活化状态,引导活化蛋白前往特定区域,介导多种信号通路,参与炎症反应[3, 9-10]。研究证实PI3K/Akt信号通路激活与RACK1密切相关:在食管鳞状细胞癌株中过表达RACK1增加p-Akt,激活PI3K/Akt信号通路[3]。本研究表明在LPS损伤PMVEC过程中,RACK1表达水平与p-Akt一致,呈时间和浓度依赖性增加,提示PI3K/Akt信号通路与RACK1相互促进;进一步研究发现PI3K/Akt特异性激动剂诱导PMVEC的RACK1表达量呈时间依赖性增加,而抑制PI3K/Akt信号通路后,RACK1表达量呈时间依赖性下降,推测RACK1可能为PI3K/Akt信号通路效应因子。
rac1是小G蛋白家族成员,调控细胞形态、黏附、骨架及内皮细胞迁移等[5, 11-12];rac1参与RACK1活性调控[5],如在上皮细胞中,rac1解除Src与RACK1的绑定,进而与RACK1形成复合物,促进细胞周期进程及细胞生长[13-14];此外,rac1也作为PI3K/Akt信号通路的下游靶点[11-12]。本研究表明在LPS诱导PMVEC过程中,rac1表达水平与RACK1一致,提示rac1和RACK1同步参与LPS致PMVEC损伤。实验进一步证实应用信号通路特异性激动剂激活PI3K/Akt后,rac1表达水平呈时间依赖性增加,而应用信号通路特异性抑制剂抑制PI3K/Akt后,rac1表达水平下降,且其趋势与RACK1一致,故推测PI3K/Akt信号通路可能通过调控RACK1-rac1复合物参与LPS致PMVEC损伤过程。
综上所述,本研究证实LPS损伤PMVEC过程中,PI3K/Akt信号通路被激活;LPS诱导大鼠PMVEC表达RACK1及rac1增加;PI3K/Akt信号通路通过调控RACK1及rac1表达参与LPS损伤PMVEC,从而为ARDS的发病和诊治提供思路,但在PMVEC中,RACK1与rac1是否通过复合物形式参与PI3K/Akt信号通路调控有待进一步探讨。
