大豆球蛋白-花青素Pickering乳液性质
2020-02-10鞠梦楠陈红宇董亚博温家煜江连洲隋晓楠
鞠梦楠,祝 钢,陈红宇,兰 天,董亚博,温家煜,江连洲,隋晓楠
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
由两种不相溶相制备的乳液在食品、药品和化妆品行业中起着至关重要的作用[1]。由于经水油部分润湿的固体胶体颗粒稳定的Pickering乳液在热力学上的不稳定性,在制备Pickering乳液的过程中通常加入小分子的表面活性剂或者表面活性聚合物,譬如多糖和脂肪[2]。Shao Ping等[3]成功制备了由芋头淀粉纳米颗粒稳定的Pickering乳液,并研究了其包封茶多酚的潜在价值。Sarkar等[4]研究乳铁蛋白和菊粉制备的纳米颗粒稳定的Pickering乳液,发现其不容易被胃蛋白酶降解,同时可以延缓食物在胃内的消化。Schroder等[5]研究了在交叉流动微流体装置内,胶体脂质颗粒稳定乳液的形成过程和聚结稳定性。此外蛋白颗粒具有很强的界面稳定性,环保且无毒,因此由蛋白质颗粒稳定的Pickering乳液具有很大的实际意义。Burgos-Díaz等[6]采用羽扇豆蛋白质分离物开发食品级Pickering乳液稳定剂,研究了Pickering乳液的乳化指数、微观结构和理化性质。Jiao Bo等[7]发现通过改变花生蛋白制备的高内相Pickering乳液内相比组成,可得到不同潜在应用的Pickering乳液。然而,很少有人研究大豆分离蛋白(soybean protein isolate,SPI)与小分子多酚共价复合物作为稳定剂制备Pickering乳液。
大豆蛋白是一种全价蛋白,主要由β-伴大豆球蛋白(7S)和大豆球蛋白(11S)组成,而SPI又以蛋白质含量高达90%以上被广泛应用在食品行业中。大豆球蛋白主要通过氢键和二硫键稳定结构,具有较低的分子灵活性[8],并且SPI通过降低水-油界面张力促进乳液的形成,同时在水-油界面处形成膜结构,从而避免乳液聚集絮凝[9]。作为植物次级代谢产物的多酚类物质是植物界中数量最多的物质之一,而作为单体多酚的花青素(anthocyanin,ACN)可在食物体系中稳定其分子结构,极大的保留其功能活性[10]。根据美国水果和蔬菜的摄入量估算,人类饮食中ACN的摄入量约为12.5 mg/d[11], 这表明ACN是人类饮食的重要组成部分。ACN作为小分子物质,通过渗透到蛋白微原纤维中,与多肽链形成多种交联点[12]。研究表明,蛋白与ACN共价交联后,可形成较强的共价键并引起蛋白结构的解折叠从而影响二者的特性[13]。尽管以往的研究对多酚类物质与植物蛋白共价作用进行了积极探索,但共价作用的确切机制及其对Pickering乳液特性及微观结构的影响尚不清楚。
因此,在本研究中,通过ACN与SPI共价复合制备纳米颗粒,破坏SPI中的二硫键,使二者之间形成共价键,进而改善其分子间柔性较低的状态。通过流变性质,冷冻电镜与激光共聚焦显微镜分析,对比有无ACN对SPI稳定Pickering乳液的影响,这将为健康、高营养的Pickering乳液设计提供理论基础。
1 材料与方法
1.1 材料与试剂
大豆粉末 禹王有限公司;黑米、九三非转基因大豆油(市售);其他试剂均为分析纯。
1.2 仪器与设备
C J J-6 磁力搅拌器 纳丽雅(N a l i y a)有限公司;5424R冷冻离心机 德国Eppendorf公司; P H S-2 5 数显台式酸度计 上海雷磁公司;R 2 5 0旋转蒸发仪 瑞士B ü c h i 公司;H H 4 2 0 水浴锅 光合有限公司;2500C高速研磨机 艾泽拉有限公司;Fluor光度计 日本Hitachi公司;乳化机 德国IKA 公司;7 2 2 N 紫外分光光度计 上海菁华公司;HAAKE Rheostress RS600旋转黏度计 德国Thermo Electron公司;LSM 880共焦显微镜 德国Zeiss公司;CT1500 HR低温系统、XL30场发射扫描电子显微镜 荷兰Philips公司。
1.3 方法
1.3.1 SPI的制备
根据Huang Liurong等[14]的方法稍加修改。将大豆粉末以1∶15的质量比溶于去离子水中,用2 mol/L NaOH溶液将pH值调节至8.0,并将所得浆液在25 ℃机械搅拌2 h,在4 000h g离心15 min后收集上清液,并用 2 mol/L HCl溶液调节至pH 4.5,然后4 000h g离心15 min。将获得的沉淀物溶于去离子水中,用2 mol/L NaOH溶液中和至pH 7.0,在4 ℃用去离子水透析24 h后冷冻干燥以获得SPI粉末。
1.3.2 ACN的提纯与定量
将未抛光的黑米粒在40 ℃干燥,用高速研磨机研磨并通过80 目筛网。根据Prior等[15]描述的提取方法稍作修改,将干燥的黑米粉用乙醇-水-盐酸(50∶50∶0.5,V/V)以固液比(1∶10)在30 ℃萃取2 h。合并所有提取物并通过布氏漏斗过滤,将收集的滤液在35 ℃真空蒸发以除去乙醇。将浓缩的提取物加载到AB-8树脂柱上以除去杂质。然后用体积分数1%的盐酸洗涤,用体积分数70%的乙醇溶液(含有体积分数1%盐酸)回收。35 ℃真空蒸发除去乙醇,得到富含ACN的黑米提取物。
使用矢车菊素-3-O-葡萄糖苷标准曲线作为量化黑米提取物中ACN的参考曲线[16]。将ACN储备液用10%甲酸溶液稀释至1、2、5、10、20、50、125 μg/mL。用Waters HPLC系统分析标准溶液和适当质量浓度的提取物。将二极管阵列检测器设定检测波长为520 nm。ACN通过C18反相柱,流速为1 mL/min。流动相由体积分数100%甲醇(A)和10%甲酸(B)组成,具有以下梯度洗脱:0~5 min,10% A;5~20 min,10%~60% A;20~30 min,60% A。进样体积为20 μL。将峰面积作为横坐标绘制为标准溶液浓度的函数。用矢车菊素-3-O-葡萄糖苷标准曲线计算其质量浓度为53.8 mg/mL。
1.3.3 SPI-ACN共价复合纳米颗粒的制备
根据Zhu Xuefeng等[17]的方法稍作修改。称取SPI溶于0.01 mol/L磷酸缓冲溶液(pH 7.0)中,配制成质量浓度60 mg/mL SPI溶液,磁力搅拌2 h,在4 ℃过夜储存以使溶液完全水合。随后将溶液pH值调节至9.0,将ACN按不同体积分数(0.05%、0.10%、0.15%分别表示为NAC1、NAC2、NAC3)加入蛋白溶液中,并在25 ℃混合搅拌16 h,以得到二者共价复合物。未经过共价复合的蛋白溶液作为对照组(NSPI)。并用0.5 mol/L NaOH或 0.5 mol/L HCl溶液将pH值精确调节至7.0。将所有样品在95 ℃的水浴中加热15 min,并立即在冰浴中冷却至25 ℃。
1.3.4 颗粒表面疏水性(H0)测定
根据Liu Fu等[18]的方法稍加修改。使用荧光探针8-苯胺-1-萘磺酸钠(8-anilino-1-naphthalenesulfonte, ANS-Na)测定蛋白质的表面疏水性。用0.01 mol/L磷酸缓冲溶液(pH 7.0)稀释样品,使最终质量浓度为0.04~0.2 mg/mL;同时使用相同的磷酸缓冲溶液配制ANS-储备液(8.0 mmol/L)。将20 μL ANS-溶液与4 mL各稀释样品振荡混合均匀,使用Fluor光度计在激发波长370 nm、发射波长470 nm测量混合物的荧光强度。以荧光强度与蛋白质质量浓度曲线的初始斜率(通过线性回归分析计算)用作表面疏水性数值。
1.3.5 乳液制备
根据Zhu Xuefeng等[17]的方法进行修改。将大豆油加入各个蛋白溶液中,直至油相体积比为1∶5,使用IKA乳化机10 000 r/min均化2 min,获得新鲜乳液(分别用ESPI、EAC1、EAC2、EAC3表示)。
1.3.6 乳化活性性及乳化稳定性的测定
根据Sui Xiaonan等[19]的方法稍加修改。用0.1%十二烷基硫酸钠将乳液样品稀释至0.05 mg/mL,使用紫外分光光度计在500 nm波长处测定初始状态的吸光度(A0)和放置30 min后的吸光度(A30)。乳化活性指数(emulsifying activity index,EAI)和乳化稳定性指数(emulsion stability index,ESI)根据下式计算:
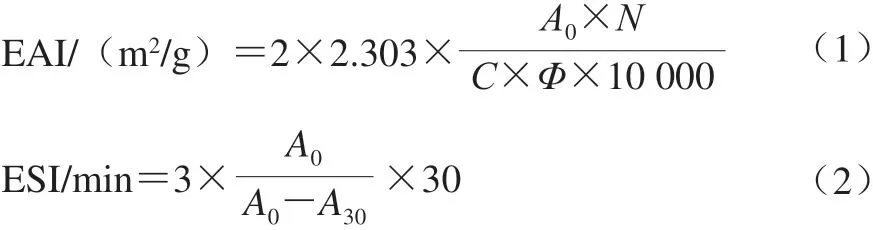
式中:N为样品稀释倍数;C为SPI质量浓度/(g/mL); Φ为油相比;A0为初始状态吸光度;A30为静置30 min后的吸光度。
1.3.7 乳液流变测量
根据Dokic等[20]的方法稍加修改,使用旋转黏度计来测量乳液的流变行为。该实验使用锥板C60/1Ti传感器(锥板间隙为0.052 mm),测量在(25f 0.1)℃进行。该方法主要为磁滞回线测试,在前180 s内,剪切速率由0 s-1增加至500 s-1,随后使剪切速率在500 s-1维持120 s,最后使剪切速率在180 s内减少至0 s-1。为了确定黏弹性区域,振荡应变扫描实验测量的振荡应变范围为0.01%~100%,频率为1 Hz。振幅测试条件如下:频率0.1~10 Hz,应变0.2%。由应变响应计算弹性模量(G’)和黏性模量(G”)。通过Power-Law模型对数据进行拟合:

式中:τ 为表观黏度/(P a g s);K 为稠度指 数/(Pag sn);γ为剪切速率/s-1;n为流动行为指数。
在黏弹性数据比较稳定的频率(0.5 Hz)下计算黏弹性比值tanδ评估SPI-ACN共价复合Pickering乳液的损失正切值。
1.3.8 乳液微观观察
采用激光共聚焦扫描显微镜和冷冻电镜研究样品的微观结构。根据Liu Fu等[21]的方法稍加修改,对样品进行激光共聚焦微观结构观察,染色方法为:40 μL尼罗蓝和尼罗红混合荧光染料与1 mL样品避光混合染色30 min,将样品放置在载玻片上并盖上盖玻片。使用共焦显微镜对乳液进行观察。
参考Whitby等[22]的方法稍加修改,使用场发射扫描电子显微镜拍摄乳液微观结构的冷冻扫描电子显微镜图。将乳液滴在位于支架上的低温扫描电子显微镜短管中并在氮气中冷冻。随后,将短管转移到超真空低温室中,在-95 ℃将乳液破碎蚀刻60 s。在铂中对破碎的表面进行涂覆,然后转移到扫描电子显微镜的冷冻阶段(-170 ℃)并使用显微镜控制软件拍摄图像。
1.4 统计分析
每组实验至少重复3 次,使用SPSS 15.0对数据进行ANOVA分析,P<0.05,差异显著。使用Origin 8.5进行图表绘制。
2 结果与分析
2.1 颗粒表面疏水性分析
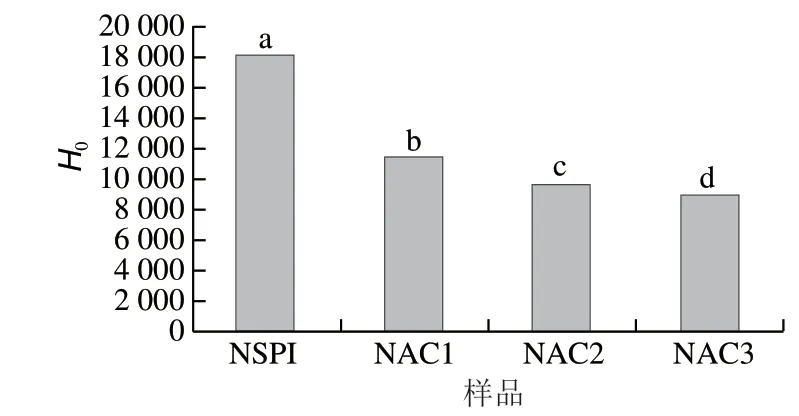
图 1 纳米颗粒表面疏水性Fig. 1 Surface hydrophobicity of nanoparticles
H0是影响其表面相关功能的重要参数[18]。如图1所示,以ACN体积分数为横坐标作为表面疏水性的函数并用ANS-作为荧光探针。随着ACN添加量的增大,颗粒表面疏水性逐渐减小,当ACN体积分数由0%增加到0.15%时,纳米颗粒的H0由18 174降低到8 945。Wei Zihao等[23]研究发现,牛奶蛋白与茶多酚共价复合后致使牛奶蛋白表面疏水性降低,与本研究结果一致。Karaca等[24]的研究表明在中性pH值下SPI的表面疏水性值为55.32。本研究的SPI纳米颗粒的H0明显高于其他研究,其原因可能为热处理诱导SPI去折叠,导致更多疏水性基团迁移到分子外部[25]。此外,随着ACN含量的增加,纳米颗粒的H0逐渐降低,这可能是由于ACN的添加导致蛋白质分子表面的负电荷基团与ANS-的有机磺酸盐基团之间的静电排斥增加,从而致使ANS-与蛋白质之间的结合减少[28]。
2.2 EAI及ESI分析
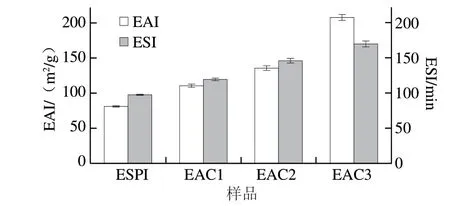
图 2 EAI及ESI分析Fig. 2 EAI and ESI of Pickering emulsions
由图2可知,Pickering乳液的EAI与ESI随着ACN的添加逐渐增大,当ACN含量增大0.15 倍时,乳液的EAI增大了将近2 倍;乳液的ESI增大了将近1 倍。Liu Fuguo等[27]得出了类似的结论,共价复合后的蛋白与多酚形成的乳液,随着多酚量的添加,EAI和ESI逐渐增加。影响Pickering乳液共价复合体系的影响因素有很多,诸如蛋白质分子质量,蛋白与多酚共价复合后的结合率等[28]。由于Pickering乳液制备过程中需要加热,由此可以推断,蛋白的二、三级结构在加热条件下发生改变,从而使油水界面处的分子重排,增加了蛋白的两亲性,进而使得乳化性能增强[29]。Jiang Lianzhou等[30]研究表明,当蛋白与ACN复合后形成的乳液在油水界面处会形成两层乳化膜。第1层被二者的复合物占据,第2层为蛋白质暴露的疏水基团通过疏水相互作用与ACN形成的乳化膜,由此增加了Pickering乳液的ESI。
2.3 乳液流变分析
2.3.1 乳液静态流变分析
由图3A可知,所有乳液在剪切速率为0.01~100 s-1时,随着剪切速率的增大黏度逐渐下降,表现出典型非牛顿假塑性行为(剪切稀化)。Pickering乳液显著的剪切稀化行为是典型的弱缔合相互作用,Tzoumaki等[31]曾报道过相似的结论,疏水性植物糖原纳米颗粒稳定的乳液中形成弱的液滴网络结构。此外,在相同剪切速率下,ACN体积分数越高,Pickering乳液的黏度越大。这些结果与用SPI-ACN共价复合纳米颗粒稳定Pickering乳液的剪切应力-剪切速率一致(图3B)。SPI-ACN纳米颗粒稳定的Pickering乳液的剪切应力-剪切速率是非线性的,符合非牛顿流体的剪切稀化行为。这种行为可以通过在剪切过程中破坏缠结的聚合物网络来解释,其中破坏的分子间缠结速率大于重整的分子间缠结速率,导致分子间流动阻力较小和表观黏度较低[32]。图3B中较高的相关系数值证实了SPI-ACN Pickering乳液参数的可靠性 (R2>0.97)。此外,Pickering乳液中ACN含量的增加导致K值的增加,这与图3A中表观黏度数据相符。同时可知n值均小于1,这证实了乳液为非牛顿假塑性 流体[33]。Pickering乳液中ACN体积分数的增加导致n值的降低,因此牛顿行为的偏差增加。Dokic等[20]得到相似的结论,由于辛烯基琥珀酸酐淀粉浓度以及分散相体积分数的增加,导致了乳液的表观黏度和假塑性特征增加。

图 3 SPI-ACN共价复合纳米颗粒稳定Pickering静态流变分析和 Power-Law模型数据拟合Fig. 3 Static rheological analysis of Pickering emulsions stabilized by SPI-ACN and data fitting by power law model
2.3.2 乳液动态流变分析
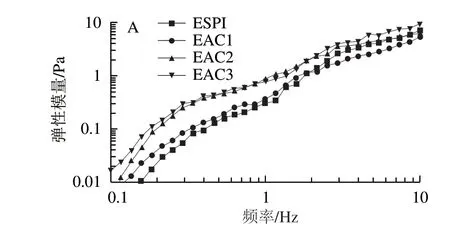

图 4 SPI-ACN Pickering乳液动态流变分析Fig. 4 Dynamic frequency sweep curves of Pickering emulsions stabilized by SPI-ACN
由SPI与ACN共价复合稳定的Pickering乳液的动态流变分析如图4所示。随着频率的增大,Pickering乳液的弹性模量和黏性模量逐渐增大,并且弹性模量大于黏性模量;在同一频率下,随着ACN添加量的增大,弹性模量与黏性模量逐渐增大。由此证实SPI-ACN Pickering乳液为弹性凝胶乳液,并且弹性模量的变化与频率变化无关[34]。Ye Fan等[1]的研究得到相似的结果,随着疏水性植物糖原浓度的增大,其稳定的Pickering乳液弹性模量和黏性模量逐渐增大并且弹性模量大于其黏性模量。这是由于稳定剂浓度在Pickering乳液液滴网络结构中产生的作用[35]。由图4c可知,在同一剪切频率下,随着ACN添加量的增大tanδ逐渐增大并且始终小于1,这说明该Pickering乳液的弹性模量始终小于黏性模量,乳液呈现类固体特性。随着ACN体积分数的增大,tanδ值明显增大,这说明黏性模量上升幅度大于弹性模量,在此浓度范围内Pickering乳液的黏性比例逐渐增大,这也与图4a、b结果相一致。
2.4 乳液冷冻电镜分析
冷冻电镜分析有助于更清晰直观地了解乳液的微观结构。由于乳液在氮气淤浆中以相对缓慢的速率冷冻,因此当液体冻结时油结晶,暴露在冷冻乳液样品中的油滴由大晶体组成,如图5所示。随着ACN添加量的增加,蛋白颗粒大小逐渐均一密集;由蛋白颗粒自组装而成的Pickering乳液液滴逐渐减小,油滴表面附着致密的蛋白颗粒。这一结果与Wang Pengjie等[36]的研究一致,由酪蛋白稳定的Pickering乳液在油滴表面上形成致密颗粒层。由图5可知,随着ACN添加量的增大,乳液界面由光滑变为网络状结构,这可能是因为ACN与蛋白共价复合后促进了蛋白发生有序聚集,同时瓦解复合物中蛋白结构,使得蛋白肽链展开。

图 5 Pickering乳液冷冻电镜分析Fig. 5 Cryo-scanning electron microscopic analysis of Pickering emulsions
2.5 乳液激光共聚焦分析
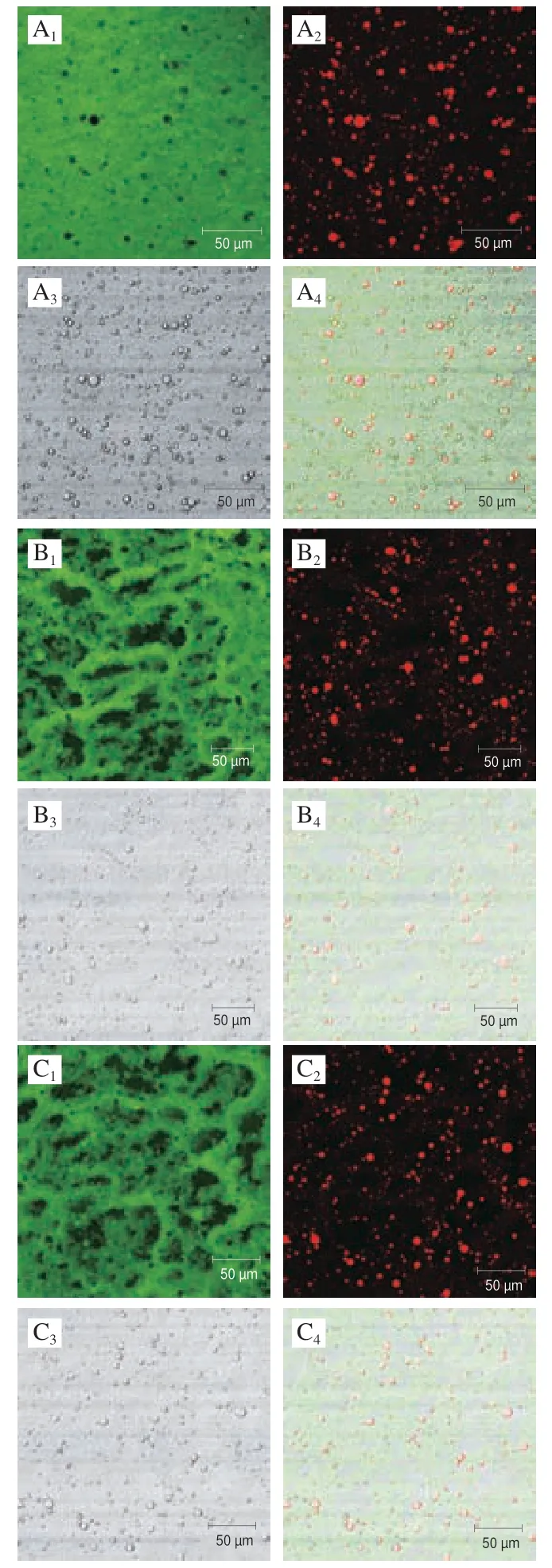

图 6 乳液激光共聚焦分析图Fig. 6 Laser scanning confocal microscopic analysis of Pickering emulsions
使用激光共聚焦技术可以评估ACN体积分数增加对蛋白和脂滴分布的影响,如图6所示(油滴被尼罗红染为红色,蛋白被尼罗蓝染为绿色),随着ACN添加量的增大,蛋白分布逐渐呈现网络状结构;脂滴逐渐减小,分布更加均一。该结果与2.4节冷冻电镜结果一致,这说明随着ACN的加入蛋白与脂滴在运动中受到限制,其分布形态与方式变得更加有序。这表明在高ACN体积分数下增强的液滴间相互作用很大程度上促进了网络状结构的形成[37]。同时,由明场图片可以看出SPI-ACN纳米颗粒完全吸附稳定油滴界面,针对于出现的网络结构可能是形成了桥接乳液。由于ACN与SPI共价复合后使蛋白的肽链展开,致使乳液中两个单独的脂滴共用一层SPI-ACN颗粒层。桥接乳液的出现将显著促进网络结构的形成,同时促进聚集颗粒凝胶的形成(构建蛋白质稳定乳液的一种理想模型)[38]。Destribats等[39]研究发现水包油型Pickering乳液稳定的软微凝胶也观察到相邻液滴间的桥接模式。
3 结 论
随着ACN体积分数的增大,SPI-ACN共价复合纳米颗粒的表面疏水性逐渐下降,由其稳定的Pickering乳液的EAI、ESI逐渐增加。SPI-ACN共价复合Pickering乳液表现出典型非牛顿假塑性流体行为并且该乳液为类固体乳液。由冷冻电镜与激光共聚焦显微镜观察结果可知,随着ACN体积分数的增大,纳米颗粒表现出致密有序的排列;乳液粒度在可视范围内减小;脂滴分布更为均一; SPI-ACN共价复合Pickering乳液呈现出桥接乳液形态。
