变性淀粉对肌原纤维蛋白凝胶特性的影响
2020-02-10李新福杜先锋徐宝才
吴 香,李新福,李 聪,杨 婷,周 辉,杜先锋,徐宝才,4,
(1.安徽农业大学茶与食品科技学院,安徽 合肥 230036;2.肉品加工与质量控制国家重点实验室,江苏雨润肉食品有限公司,江苏 南京 211806;3.合肥师范学院电子信息与电气工程学院,安徽 合肥 230601;4.合肥工业大学食品与生物工程学院,安徽 合肥 230036)
玉米淀粉产量大、且经济实惠,被广泛用于食品、制药和化工等行业[1-2]。但玉米淀粉存在析水易老化、耐机械性差等缺陷,对其更进一步的应用带来影响[3]。变性淀粉具有较好的吸水膨胀性、透明性[4-5]和糊化温度低等特点,使得变性淀粉在食品应用中有着独特的 优势[6-7]。肌原纤维蛋白是肌肉中的主要蛋白[8],作为功能性蛋白质,除了可以维持肌纤维形态、参与肌肉收缩外,也是形成凝胶最重要的蛋白质[9]。蛋白质与淀粉多糖之间的相互作用形成的混合凝胶,赋予共混体系一些独特的性质,使得淀粉-蛋白共混体系不仅可以改善蛋白的流变学特性[10-11],而且对改进肉制品的硬度、弹性[12]和出品率也有着紧密的作用[13]。
夏秀芳等[14]研究马铃薯淀粉对鲤鱼肌原纤维蛋白功能特性影响,发现马铃薯淀粉可提高肌原纤维蛋白的硬度、弹性、保水性及乳化稳定性。Sun Fengyuan等[15]在肌原纤维蛋白中加入木薯淀粉和木薯变性淀粉,发现添加木薯淀粉可有效提高淀粉-蛋白复合物的保水性、质构特性,且添加量增大可显著提高蛋白网络的聚集性。然而目前对不同变性淀粉-蛋白复合物热诱导凝胶的流变性、水分迁移情况以及淀粉与蛋白相互作用机制的基础研究不透彻。
本实验通过将不同变性淀粉添加到肌原纤维蛋白中(以玉米原淀粉为对照),通过对流变特性、质构特性、持水性和水分迁移等指标变化规律的分析,阐释淀粉对肌原纤维蛋白凝胶特性的影响机理,为玉米变性淀粉和木薯变性淀粉在肉制品中的进一步应用提供理论依据。
1 材料与方法
1.1 材料与试剂
鸡胸肉 江苏雨润肉食品有限公司;玉米淀粉(native corn starch,NCS) 河北玉峰淀粉糖业有限公司;玉米乙酰化二淀粉磷酸酯(acetylated distarch phosphate,ADP) 嘉吉投资(中国)有限公司;木薯乙酰化双淀粉己二酸酯淀粉(acetylated distarch adipate,ADA)、木薯醋酸酯变性淀粉(starch acetate,SA) 广西农垦明阳生化集团;K2HPO4、Na2HPO4上海凌峰化学试剂有限公司;NaCl、牛血清白蛋白(bovine serum albumin,BSA)、MgCl2、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA) 济宁百川化工有限公司;HCl、NaOH、CuSO4、酒石酸钾钠 国药集团药业股份有限公司;以上试剂均为分析纯。
1.2 仪器与设备
FA25高速分散乳化机 上海弗鲁克流体机械制造有限公司;CR21GIII型高速冷冻离心机 日本Hitachi Koki 公司;PHS-3C数字pH计 天津市盛邦科学仪器技术公司; 分光光度计 北京普析通用仪器有限责任公司;HH-6数显恒温水浴锅 国华电器有限公司;MCR302流变仪 奥地利安东帕有限公司;TA.XT.Plus物性仪 英国SMS公司;MicroMR微型核磁共振成像仪 上海纽迈电子有限公司。
1.3 方法
1.3.1 肌原纤维蛋白的提取
参考伍梦婷[16]和Doerscher[17]等的方法并作修改,剔除鸡胸肉结缔组织和脂肪,切成小块。在原料肉中加入4 倍体积提取液(10 mmol/L K2HPO4、0.1 mol/L NaCl、2 mmol/L MgCl2、1 mmol/L EDTA,pH 7.0),用高速分散机匀浆(12 000 r/min,1 min,冰浴),制得的悬浮液置于高速冷冻离心机中离心(3 500h g,15 min,4 ℃),弃去上清液,取沉淀重复提取2 次,得到粗提的肌原纤维蛋白。
在粗提的肌原纤维蛋白中加入4 倍体积的0.1 mol/L NaCl溶液,冰浴条件下12 000 r/min匀浆1 min,4 ℃、4 000h g离心15 min,重复提取1 次,取沉淀加入4 倍体积的0.1 mol/L NaCl溶液,匀浆1 min,过40 目筛,用0.1 mol/L HCl溶液调节pH值至6.0,4 ℃、3 500h g离心15 min。弃去上清液,沉淀为提纯的肌原纤维蛋白。蛋白质浓度采用双缩脲法测定,以BSA为标准蛋白,最终绘制标准曲线为y=0.049 6x+0.002 7,R2=0.999 8,所提取的蛋白在4 ℃冰箱保存,3 d内用完。
1.3.2 肌原纤维蛋白凝胶制备[18]
将肌原纤维蛋白溶于磷酸缓冲液(0.6 mol/L NaCl,50 mmol/L Na2HPO4/NaH2PO4,pH 6.5),蛋白质量浓度调整到70 mg/mL,分别加入肌原纤维蛋白溶液总量的0%、4%、6%、8%、10%、12%的淀粉,混合均匀后,量取20 mL蛋白于平底玻璃瓶中并封口(内径36 mm,高60 mm),置于水浴锅中以1 ℃/min的速率升温到80 ℃,保温50 min。然后取出放在0~4 ℃条件下冷藏12 h后进行测试。
1.3.3 肌原纤维蛋白流变特性测定
肌原纤维蛋白溶于磷酸缓冲液(0.6 mol/L NaCl、50 mmol/L Na2HPO4,pH 6.5),将蛋白质量浓度调整到20 mg/mL,分别加入肌原纤维蛋白溶液总量的0%、4%、6%、8%、10%、12%的淀粉,混合均匀。流变仪测试条件:夹具为50 mm平板,上下板夹缝1 mm,频率0.1 Hz,应变为2%,从30 ℃以0.05 ℃/s升温到80 ℃,板外加盖防止溶液蒸发,储能模量(G’)和相变角正切(tanδ)流变性指标随温度变化自动记录,每个样品测定5 个平行。
1.3.4 质构特性测定
采用质构分析仪进行凝胶强度测定。质构仪参数设定:测前探头下降速率1 mm/s,测试速率5 mm/s,测后探头上升速率5 mm/s,压缩比50%;负载类型:Auto-5 g;探头:P0.5R。每个样品测定5 个平行。
1.3.5 复合凝胶保水性测定
参照Foegeding等[19]的方法进行参数设定。蛋白质量浓度调节至40 mg/mL,分别加入肌原纤维蛋白溶液总量的0%、4%、6%、8%、10%、12%的淀粉,混合均匀。制备成热诱导凝胶后,于4 ℃冷藏24 h后8 000 r/min离心20 min,弃离心出液体并计算前后样品质量差,每个样品测定5 个平行。按下式计算凝胶保水性:
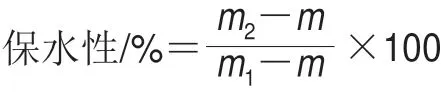
式中:m为离心管质量/g;m1为离心前凝胶和离心管总质量/g;m2为离心后凝胶和离心管总质量/g。
1.3.6 低场核磁共振自旋-自旋弛豫时间(T2)测定
将蛋白质量浓度调节至40 mg/mL,分别加入肌原纤维蛋白溶液总量的0%、4%、6%、8%、10%、12%的淀粉,混合均匀。取2 g样品凝胶于15 mm玻璃小管中以1 ℃/min 的速率升温到80 ℃后保温30 min,再冷却至室温,所得凝胶置于4 ℃保存12 h后,进行核磁共振实验。测试条件:质子共振频率22 MHz,测量温度32 ℃。T2弛豫时间用CPMG序列测量。参数设置:τ值设为250 μs,重复扫描次数为32,得到16 000 个回波。每个样品测定5 个平行,得到指数衰减图形后用仪器自带的Multi Exp Inv Analysis 软件进行反演,得到T2值以及弛豫幅值。
1.4 数据统计分析
采用SPSS 20.0软件进行相关性分析和方差分析,方差显著性分析用Duncan multiple-range test进行多重比较(P<0.05),采用Origin 8.0软件进行作图。
2 结果与分析
2.1 淀粉对肌原纤维蛋白流变特性的影响
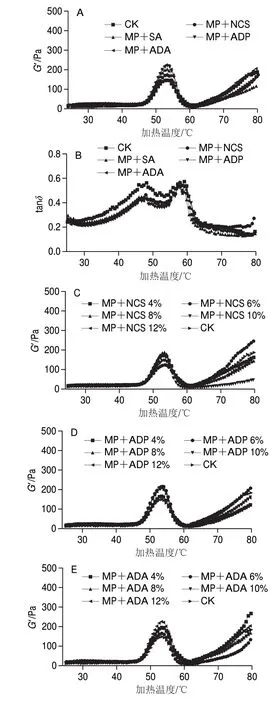
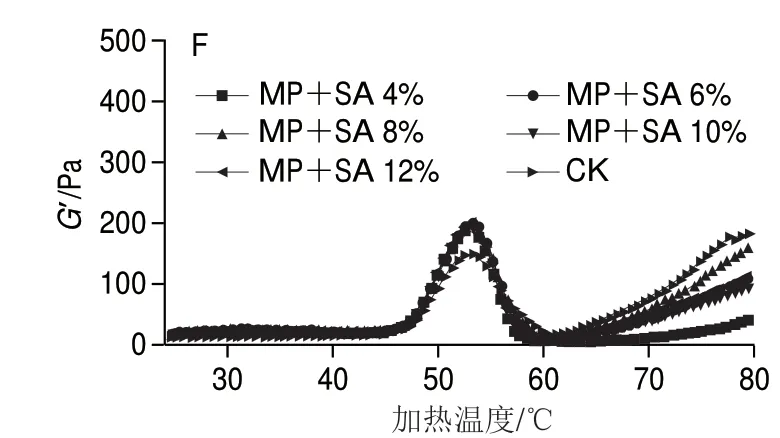
图 1 淀粉及添加量对肌原纤维蛋白流变性的影响Fig. 1 Effects of the type and amount of starches on rheological properties of MP
通过测定试样G’和tanδ反映凝胶体的黏弹性变化[20],能反映蛋白结构解折叠和聚集的不同阶段及凝胶性能的强弱。由图1A可知,各实验组均在40~55 ℃之间,混合样的G’逐步上升,在55~60 ℃间G’开始下降,在65 ℃后G’再次上升。与CK(40 ℃)相比,NCS、ADP、ADA和SA混合样分别于42、43、44 ℃和46 ℃时G’开始上升,且G’于53 ℃左右达到峰值,G’分别为173、220、225 Pa和200 Pa。与CK组相比,淀粉的加入可延迟肌原纤维蛋白的变性温度,添加变性淀粉比NCS的变性温度延迟1~4 ℃,这说明淀粉的添加延缓了蛋白质分子变性,增强了蛋白在受热过程中的热稳定性,这归因于淀粉与肌原纤维蛋白之间的相互作用,且乙酰化淀粉与蛋白间的相互作用更强[21]。在40 ℃左右时G’的增大来自于肌球蛋白头部的接合,肌球蛋白尾部会随着温度的升高逐渐展开,导致肌球蛋白的头部结合瓦解,致使G’下降;在温度超过60 ℃后,随着蛋白的变性伴随着淀粉的糊化,二硫键的形成促进凝胶网络交联,使得G’持续增加,这与Egelandsdal等[22]在热诱导肌球蛋白凝胶的动态流变学研究中结果基本一致。
tanδ值大于1时,表明样品的黏性大于弹性,为黏性流体;小于1时,表明样品的弹性大于黏性,为溶胶或凝胶。由图1B可以看出,tanδ始终小于1,并且在30~45 ℃间呈上升趋势,45~47 ℃略微平衡的状态,从47 ℃之后逐步开始下降,55 ℃之后持续上升,在60 ℃达到最高。说明添加淀粉的肌原纤维蛋白在45 ℃之前随着温度的升高蛋白结构膨胀呈现出黏性溶胶的状态,在45~47 ℃开始从溶胶向凝胶转变,在47 ℃之后二硫键交联加速弹性网络的形成使得tanδ下降,当温度升高至55 ℃,蛋白尾部的展开使得tanδ再次上升。
从图1C~F可知,淀粉添加量对肌原纤维蛋白G’的总体变化趋势影响不显著,均呈现先上升后下降再上升的趋势。G’随淀粉添加量增加而增大,其中NCS添加量为8%,ADP、ADA和SA添加量为12%时蛋白质变性时G’达到最高且添加变性淀粉的G’高于原淀粉,但在 50~55 ℃淀粉添加量超过8%时蛋白变性G’峰值差异性不显著(P>0.05),说明变性淀粉添加量小于10%对肌原纤维蛋白流变特性有促进作用。这归因于变性淀粉糊化温度接近于蛋白质热凝胶形成温度,随着温度升高变性淀粉颗粒逐渐溶胀吸水并占据更多空间,从而混合物结构更紧凑;另外,随着温度的升高蛋白质结构发生 变化[23],蛋白质分子开始凝胶化并析水,变性淀粉吸水膨胀后黏弹性高于NCS,从而导致变性淀粉蛋白混合样发生变性时的G’更高。
2.2 淀粉对肌原纤维蛋白凝胶强度的影响
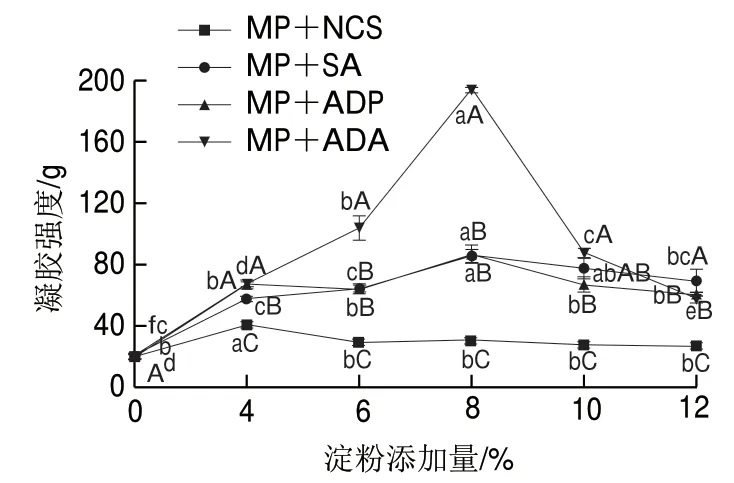
图 2 淀粉及添加量对肌原纤维蛋白凝胶强度的影响Fig. 2 Effects of the type and amount of starches on gel strength of MP
由图2 可知,C K 组(0%)肌原纤维蛋白的凝胶强度显著低于添加淀粉的肌原纤维蛋白凝胶强度 (P<0.05)。添加6%~12%的NCS对肌原纤维蛋白的凝胶强度影响不显著(P>0.05);添加ADP、ADA和SA对淀粉-蛋白复合物的凝胶强度均呈现先增大后减小的趋势,ADP、ADA和SA均在添加8%时凝胶强度最高,但3 种变性淀粉的添加量对凝胶强度的增加程度有所差异(ADA>ADP>SA>NCS),其中添加8%的ADA的凝胶强度达193.90 g。这表明淀粉种类和添加量对淀粉-蛋白复合物凝胶强度有直接影响,添加0%~8%变性淀粉对其凝胶强度有促进作用。有研究表明淀粉糊化温度越低,对蛋白的支撑效应越强[24]。根据之前的研究结果ADA、SA和ADP糊化温度显著低于原淀粉,其中ADA糊化温度最低,其混合物凝胶强度显著高于其他组。另外,变性淀粉与肌原纤维蛋白中的一些反应基团, 如—NH2、—OH和—SH相互作用,参与蛋白质内的交联反应,并与其他生物分子群体相互作用,起到很好的胶黏作用,使得淀粉-蛋白复合物在外界压力下不会轻易破裂,该结果与吕振磊等[25]研究结果一致。另有研究报道称凝胶强度的增加是基于肌原纤维蛋白凝胶网络内的糊化淀粉颗粒的“充填效应”[26],从而淀粉颗粒内部吸水膨胀产生抗凝胶网络束缚的一种内在压力。因此,淀粉对于复合凝胶的充填效应与温度和淀粉颗粒大小有显著的相关性,淀粉颗粒越大,形成凝胶温度与淀粉糊化温度越接近,淀粉对凝胶的支撑效应越好,从而复合凝胶的强度越大。另外,随着添加量的增加,淀粉糊化需要吸收更多的水分,而肌原纤维蛋白体系中可利用的游离水分减少,淀粉不能充分糊化,导致凝胶强度降低。所以添加适量的淀粉可对淀粉-肌原纤维蛋白体系的凝胶强度起到促进作用,而当变性淀粉添加量大于8%时,过多的淀粉存在则会阻碍肌原纤维蛋白自身凝胶的形成,从而降低了整个体系的凝胶强度。
2.3 淀粉对肌原纤维蛋白保水性的影响
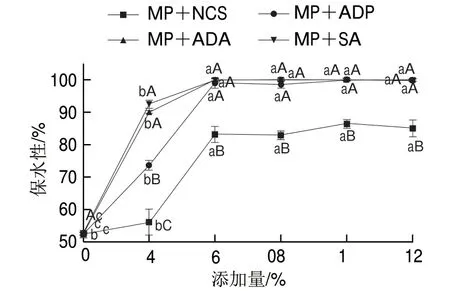
图 3 淀粉及添加量对肌原纤维蛋白保水性的影响Fig. 3 Effects of the type and amount of starches on water-holding capacity of MP
由图3可知,复合凝胶保水性随着淀粉添加量的增大呈先增大后平缓的趋势;淀粉添加量为4%时,SA与ADA保水性显著高于NCS(P<0.05);淀粉添加量达8%时淀粉-蛋白复合物保水性趋于稳定(P>0.05),变性淀粉保水性比NCS的保水性高约15%~18% (P<0.05)。结果表明,添加淀粉可显著提高肌原纤维蛋白的保水性,添加变性淀粉对保水性增强作用更佳,但淀粉添加量过高对肌原纤维蛋白保水性无显著促进作用,这与凝胶强度结果一致。这主要是因为ADP中均含有磷酸酯基团,可有效增加淀粉的膨润率[27],充分吸收蛋白脱水缩合出的水分,对复合蛋白凝胶体系起到支撑作用,Tong Qunyi等[28]也有类似的报道;ADA通过乙酰化变性引入乙酰基赋予淀粉产品更好的亲水性能,交联处理能增加淀粉颗粒分子内部和分子间的联系,增加了淀粉结构中交联的密度,促进了凝胶强度,从而提高了肌原纤维蛋白的保水性;SA中含有亲水性更强的羟基,在肌原纤维蛋白加热过程中,会吸收更多的水分,从而提高了吸水率。但添加量越大,蛋白变性后可供淀粉颗粒糊化吸收的水分减少,从而导致添加量越大,保水性无显著差异。另外,变性淀粉的糊化温度较原淀粉低,且淀粉结构显著不同,经升温加热后形成的淀粉-蛋白复合物结构也存在差异,从而导致水分子进入结构内部的难易程度不同,造成保水性不同。
2.4 淀粉种类对肌原纤维蛋白水分迁移的影响

图 4 淀粉及添加量对肌原纤维蛋白水分迁移的影响Fig. 4 Effects of the type and amount of starches on moisture migration of MP
如图4所示,T2弛豫时间反映水分的自由度,各状态下水分的结合状态和自由移动程度。从图4A可以看出,CK组T23(自由水)含量显著高于淀粉组,T23对应的水流动性较大,是位于高度组织化蛋白质结构内部的水以及存在于细胞间隙中能自由流动的水。添加淀粉后T22向慢弛豫时间上移动,弛豫速度降低,峰面积百分数逐渐增加;添加NCS的T22弛豫时间比添加变性淀粉弛豫时间长,但峰面积显著低于变性淀粉,添加ADA和SA的肌原纤维蛋白T22差异性不显著。T22向慢弛豫时间方向上移动是由于加入淀粉后经过加热保温而形成的凝胶网络限制了水分子的移动,从而往T22这部分的水移动性下降,加热后热诱导凝胶强度增大,从而限制了水分的移动,导致T22弛豫时间降低。另外,随着温度的升高,淀粉与蛋白质功能基团以离子键或氢键结合,吸取极性基团附近的水分,其中变性淀粉中含有的亲水性的乙酰基和羟基基团更易吸取水分,避免了氢键连接点的直接暴露,从而增强了邻近多肽非极性片段的疏水相互作用,进而稳定蛋白质的高级结构。此外,蛋白质内部各亚基疏水基团暴露与淀粉的疏水端结合,各亚基之前重新相互作用使得蛋白凝胶三维网络得以形成并束住水分[29]。
从图4B~E可以看出,淀粉添加量对肌原纤维蛋白水分迁移影响显著,随着添加量增加,ADP和ADA的T22值呈逐渐增大的趋势,在添加量为12%时达到最大值;而NCS和SA呈先增大后减小再增大的趋势,NCS和SA分别在添加量为12%和10%时达到最大值。T22峰面积随着添加量的增加而增大,说明自由水向不易流动水迁移,使得复合凝胶保水性提高,这可能是因为肌原纤维蛋白的正电荷和负电荷数量增大,形成较多与周围水分子结合的氢键结合位点,静电荷的增加也会造成肌丝的相互排斥,从而使肌原纤维蛋白膨胀,使得其中保留更多的水分。另外,弛豫时间受淀粉种类及添加量的作用影响较大,与NCS相比,添加变性淀粉可显著降低淀粉-蛋白复合物中水分的T2弛豫时间,ADA和SA的T2弛豫时间比ADP降低的更为显著。这归因于ADA和SA中的己二酸酯和羟基基团与肌原纤维蛋白中的功能基团相互作用较强,它们与分区表面的生物大分子相互作用的差异使其弛豫性质差异很大[15,30]。Brownstein等[31]认为水和大分子快速交换时,水大分子的距离决定了弛豫速度,距离增加使弛豫时间延长。因此,经加热后蛋白质聚集会降低水质子的弛豫时间,偶极子之间的相互作用会变弱,从而生物大分子阻碍了水分子的移动。
3 结 论
淀粉种类及添加量对肌原纤维蛋白的流变特性、凝胶强度、保水性和水分分布状态有显著影响。添加变性淀粉可显著提高肌原纤维蛋白变性的G’,可延迟肌原纤维蛋白变性温度1~4 ℃,添加ADA蛋白变性温度延长最大。添加小于10%的变性淀粉可显著提高淀粉-蛋白复合物的凝胶强度,原淀粉的添加量对肌原纤维蛋白的凝胶强度影响不显著,添加8% ADA的淀粉-蛋白复合物凝胶强度显著高于其他实验组。变性淀粉-蛋白复合物的保水性优于原淀粉,SA-蛋白复合物与ADA-蛋白复合物保水性较好。当淀粉添加量超过6%时,添加量对肌原纤维蛋白的保水性无显著影响。另外,变性淀粉可降低肌原纤维蛋白水分子的弛豫时间和移动性。因为变性淀粉于肌原纤维蛋白中经加热可使蛋白质分子展开、聚集,正负电荷数量增大,形成较多的与周围水分子结合的氢键结合位点,使得多肽链之间的氢键更佳稳定,促进形成更稳定的三维网络结构,肌原纤维蛋白的膨胀,从而保留了更多的水分。
