掌叶覆盆子诱导培养的抗褐化研究
2020-02-07王云冰江景勇
王云冰,江景勇,2
(1.台州科技职业学院 园艺植物研究所,浙江 台州 318020; 2.台州市农业科学研究院,浙江 台州 317000)
掌叶覆盆子(RubuschingiiHu)又称华东覆盆子,俗称大号角公、牛奶母等,为蔷微科悬钩子属,叶形多为五裂似掌状。掌叶覆盆子是“药果同源”植物,成熟果可食用,未成熟果实可入药,是194种悬钩子属植物中唯一入选《中国药典》的覆盆子,具有益肾、固精、缩尿、养肝明目等功能,有着极大的开发潜力和广阔的市场前景。掌叶覆盆子种苗繁育多采用扦插、压条和根蘖繁殖等[1],但繁育效率低,品种易混杂。通过组培快繁育苗不仅能保证品种纯正,还能快速高效提供优质种苗,以满足市场需求。
掌叶覆盆子组织培养中外植体褐化现象较普遍。外植体褐化是一种酶促褐变,多酚氧化酶被激活,从而使植物体中的酚类物质聚合产生的醌类物质,从而影响离体材料的现象[2]。褐化是导致外植体培养材料死亡的主要原因,这直接影响到种苗的繁育及成本[3]。在不同培养基成分中,采用抗氧化剂及吸附剂,其外植体的褐化程度表现各异[2]。大花香水月季、牡丹、芍药等在组培上已有较系统的抗褐化研究[4-6],而掌叶覆盆子主要针对建立相应的各阶段培养基配方研究较多[1,7-8],有关褐化问题的研究鲜见报道。
外植体褐化受取材部位及培养基类型的影响。吸附剂和抗氧化剂等抗褐化剂会减轻外植体的褐化程度,常用的有抗坏血酸(Vc)、柠檬酸、活性炭(AC)、聚乙烯吡咯烷酮(PVP)等[3]。低温预处理对降低褐变有一定作用[7]。本试验通过对掌叶覆盆子茎段组织培养中不同的外植体部位、培养基、抗褐化物质及低温黑暗等处理,对掌叶覆盆子的抗褐化方案进行了研究。
1 材料与方法
1.1 材料
选取台州地区优良掌叶覆盆子进行组培,选取根蘖芽段、带芽枝段、当年生茎段为外植体。不同试验材料取材时间为3月10日至7月10日。
1.2 方法
1.2.1 材料处理
将采取的掌叶覆盆子材料在肥皂水中用软毛刷清洗,然后在自来水中冲洗1 h。将根蘖芽或枝条剪成长约2 cm的带芽茎段,枝芽直接消毒,用75%的酒精浸泡摇动处理50 s,无菌水冲洗3次,再用0.1%的升汞溶液浸泡震动8 min,无菌水冲洗3次,备用。
1.2.2 培养条件
光照强度2 000~4 000 lx,每天光照12 h,培养室温度(25±2) ℃,培养基蔗糖用量30 g·L-1,琼脂用量6 g·L-1,pH为5.8,培养基使用的激素种类和用量为6-BA 1.5 mg·L-1+NAA 0.2 mg·L-1。
1.2.3 处理设计
不同外植体试验。培养基为1/2MS,T1、T2、T3处理分别为带芽枝段、根蘖芽段和当年生茎段,采集时间分别为3、4、7月。T4、T5、T6 4 ℃低温处理时间分别为0、24、48 h,材料为茎段。
不同培养基处理。将茎段切去两端接种于不同基础培养基上,分别为T7(1/4MS)、T8(1/2MS)、T9(MS)、T10(WPM)。
不同抗褐化剂处理[4-5]。培养基为1/2MS,处理T11、T12、T13对应加入Vc浓度分别为50、100、150 mg·L-1;处理T14、T15、T16对应加入PVP浓度分别为1、2、3 g·L-1。
1.2.4 测定指标
培养基采用单因素试验,每处理20个外植体,重复3次。外植体接种10 d后统计褐化率、出芽数,接种20 d后进行生长势评价。褐化致死外植体个数计为褐化数;侧芽萌发外植体个数计为萌发数;生长势评价指标包括芽长、叶数、叶色、叶形等,从低到高共1~5级,3次评价取平均值[4]。
2 结果与分析
2.1 外植体不同取材部位培养对抗褐化的影响
掌叶覆盆子外植体不同部位取材培养的生长状况差异较大。由图1可见,根蘖芽段直径较大,组织较嫩,褐化程度最高,褐化发生在3 d后,之后多数组织全部褐化;带芽枝段头尾部分褐化,生长停滞;而当年生枝段长出新芽,生长旺盛。

图1 外植体不同部位培养生长情况
由图2可见,生长势评价表明,当年生茎段最佳,带芽茎段其次,且两者相差不大,而根蘖芽段最差;从出芽后生长后期可知,对带芽茎段和当年生茎段芽生长影响不大,但对根蘖芽段后期生长仍有影响。从褐化情况看,根蘖芽段褐化率达到87.7%,带芽枝段居中,当年生茎段最低,为14.8%;当年生茎段出芽率达到85.2%,带芽枝段为45.3%,根蘖芽段最低,这也许与幼嫩组织酚类含量高有关。木本植物褐化发生与外植体体内酚类物质的含量呈正相关[9-10],而带芽茎段为冬季休眠茎段,少量褐化对其生长也有一定影响,而采自7月生长季当年生茎段相对于前两者生长力旺盛,褐化少,这与李焕秀等[9]得出的5月以后外植体的褐变率逐渐降低的结论一致。

图2 外植体不同部位培养抗褐化情况
2.2 不同基本培养基对外植体抗褐化的影响
从表1可以看出,在其他培养基条件相同的情况下,掌叶覆盆子外植体茎段在4种不同基础培养基上长势有所不同。其中,1/4MS培养基褐化率最低,为14.3%,出芽率为85.7%;1/2MS培养基褐化率与之相近;MS培养基褐化率最高,为47.1%,出芽率为52.9%,而WPM培养基与其接近。从生长势评价来看,1/4MS培养基后期生长叶色略黄,生长芽心抽生速度慢,而其他三类培养基在出芽后生长较为稳定,生长旺盛,叶色浓绿。综合来看,1/2MS培养基较为理想,这与李纯佳等[4]研究的大花香水月季在WPM培养基中褐化率最低有所不同,但在MS培养基最高这点上是一致的,这可能与植物种类培养特性差异有关系。
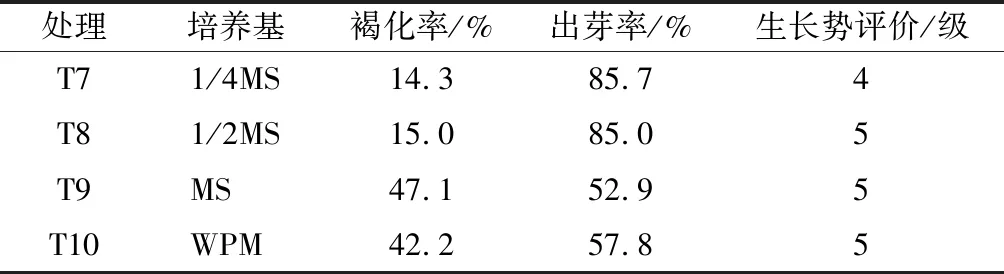
表1 不同培养基条件下外植体抗褐化情况
2.3 抗褐化剂对抑制外植体抗褐化的影响
通过两种抗褐化剂的不同水平处理观察掌叶覆盆子外植体在培养基上的生长情况可知(图3),在不同浓度的抗坏血酸(Vc)处理中,T12处理Vc含量为100 mg·L-1时,褐化率仅为7.5%,出芽率达到92.5%;结果显示,褐化情况随着浓度升高呈先下降后上升趋势。不同浓度PVP处理中,T14中PVP含量为1 g·L-1时褐化率最低,为15.0%,出芽率为85%;PVP浓度升至3 g·L-1时,其生长迟滞,叶片黄绿,芽细弱,生长势有所下降,这与李纯佳等[4]的研究结果一致。总体上讲,Vc作为抗氧化剂对于掌叶覆盆子抗褐化效果较为明显,作用浓度为100 mg·L-1,而通过吸附起作用的PVP为其次,作用浓度为1 g·L-1最佳。
2.4 黑暗低温处理时数对外植体抗褐化的影响
图4显示,在不同黑暗低温处理下,24 h黑暗低温处理效果明显,其褐化率仅为5.0%,出芽率高达95%,而未进行黑暗低温处理的材料褐化率有34.0%,处理48 h的掌叶覆盆子材料其褐化率较之有所提升,后期生长势观察评价表明,黑暗低温处理48 h的生长势受到一定影响,出芽速度慢,叶片展开较慢,生长势弱,而前两者处理在出芽后的生长中长势均较为良好。可见,适度的黑暗低温处理对掌叶覆盆子抗褐化培养比较重要,以24 h为宜,处理时间过长对生长不利。

图4 不同黑暗低温处理时间下外植体生长情况
3 小结
试验发现,选择适宜的外植体部位,不同的基本培养基、抗褐化剂及黑暗低温处理都对掌叶覆盆子抗褐化有一定的减缓作用,但通过某一因素的调节均不能对外植体褐化起到绝对的抑制作用,这与外植体褐化发生影响因素较多有关。植物组培褐化的发生与植物基因型、外植体及培养条件等内外因因素有关[3]。在不同部位的外植体培养中,当年生茎段褐化率低,仅为14.8%,生长势评价等级为5级,长势较佳;同等激素水平下,虽然前期1/4MS培养基褐化率略低,但权衡考虑生长势评价情况,最佳基础培养基配方应为1/2MS,其褐化率为15.0%。不同抗褐化剂处理结果显示,掌叶覆盆子茎段对Vc 100 mg·L-1的培养基抗褐化效果最好,而PVP 1 g·L-1时抗褐化效果较好,褐化率为15%,浓度增加对生长不利,这与李萍等[5]的结果一致,实际操作中考虑出芽后转接至新的培养基中为宜。黑暗低温处理最佳时间为24 h,出芽率达到95%,超过24 h对其生长势影响较大,原因可能与长期低温造成植物组织损伤有一定关系[4]。
综上所述,通过各单因素试验,基本得出掌叶覆盆子减轻褐化的基本方法,有一定的实际意义。但以上试验表明,没有一种单因素足以使其外植体褐化率降至0,这需要综合考虑几个因素的叠加、协同效应,有待于进一步的多因素试验。
