基于超高效液相色谱-高分辨质谱联用技术研究冠心病及冠心病合并2型糖尿病患者代谢特征
2020-02-06任繁栋丁筱雪蔡芳任达兵易伦朝张宏
任繁栋 丁筱雪 蔡芳 任达兵易伦朝 张宏
摘 要 采用超高效液相色谱-四极杆-轨道阱质谱联用技术开展冠心病及冠心病合并2型糖尿病患者的血浆代谢组学研究,以探寻冠心病及冠心病合并2型糖尿病患者的代谢特征,为基于代谢组学的临床治疗方案优化奠定基础。本研究鉴定出78种血浆中的内源性代谢物。在代谢物定性与定量分析基础上,结合偏最小二乘-判别分析和变量重要性投影等方法,筛选出20种区分健康人和冠心病患者的潜在特征代谢物、35种区分冠心病及冠心病合并2型糖尿病患者的潜在特征代谢物、37种区分健康人和冠心病合并2型糖尿病的潜在特征代谢物。代谢通路分析结果表明,氨基酸代谢在这两类患者的生理代谢过程中发挥重要作用,而脂肪酸代谢很可能与冠心病合并2型糖尿病相关。
关键词 冠心病; 冠心病合并2型糖尿病; 超高效液相色谱-高分辨质谱联用技术; 代谢组学; 化学计量学
1 引 言
目前,冠心病(Coronary heart disease, CHD)是世界范围内危害最大的心血管疾病,也是我国成年人心脏病住院和死亡的首要原因[1~3]。近十年来,由于人口规模和老龄化程度加剧,冠心病的患病率逐年上升[4,5]。冠心病是一种由遗传和环境因素相互作用引起的复杂性代谢紊乱疾病[6,7]。2型糖尿病(Type 2 diabetes mellitus, T2DM)是冠心病患者常见的合并症。研究表明,冠心病合并2型糖尿病(Coronary heart disease-type 2 diabetes mellitus, CHD-T2DM)患者的死亡率远高于单纯的冠心病患者[8]。揭示冠心病及冠心病合并2型糖尿病患者的代谢特征可帮助了解机体在病变过程中代谢的改变, 研究结果可辅助临床治疗方案的确定,有助于针对不同类型患者提出差异性的治疗方案[4,9]。
代谢组学有助于全面了解生物系统中小分子代谢物在病理、生理刺激条件下的变化,是研究生命过程中内源性小分子的有效手段[10~13]。近年来,代谢组学已应用于冠心病的发病机理及临床诊断等研究[14,15]。然而,代谢组学在冠心病合并2型糖尿病方面的研究报道仍较少。超高效液相色谱-高分辨质谱联用技术(Ultra-high performance liquid chromatography-high resolution mass spectrometry, UPLC-HRMS)是代谢组学研究的有力工具[16],如采用UPLC-HRMS灵敏快速地分析不同生物样本中的25种氨基酸[17],可快速定性与定量分析多种脂类物质[18],在2 min内可检测到二百余种细胞提取物中的主要代谢物[19]。由此可见,UPLC-HRMS可用于分析生物样本中种类繁多的多种代谢物,具有高灵敏度、高分辨率、高通量的特点,可为代谢物的定性与定量分析提供丰富的信息。
本研究采用UPLC-HRMS技术对健康人(Healthy control, HC)、冠心病患者(CHD)及冠心病合并2型糖尿病患者(CHD-T2DM)进行血浆代谢组学研究。在对代谢物进行定性与定量分析的基础上,结合主成分分析(Principal component analysis, PCA)、偏最小二乘-判别分析(Partial least squares-discriminant analysis, PLS-DA)[20]等方法对健康人与冠心病患者、冠心病与冠心病合并2型糖尿病患者、健康人与冠心病合并2型糖尿病患者进行区分,并结合特征代谢物筛选和代谢通路分析,探寻冠心病及冠心病合并2型糖尿病患者的代谢特征。
2 实验部分
2.1 仪器与试剂
Q-Exactive Focus轨道离子阱高分辨质谱仪、UltiMate 3000超高效液相色谱仪(赛默飞世尔科技公司); 超声波清洗机(天津市恒奥科技发展有限公司); 电子分析天平(上海梅特勒-托利多仪器有限公司)。乙腈、甲酸、甲醇(质谱级,德国Merck公司)。21种标准品(纯度>98%),其中,柠檬酸购自美国Supelco公司,溶血磷脂类物质购自美国Avanti公司,其余的标准品购自美国Sigma公司。标准品的详细信息见电子版文后支持信息表S1。
2.2 实验方法
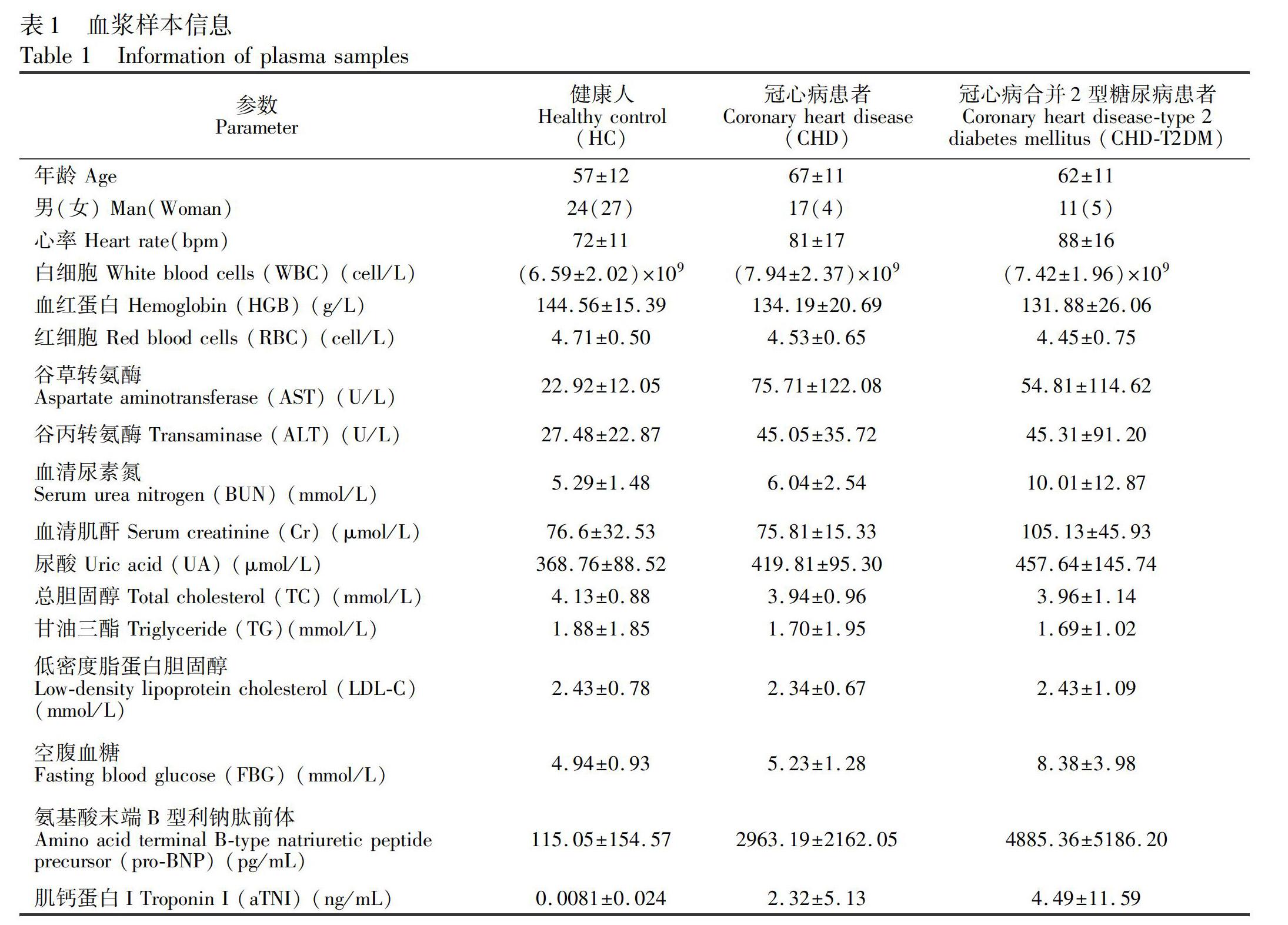
2.2.1 样品的采集与制备 51例健康人、21例冠心病患者和16例冠心病合并2型糖尿病患者,共88个血浆样本收集于云南省第一人民医院心血管内科。入组的患者,冠状动脉造影單支血管狭窄>50%[21]。冠心病合并2型糖尿病患者除依据冠心病的诊断标准外,结合2型糖尿病的诊断标准入组。此组患者清晨空腹血糖 ≥ 7.0 mmol/L,75 g葡萄糖摄入2 h后血糖 ≥11.1 mmol/L [22]。研究中,排除了患有器质性心脏病、肝功能不全、严重感染或恶性肿瘤、甲亢或任何其他自身免疫性疾病的参与者。血浆样本均在清晨,空腹8 h后,经由肘静脉采取(肝素锂抗凝),4℃静置3 h,以3000 r/min离心20 min,取上清液,-80℃冻存。具体的样本信息如表1所示。此项目通过云南省第一人民医院伦理委员会审查,参与人员均已签署知情同意书。
2.2.2 血浆样本前处理 将血浆样本从-80℃取出,缓慢解冻并涡旋1 min,取20 μL转移至离心管中,加入500 μL冷的质谱级甲醇和10 μL 1 mg/mL的内标(2-异丙基苹果酸)溶液,涡旋1 min,室温静置10 min,在4℃条件下,14500 r/min离心10 min,取上清液,在室温下用氮气吹干,使用100 μL 质谱级甲醇复溶,涡旋1 min,并转入带有内衬管的进样瓶中,待进样。
质量控制样本(Quality control, QC)的制备: 从88个血浆样本中各取2 μL并混合均匀,加入1000 μL冷的质谱级甲醇沉淀蛋白,后续处理步骤与血浆样本的处理过程一致。将其作为QC样本。测定过程中,每隔3个样本进一针QC样本,QC样本共进样29次,用于评价整个分析过程仪器和样本的稳定性[23]。
2.2.3 色谱条件 超高效液相色谱系统使用 ACE UPLC C18色谱柱(150 mm×3.0 mm,3 μm)进行反相分离。 流动相A为0.1%(V/V)甲酸溶液, 流动相B为乙腈。流速: 0.20 mL/min。柱温: 40℃,进样体积: 1 μL。梯度洗脱: 2~9 min,5%~38% B; 9~14 min,38%~68% B; 14~22 min,68%~100% B; 22~30 min,100%~5% B。
2.2.4 质谱条件 高分辨质谱相关参数设置如下: 离子源采用電喷雾电离源,喷雾电压: 3500 V(-),4000 V(+); 雾化温度: 300℃; 雾化气(鞘气)压力: 4.5 MPa(+),4.0 MPa (-); 辅助气压力: 1.5 MPa(+),1.0 MPa(-); 传输毛细管温度:350℃(+),320℃(-); 扫描模式: 全扫描(Full MS),分辨率35000,源内诱导裂解电压0 eV; 数据依赖二级扫描(ddms2),分辨率17500,高能碰撞诱导电压: 15、25和35 eV。
2.2.5 数据处理 代谢物定性分析: 对于有标准品的代谢物,通过与标准品的一级质谱、二级质谱数据及保留时间比对,实现对样本中代谢物的准确定性分析。对于其它的质谱特征,通过分析一级质谱和二级质谱信息,并结合数据库匹配,如Mass Bank、人类代谢组学数据库(HMDB)等实现定性分析。
代谢物定量分析: MZmine是目前分析质谱数据使用最广泛的一种工具,其运行相对稳定,操作简单,对计算机性能的要求相对较低,可对数据进行准确、高效地处理[24]。本研究基于定性的78种血浆内源性代谢物,使用MZmine2.32提取其保留时间、质荷比、峰强度及峰面积,MZmine2.32的具体参数见电子版文后支持信息表S2, 并采用内标法[25]实现78种代谢物的相对定量分析。
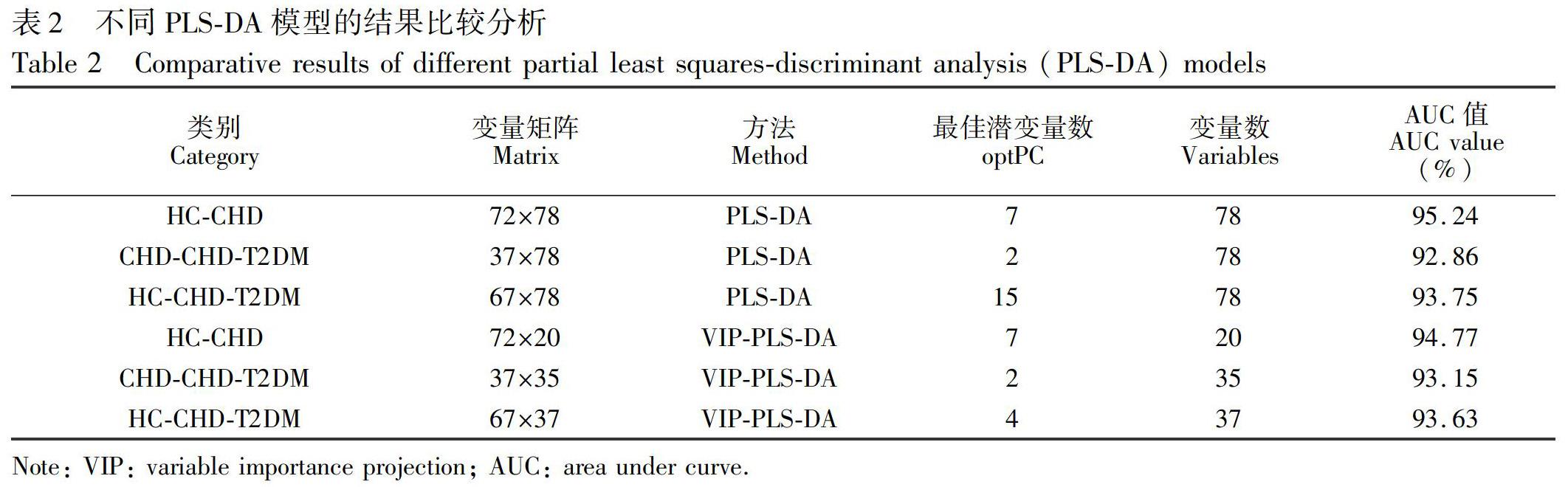
分类模型的建立: 使用MATLAB软件和实验室自编的PCA程序分析了QC、HC、CHD及CHD-T2DM的聚类情况。在此基础上,使用实验室自编的PLS-DA程序建立HC与CHD、CHD与CHD-T2DM及HC与CHD-T2DM的两两分类模型。数据经过自标度化(Autoscaling)预处理,并由十折交互检验得到最佳潜变量数(optPC),使用ROC(Receiver operating characteristic)曲线的曲线下面积(Area under curve, AUC)判断模型的质量[8]。
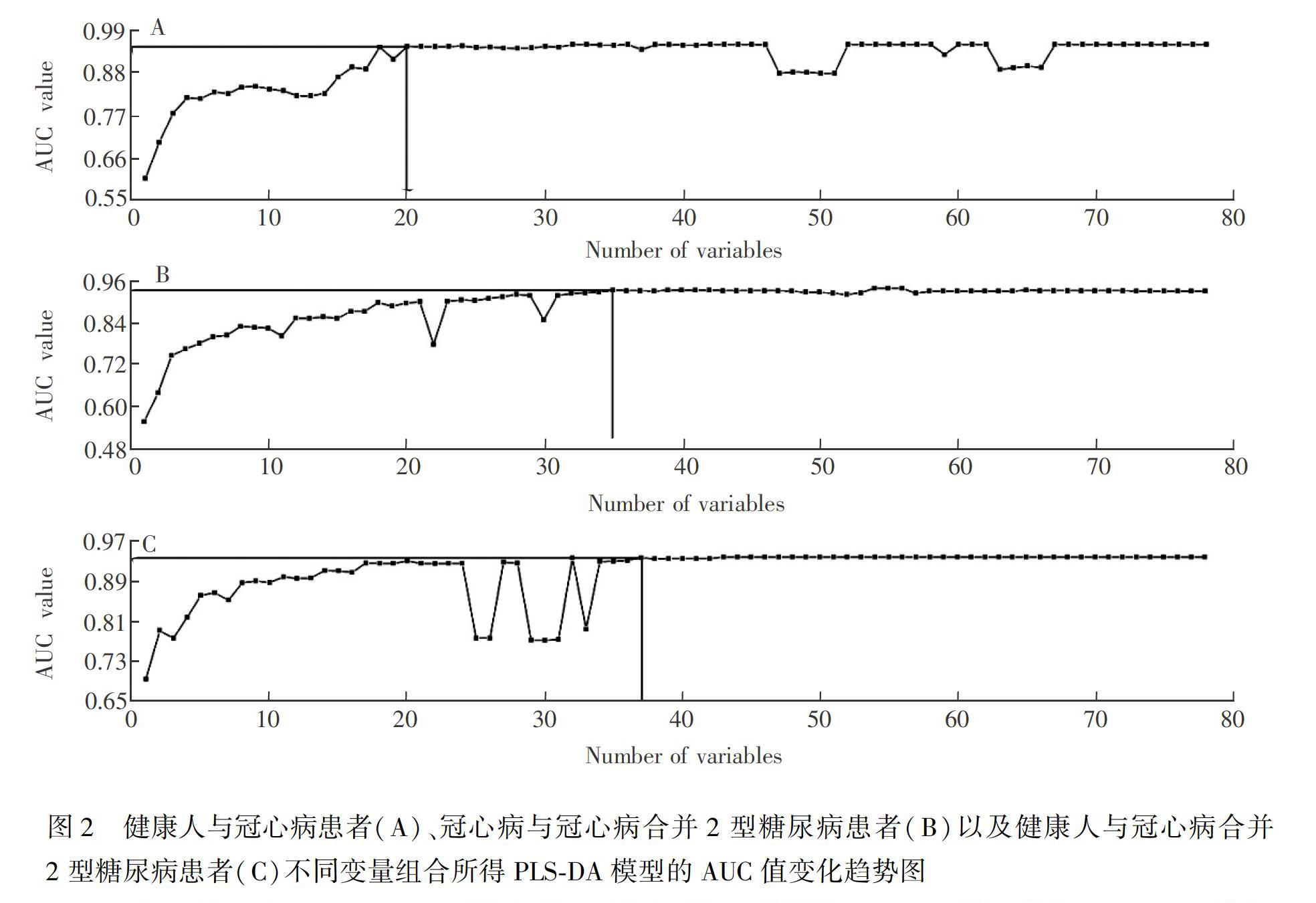
特征代谢物筛选: 在PLS-DA模型的基础上,将变量重要性投影(Variable importance projection, VIP)与AUC值相结合筛选特征代谢物[26]。PLS-DA模型中,某个变量(代谢物)的VIP值越大,代表该变量对分类的贡献就越大。将变量的VIP值进行排序,再通过比较不同变量组合的分类能力,选取最佳的变量个数。具体方法如下: 对变量的VIP值排序,选取的第一个组合为VIP值最大的变量,第二个组合是VIP值最大的变量加上第二个变量,第三个组合是前三个变量,以此类推。随着变量增多,AUC值逐渐增大,当变量组合到一定数目时,AUC值达到最大,并且随着变量个数的增加,AUC值不再增大。
代谢通路分析: 采用网络版的MetaboAnalyst[27] (https://www.metaboanalyst.ca/)分析相关代谢通路。具体的操作过程如下: 将上述得到的特征代谢物名称输入至MetaboAnalyst的Pathway Analysis中; 在Over Representation Analysis中选择Hypergeometric Test算法,Pathway Topology Analysis用Relative-betweeness Centrality算法。最后进行代谢通路匹配,得到代谢通路图,其中横坐标代表代谢通路的影响值(Pathway impact),纵坐标显示了富集分析(Enrichment analysis)的P值。
3 结果与讨论
3.1 代谢物的定性与定量分析
首先通过QC样本评估UPLC-HRMS数据的质量[28]。主成分分析的结果表明(见电子版文后支持信息图S1),QC样本分布在HC、CHD、CHD-T2DM的样本分布范围内,且聚类效果良好,说明数据的采集具有良好的重复性和稳定性。结合标准品和数据库,从HC、CHD、CHD-T2DM的血浆样本中共定性分析出78种内源性代谢物(见电子版文后支持信息表S3)。其中,20种代谢物通过标准品进行定性归属,58种代谢物通过比对数据库以及代谢物的色谱和质谱特征进行定性归属。
使用MZmine2.32提取88个血浆样本中78种代谢物的保留时间、质荷比、峰强度及峰面积,并采用内标法进行相对定量分析。从总离子流图(Total ion chromatograms, TIC)的直观比较可见,一些谱峰在三类样本间存在明显的差异(见图1)。采用t检验评价各内源性代谢物在HC与CHD、CHD与CHD-T2DM、HC与CHD-T2DM的血浆中是否有显著性差异。结果表明,78种代谢物中,有3种代谢物在HC与CHD间存在显著性差异,9种代谢物在CHD与CHD-T2DM间存在显著性差异,17种代谢物在HC与CHD-T2DM间存在显著性差异(见电子版文后支持信息表S3)。
3.2 特征差异性代谢物筛选
采用PLS-DA方法建立HC与CHD的分类模型,AUC值为95.24%(表2)。在此基础上,采用VIP方法筛选特征差异性代谢物。当以VIP值最大的甘氨熊去氧胆酸(Glycoursodeoxycholic acid)作为第一个变量组合时,建立模型的十折交互检验的AUC值仅为60.78%,随着变量增多,AUC值逐渐增加,当代谢物增加到20种时,AUC值为94.77%(表2),并且随着变量数增加,AUC值呈相对稳定状态(图2A)。最终筛选出区分HC与CHD的20种特征差异性代谢物(见电子版文后支持信息表S3)。
采用PLS-DA方法建立CHD與CHD-T2DM的分类模型,AUC值为92.86%(表2)。采用同样的方法筛选特征差异性代谢物,以VIP值最大的代谢物2-戊酮酸(Ketovaleric acid)作为第一个变量组合时,AUC值为55.36%,当变量组合增加到35个时,PLS-DA模型的AUC值为93.15%(表2),并且随着变量数增多,AUC值呈稳定趋势(图2B)。最终筛选出区分CHD与CHD-T2DM的35种潜在特征差异性代谢物(见电子版文后支持信息表S3)。
采用PLS-DA方法建立HC与CHD-T2DM的分类模型,AUC值为93.75%(表2)。以VIP值最大的代谢物吡咯烷(Pyrrolidine)作为第一个变量组合时,AUC值为69.30%,当变量组合增加到37个时,PLS-DA模型的AUC值为93.63%(表2),并且随着变量数增多,AUC值呈稳定趋势(图2C)。最终筛选出区分HC与CHD-T2DM的37种潜在特征差异性代谢物(见电子版文后支持信息表S3)。
3.3 代谢通路分析
将区分HC与CHD的20种特征代谢物、区分CHD与CHD-T2DM的35种特征代谢物和区分HC与CHD-T2DM的37种特征代谢物导入MetaboAnalyst中进行相关代谢通路分析(图3)。由图3可知,在HC与CHD中,组氨酸代谢,甘氨酸、丝氨酸和苏氨酸代谢,精氨酸和脯氨酸代谢,氨酰生物合成,这4个生物代谢途径对冠心病的影响比较大(图3A); 在CHD与CHD-T2DM中,亚油酸代谢,丙氨酸、天冬氨酸和谷氨酸代谢,泛酸盐和乙酰辅酶A的生物合成,这3个生物代谢途径的影响较大(图3B); 在HC与CHD-T2DM中,苯丙氨酸、酪氨酸和色氨酸的生物合成,亚油酸代谢,D-谷氨酰胺和D-谷氨酸代谢,苯丙氨酸代谢,丙氨酸、天冬氨酸和谷氨酸代谢,这5个生物代谢途径影响较大(图3C)。
甘氨酸在代谢过程中,可转变为丝氨酸、甘胺胆酸、胆碱、肌酸等,其中,胆碱在生物体内通过与二酰甘油结合生成磷脂酰胆碱。丝氨酸经过脱羧反应生成胆胺,胆胺甲基化后与胆碱激酶结合生成磷酸胆碱。磷酸胆碱类物质合成异常可增加患心血管疾病的风险[29]。精氨酸是动物细胞中用途最广泛的一种氨基酸,可作为合成NO的前体物质。NO是重要的内皮源性舒张因子(Endothelium-derived relaxing factor, EDRF),可扩张血管,有效降低冠心病的发病率。有研究指出,在大鼠实验中增加精氨酸的量,还可显著降低脂肪含量[30]。丙氨酸经过转氨作用产生的丙酮酸,可进入三羧酸循环,也可转变为葡萄糖,还可生成谷氨酸。谷氨酸代谢异常与冠心病合并2型糖尿病密切相关[31]。
总体而言,氨基酸不仅是酶的重要底物,而且是重要的调节因子,包含反映身体新陈代谢和功能状态的重要生化信息[32]。氨基酸代谢在冠心病患者的生理代谢中起重要作用[33],在人体内分解,可通过脱氨产生酮酸和氨。生成的酮酸可转变成糖及脂肪,此过程是由酮酸在代谢过程中产生乙酰辅酶A,乙酰辅酶A可合成脂肪酸。脂肪酸可通过与甘油结合生成脂肪,而脂质积累和聚集与冠心病的主要病因动脉粥样硬化关系密切[30]。机体内氨基酸通过脱氨反应生成的氨,在血液中并不是以游离的NH3形式存在的,而是通过氨酰生物合成的产物在血液中运输。在氨基酸的分解代谢中,有的酮酸具有产生糖的潜力,其中丙氨酸、天冬氨酸和谷氨酸为生糖氨基酸。生糖氨基酸不仅可生成糖,还可直接或间接生成丙酮酸,丙酮酸不但可转变为甘油,而且也可在氧化脱羧后变成乙酰辅酶A从而生成脂肪酸。近年来一些研究表明,精氨酸和脯氨酸代谢,甘氨酸、丝氨酸和苏氨酸代谢,丙氨酸、天冬氨酸和谷氨酸代谢,丙酮酸代谢,这4个代谢通路受到干扰可能导致冠心病合并2型糖尿病的发生[31]。由此可知,氨基酸代谢对冠心病合并2型糖尿病的发生具有重要影响[30]。
除此之外,脂肪酸代谢可能由于脂质代谢异常使体内积累大量酮体,脂肪酸的β氧化进程减慢,减少了乙酰辅酶A的生成,从而影响三羧酸循环,导致糖代谢出现异常,所以脂肪酸代谢在冠心病合并2型糖尿病患者中也可能起重要作用。在人体内脂肪酸可通过一系列生化反应生成胆固醇,胆固醇代谢异常可导致心血管疾病的发生。
4 结 论
本研究利用 UPLC-HRMS的高通量分析优势,检测出78种血浆内源性代谢物。在此基础上,结合PLS-DA和VIP法,筛选出区分健康人与冠心病患者的20种潜在特征代谢物,区分冠心病和冠心病合并2型糖尿病患者的35种潜在特征代谢物,区分健康人和冠心病合并2型糖尿病患者的37种潜在特征代谢物。代谢通路分析表明,氨基酸代谢很可能对冠心病的病变发展起重要作用,而脂肪酸代谢对冠心病合并2型糖尿病患者的代谢紊乱也可能起重要作用。本研究结果为深入研究冠心病及其合并症的代谢紊乱问题提供了基础数据,也为基于代谢组学的临床治疗方案优化提供了有价值的信息。
References
1 Daghem M, Bing R, Fayad Z A, Dweck M R.JACC-Cardiovasc. Imag., 2019, 033: 1-14
2 Kostara C E, Papathanasiou A, Psychogios N, Cung M T, Elisaf M S, Goudevenos J, Bairaktari E T.J. Proteome Res., 2014, 13(5): 2585-2598
3 Xu X, Gao B, Guan Q, Zhang D, Ye X, Zhou L, Tong G, Li H, Zhang L, Tian J, Huang J. J. Pharmaceut. Biomed., 2016, 129: 34-42
4 PANG Bo, WANG Bin, SHU Zhen-Bo, YAO Xiao-Xiao, ZHANG Guo-Dong, HU Cong, WU Sui-Sheng. Chinese J. Anal. Chem., 2017, 45(8): 1165-1171
龐 博, 王 斌, 舒振波, 姚小晓, 张国栋, 扈 聪, 吴绥生. 分析化学, 2017, 45(8): 1165-1171
5 Barderas M G, Laborde C M, Posada M, de la Cuesta F, Zubiri I, Vivanco F, Alvarez-Llamas G. J. Biomed. Biotechnol., 2011: 790132
6 DeRatt B N, Ralat M A, Lysne V, Tayyari F, Dhar I, Edison A S, Garrett T J, Midttun O, Ueland P M, Nygard O K, Gregory J F.J. Nutr., 2017, 147(9): 1658-1668
7 Huang L, Zhang L, Li T, Liu Y W, Wang Y, Liu B J. Sci. Rep., 2018, 8(1): 12958
8 Wu T, Xie G, Ni Y, Liu T, Yang M, Wei H, Jia W, Ji G. J. Proteome Res., 2015, 14(1): 447-456
9 Zhou H, Li L, Zhao H, Wang Y, Du J, Zhang P, Li C, Wang X, Liu Y, Xu Q, Zhang T, Song Y, Yu C, Li Y.J. Proteome Res., 2019, 18(5): 1994-2003
10 JIANG Ming-Chen, WANG Shou-Chuan, XU Shan, XU Qiu-Yue, SHAN Jin-Jun, XIE Tong, PENG Lin-Xiu, DAI Qi-Gang. Chinese J. Anal. Chem., 2018, 46(6): 969-974
姜茗宸, 汪受传, 徐 珊, 徐秋月, 单进军, 谢 彤, 彭琳秀, 戴启刚. 分析化学, 2018, 46(6): 969-974
11 Shao F J, YingY T, Tan X, Zhang Q Y, Liao W T.J. Proteome Res., 2018, 17(10): 3445-3453
12 WU Yan, ZHANG Xi, ZHANG Jie, ZHANG Xue-Qin, SHEN He-Qing. Chinese Journal of Chromatography, 2019, 37(8): 890-903
吴 衍, 张 西, 张 洁, 张雪芹, 申河清. 色谱, 2019, 37(8): 890-903
13 ZHENG Si-Jia, WANG Qing-Qing, WANG Xiao-Lin, ZHAO Xin-Jie, XU Guo-Wang.Chinese J. Anal. Chem., 2017, 45(12): 1921-1929
郑思佳, 王晴晴, 王晓琳, 赵欣捷, 许国旺. 分析化学, 2017, 45(12): 1921-1929
14 Huang M, Zhao H, Gao S, Liu Y, Liu Y, Zhang T, Cai X, Li Z, Li L, Li Y, Yu C. Clin. Chim. Acta, 2019, 497: 95-103
15 Wu G S, Li H K, Zhang W D. Chin. J. Nat. Med., 2019, 17(5): 321-330
16 Boyce M C, Lawler N G, Tu Y, Reinke S N. J. Chem. Educ., 2019, 2019(4): 745-750
17 Casado M, Sierra C, Batllori M, Artuch R, Ormazabal A.Metabolomics, 2018, 14(6): 76
18 Scherer M, Leuthauser-Jaschinski K, Ecker J, Schmitz G, Liebisch G.J. Lipid Res., 2010, 51(7): 2001-2011
19 Guder J C, Schramm T, Sander T, Link H. Anal. Chem., 2017, 89(3): 1624-1631
20 Ferreiro-González M, Espada-Bellido E, Guillén-Cueto L, Palma M, Barroso C G, Barbero G F.Talanta, 2018, 188: 288-292
21 Lu J, Chen B, Chen T, Guo S, Xue X, Chen Q, Zhao M, Xia L, Zhu Z, Zheng L, Yin H.Redox. Biol., 2017, 12: 899-907
22 Omori K, Katakami N, Yamamoto Y, Ninomiya H, Takahara M, Matsuoka T A, Bamba T, Fukusaki E, Shimomura I.J. Atheroscler. Thromb., 2019, 26(3): 233-245
23 Broadhurst D, Goodacre R, Reinke S N, Kuligowski J, Wilson I D, Lewis M R, Dunn W B.Metabolomics, 2018, 14(6): 72
24 Olivon F, Grelier G, Roussi F, Litaudon M, Touboul D.Anal. Chem., 2017, 89(15): 7836-7840
25 Liao H W, Chen G Y, Wu M S, Liao W C, Lin C H, Kuo C H.J. Proteome Res., 2017, 16(2): 1097-1104
26 Sankar M.Anal. Chem., 2008, 80(19): 7562-7570
27 Chong J, Soufan O, Li C, Caraus I, Li S, Bourque G, Wishart D S, Xia J.Nucleic Acids Res., 2018, 46(W1): 486-494
28 LIU A-Na, ZHAO Wen-Xiao, GONG Li-Li, YU Rui-Xue, CUI Ning, CHEN Er-Dong, JI Xu-Ming, WANG Shi-Jun, JIANG Hai-Qiang. Chinese J. Anal. Chem., 2017, 45(4): 537-544
劉阿娜, 赵文晓, 巩丽丽, 于瑞雪, 崔 宁, 陈迩东, 季旭明, 王世军, 蒋海强. 分析化学, 2017, 45(4): 537-544
29 Liu X, Gao J, Chen J, Wang Z, Shi Q, Man H, Guo S, Wang Y, Li Z, Wang W.Sci. Rep., 2016, 6: 30785
30 Feng Q, Liu Z, Zhong S, Li R, Xia H, Jie Z, Wen B, Chen X, Yan W, Fan Y, Guo Z, Meng N, Chen J, Yu X, Zhang Z, Kristiansen K, Wang J, Xu X, He K, Li G. Sci. Rep., 2016, 6: 22525
31 Fried P J, Pascual-Leone A, Bolo N R. Clin. Neurophysiol., 2019, 130(9): 1502-1510
32 Zhou H, Li L, Zhao H, Wang Y, Du J, Zhang P, Li C, Wang X, Liu Y, Xu Q, Zhang T, Song Y, Yu C, Li Y.J. Proteome Res., 2019, 18(5): 1994-2003
33 Shearer J, Duggan G, Weljie A, Hittel D S, Wasserman D H, Vogel H J.Diabetes Obes. Metab., 2008, 10(10): 950-958
Abstract Ultra-high performance liquid chromatography-quadrupole-orbitrap mass spectrometry was used in plasma metabolomics study of patients with coronary heart disease and coronary heart disease-type 2 diabetes mellitus. The aim was to explore the metabolic characteristics of coronary heart disease and coronary heart disease-type 2 diabetes mellitus, which would be useful for the optimization of clinical treatment plans based on metabolomics. A total of 78 endogenous metabolites were analyzed in plasma. On this basis, combined with partial least squares-discriminant analysis and variable importance projection, 20 characteristic metabolites were screened to distinguish healthy control from patients with coronary heart disease, 35 metabolites were screened for discrimination of patients with coronary heart disease and coronary heart disease-type 2 diabetes mellitus, 37 metabolites were screened to distinguish healthy control from patients with coronary heart disease-type 2 diabetes mellitus. Metabolic pathway analysis showed that amino acid metabolism played an important role in the physiological metabolism of these two types of patients, and fatty acid metabolism was likely to be associated with the complication of type 2 diabetes mellitus.
Keywords Coronary heart disease; Coronary heart disease-type 2 diabetes mellitus; Ultra-high performance liquid chromatography-high resolution mass spectrometry; Metabolomics; Chemometrics
