低分子量鲶鱼蛋白肽的酶解工艺优化及氨基酸分析
2020-02-06冯倩曾里冉旭高安友应萍辉
冯倩,曾里,冉旭*,高安友,应萍辉
(1.四川大学 轻工科学与工程学院,成都 610065;2.四川省新溪源生物科技发展有限公司,成都 618500)
鲶鱼,同鲇鱼,种类繁多,适应能力好,容易养殖,成本低廉[1],其体内含有丰富的亚油酸、亚麻酸等构成人脑极为重要的一系列营养素,具有一定的调中、益阳的药用功效[2]。近年来有关利用生物酶解技术生产鱼类发酵制品的研究越来越多[3,4],研究发现生物酶解不仅效率高、污染低,而且酶解产物包含许多人体必需的氨基酸[5]。另一方面,通过酶解可以得到具有抗氧化活性、能够缓解体力疲劳和降血压等功能性的更利于人体吸收的小分子多肽[6]。但目前对于鲶鱼酶解多采用单酶水解,因而存在底物水解不完全和利用率较低的问题。另外,对酶解后的多肽及氨基酸做进一步的分析以开发鲶鱼发酵产品的研究还鲜有报道[7]。因此,本文对鲶鱼进行双酶复合酶解,然后应用响应面分析法对酶解制备鲶鱼多肽的工艺进行优化研究,再对酶解液进行氨基酸分析和多肽分子量评价,以期为后续鲶鱼相关的发酵制品的开发提供一定的理论指导。
1 材料与方法
1.1 材料
鲶鱼:由四川溪源水产养殖有限公司提供;木瓜蛋白酶(80×104U/g)、中性蛋白酶(5×104U/g):Solarbio公司;其他试剂:均为分析纯。
1.2 仪器与设备
PHS-3C精密数显pH计 上海仪电科学仪器股份有限公司;UV-1800PC紫外可见分光光度计 上海美谱达有限公司;KDN-C 定氮炉 浙江托普仪器有限公司;TG16-WS台式高速离心机 上海卢湘仪离心机仪器有限公司;ELEOS System凝胶色谱仪 美国Wyatt公司。
1.3 试验方法
1.3.1 原料预处理
新鲜鲶鱼解冻后,去除鱼头、内脏和鱼皮,将洗净后的鱼肉以小袋分装,于-20 ℃下保存,备用。
1.3.2 原料最佳酶添加量的选择
选用酶切位点为疏水性大分子氨基酸Leu、Ile、Phe的中性蛋白酶和酶切位点为Arg、Lys、Gly、Cys残基羧基参与形成肽键的木瓜蛋白酶,添加不同比例以确定最佳酶添加量[8-13]。
1.3.3 酶解鲶鱼肉的响应面试验设计
1.3.3.1 单因素试验
准确称取一定量的鲶鱼肉,通过预试验添加中性蛋白酶∶木瓜蛋白酶为1∶1作为本试验酶的添加量。分别对酶解pH、温度、时间和料液比4个因素进行单因素试验分析,衡量指标为鲶鱼肉的水解度及多肽得率。
1.3.3.2 响应面试验优化提取鲶鱼多肽工艺参数
鲶鱼多肽提取工艺的设计因素及水平编码见表1。

表1 鲶鱼多肽提取工艺的设计因素及水平编码Table 1 Factors and levels of response surface methodology
1.3.4 水解度的测定
1.3.4.1 总氮的测定
参照GB 5009.5-2016《食品安全国家标准 食品中蛋白质的测定》中的凯氏定氮法测定鲶鱼肌肉的总氮含量。
1.3.4.2 游离氨基酸态氮的测定
参考GB 5009.235-2016《食品安全国家标准 食品中氨基酸态氮的测定》中的酸度计法,并稍加修正[14]。吸取5.0 mL酶解液,加入50 mL去离子水稀释,用NaOH标准溶液(0.05 mol/L)调节pH至8.2,再加入10.0 mL甲醛溶液(38%,V/V),混匀静置5 min,继续滴定至pH为9.2,记录消耗NaOH标准溶液的体积(V1,mL);以去离子水作空白,采用同样的操作方法,记录消耗NaOH标准溶液的体积(V0,mL)。酶解液中游离氨基酸态氮的含量(CN,g/dL)计算公式如下:
CN=(V1-V0)×C×0.014/5。
式中:CN为酶解液中游离氨基态氮的含量,g/mL;C 为NaOH标准溶液的浓度,mol/L;V1为酶解液加入甲醛后滴定消耗NaOH标准溶液的体积,mL;V0为空白液加入甲醛后滴定消耗NaOH标准溶液的体积,mL;0.014为1.00 mL氢氧化钠标准滴定[c(NaOH)=1.000 mol/L]相当于氮的质量,g。
1.3.4.3 水解度的计算
DH=CN×V/总氮。
式中:CN为酶解液中游离氨基酸态氮的含量,g/mL;V为酶解液总体积,mL。
1.3.5 多肽含量的测定
鲁伟等[15]采用加入等量10%(W/V)三氯乙酸(TCA)沉淀大分子蛋白后,再采用双缩脲法测定酶解液中肽的含量。本试验参照此法并稍作改变。
1.3.5.1 双缩脲试剂的配制
称取硫酸铜(CuSO4·5H2O)3 g、酒石酸钾钠(KNaC4H4O6·4H2O)9.0 g、碘化钾5.0 g、氢氧化钠24 g,加水溶解并稀释至1000 mL,摇匀,即得双缩脲试剂。
1.3.5.2 蛋白质溶液标准曲线的绘制
精密称取牛血清蛋白(BSA)标准品,用超纯水定量稀释成蛋白质含量分别为1,2,3,4,5 mg/mL的溶液。取5 mL溶液于试管中,加入4 mL双缩脲试剂,混匀,用软塞塞住上管口,置于37 ℃水浴中30 min。然后以超纯水调零,在波长540 nm处测定吸光度。
1.3.5.3 多肽含量的测定与计算
精密量取稀释一定浓度后的样品液5 mL,其余方法同1.3.5.2。根据标准曲线方程计算出多肽含量(mg/mL)。
1.3.6 游离氨基酸的测定与分析
利用A300德国MembraPure氨基酸分析仪,采用570 nm和440 nm双检测通道对样品进行分析。为了进一步准确判断评价蛋白质的营养价值,可通过WHO/FAO提出的氨基酸模式谱来计算样品中的必需氨基酸比值(RAA)、氨基酸比值系数(RC)、比值系数分(SRC)[16-18]。
1.3.7 多肽相对分子质量的分布测定
采用ELEOS System型凝胶色谱仪(色谱柱为ShodexOHpak系列SB-806串803)进行相对分子质量的测定,选择柱温40 ℃、流速1 mL/min、进样量500 μL[19-21]。
2 结果与分析
2.1 不同酶解条件对鲶鱼蛋白水解度及多肽的率得影响



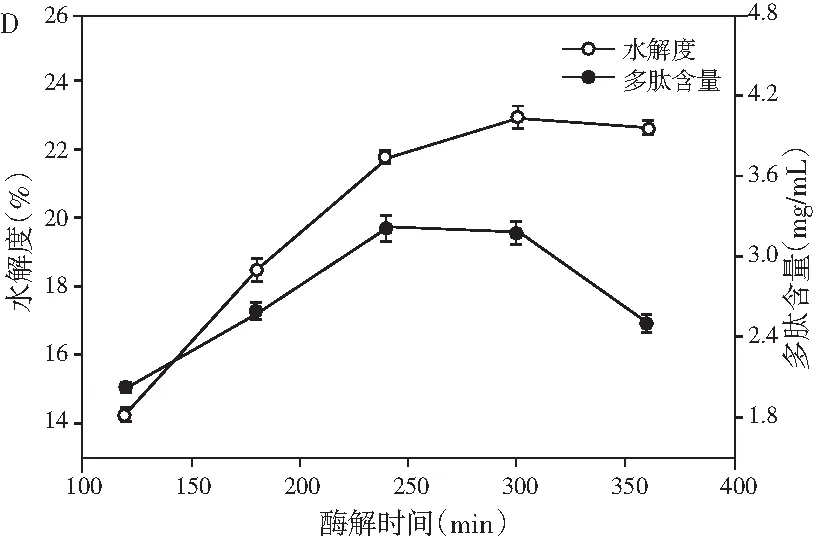
图1 pH、料液比、酶解温度及酶解时间对鲶鱼酶解液水解度和多肽含量的影响Fig.1 Effect of pH values, solid-liquid ratios, enzymolysis temperatures and enzymolysis time on the degree of hydrolysis and peptide content
由图1可知,在酶解过程中,水解度与多肽含量随着条件的变化都呈现先增加后降低的趋势。由图1中A可知,pH为6时,水解度和多肽含量都达到最大值,可能是因为其均在中性蛋白酶和木瓜蛋白酶的最适pH范围内。由图1中B可知,随着溶剂量的增多,更多的多肽被水解出来,当料液比继续增大时,由于溶液体积的增大导致多肽含量明显下降,再考虑到试验操作的损耗以及后期试验的方便性,选择料液比为1∶4时最佳。酶的催化活性受温度的影响较大,中性蛋白酶和木瓜蛋白酶都有各自的最适反应温度,由图1中C可知,在55 ℃时,水解度趋于平稳,同时多肽含量达到最大值,随即显著降低,可能是因为过度水解导致小分子多肽也开始被消耗。反应时间对水解的影响见图1中D,由于酶解底物量的限制以及酶活的自我损失,当酶解到300 min时,水解度已经慢慢达到稳定状态,然而之后由于小分子多肽也开始被水解为氨基酸,导致多肽含量开始降低。
2.2 响应面试验
在单因素试验结果的基础上,根据Box-Behnken的原理,选择对结果影响较大的料液比、pH、酶解温度作为自变量X1、X2、X3,酶解得到的多肽含量Y为响应值,设计三因素三水平的响应面分析试验,见表2,采用Design-Expert 11软件进行数据分析。
通过Design-Expert软件对数据进行拟合分析,可以得到料液比、pH和温度对多肽得率影响的二次多项回归方程:
Y=3.17-0.3095A+0.0233B+0.0290C-0.0123AB+0.0022AC+0.0019BC-0.2346A2-0.1044B2-0.0872C2。

表2 鲶鱼酶解工艺的响应面设计及结果Table 2 Design and results of response surface experiment of enzymatic hydrolysis for catfish
鲶鱼蛋白的回归模型各项系数的显著性检验结果及方程的方差分析结果见表3。
注:“*”表示差异显著,P<0.05;“**”表示差异极显著,P<0.01。
由表3可知,该回归模型的P<0.0001,其中,失拟项值为0.6327,>0.5,表现为不显著。综上表明所设计的三因素三水平响应面试验是可行的,方程相关系数R2=0.9835,相关系数RAdj2=0.9623,表明该模型的拟合度较好,能够在96.23%的程度上解释试验结果;变异系数为1.74%,表明该模型能够很好地反映真实的试验值;精密度为17.0792,>4.0,表明其是一个适宜的信号值。
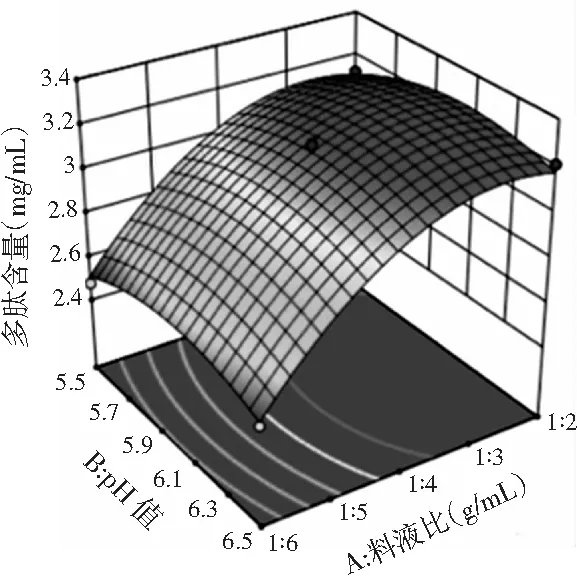

图2 pH值和料液比交互作用的响应面图和等高线图Fig.2 Response surface figure and contour plot of interaction effect of pH value and solid-liquid ratio
由图2可知,随着料液比或pH值的增加,多肽得率都先增加,达极大值后减小,这与单因素结果保持一致。


图3 酶解温度和料液比交互作用的响应面图Fig.3 Response surface figure and contour plot of interaction effect of enzymolysis temperature and solid-liquid ratio
由图3可知,料液比的曲线比酶解温度的曲线更陡,表明料液比对试验结果的影响大于酶解温度的显著性。
由图4可知,当酶解温度一定时,多肽得率随pH值的增加先升高后降低。

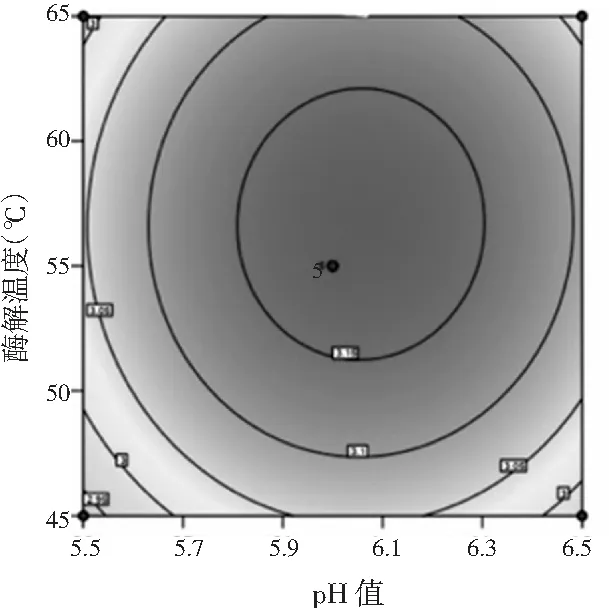
图4 酶解温度和pH值交互作用的响应面图和等高线Fig.4 Response surface figure and contour plot of interaction effect of enzymolysis temperature and pH value
根据上述响应面优化得到鲶鱼酶解液多肽含量的最佳提取条件为:料液比1∶2.673,pH值6.076,酶解温度56.595 ℃,多肽得率预测值为3.279 mg/mL。考虑到实际操作条件,将最佳酶解工艺条件修正为:料液比1∶2.7,pH值6,酶解温度57 ℃。进行3次平行验证试验,在此条件下,鲶鱼酶解液多肽含量平均值为3.165 mg/mL,非常接近于预测值。这说明该回归模型能够较好地反映鲶鱼酶解液多肽含量的变化规律。
2.3 氨基酸分析结果

表4 鲶鱼酶解液中的氨基酸组成Table 4 Amino acid composition of catfish enzymatic hydrolysate

表5 各种必需氨基酸的RAA、RC及SRCTable 5 RAA, RC and SRC of human essential amino acids
由表4和表5可知,水解后鲶鱼样品中氨基酸的种类齐全,其中必需氨基酸(EAA)与非必需氨基酸(NEAA)的比值(EAA/NEAA)为57.45%,较接近于FAO/WHO所提出的比值40%。为了进一步说明鲶鱼酶解液的营养价值,采用氨基酸比值系数法对酶解液中各种必需氨基酸进行了进一步分析。鲶鱼酶解液中各种必需氨基酸的氨基酸比值(RAA)、氨基酸比值系数(RC)以及比值系数分(SRC)见表5,可知鲶鱼酶解液氨基酸的比值系数分较高,为83.2,这为后续进一步加工利用提供了可靠的科学依据。
2.4 多肽相对分子质量的分布

图5 分子量分布Fig.5 Molecular weight distribution
由图5可知,鲶鱼酶解液中多肽分子峰尖分子量为1.100×103g/mol,数均分子量为1.842×103g/mol,平均分子量为1.334×103g/mol,多分散性指数为1.651。酶解液中多肽分子量分布在700.0~28922.0 g/mol之间,其中,多肽分子量在700.0~2800.0 g/mol之间占总多肽分子量含量的53%;多肽分子量在2800.0~3200.0 g/mol之间,占总多肽分子量含量的28.6%,说明酶解后的多肽分子含量主要以3000.0 g/mol以下的小分子肽为主,水解程度较好。具体分析数据见表6。
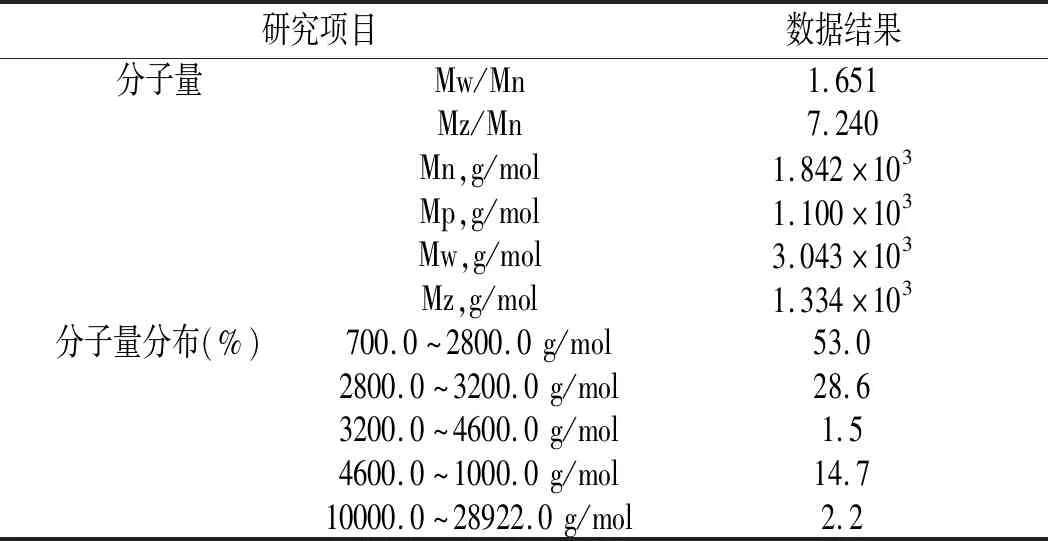
表6 凝胶色谱结果分析Table 6 Analysis of gel chromatography results
3 结论
通过响应面试验,得到料液比1∶2.7、pH值6、酶解温度57 ℃和酶解时间300 min为鲶鱼酶解的最佳条件,在此条件下鲶鱼酶解液的多肽含量平均值为3.165 mg/mL。鲶鱼经过酶解后,人体必需氨基酸含量大幅上升,其中必需氨基酸(EAA)与非必需氨基酸(NEAA)的比值(EAA/NEAA)为57.45%,氨基酸比值系数分SRC为83.2,符合FAO/WHO所提出的蛋白评价标准。通过GPC凝胶色谱仪对样品进一步的检测分析可知,鲶鱼酶解液中多肽分子平均分子量为1.334×103g/mol,主要以3000.0 g/mol以下的多肽为主。该研究确定了一种水解程度较高、营养丰富、容易吸收消化的鲶鱼酶解液的制备方法,可为后续鲶鱼相关发酵制品的研发提供理论指导。
