QuEChERS净化—超高效液相色谱—串联质谱法同步测定荔枝中10种植物生长调节剂残留
2020-01-21吴学进刘春华罗金辉李春丽马晨乐渊吴南村
吴学进 刘春华 罗金辉 李春丽 马晨 乐渊 吴南村

摘要:【目的】建立同步測定荔枝中甲哌啶、矮壮素等10种植物生长调节剂(PGRs)残留的QuEChERS净化—超高效液相色谱—串联质谱法(UPLC-MS/MS),为荔枝中多种PGRs残留同步检测提供技术参考。【方法】荔枝样品以1%(v/v)乙酸—乙腈提取,经优化QuEChERS前处理后,净化后的样品提取液以Agilent InfinityLab Poroshell 120 EC-C18柱为分离色谱柱,甲醇—5 mmol/L乙酸铵水溶液(含0.1%甲酸,v/v)缓冲溶液为流动相梯度洗脱,以UPLC-MS/MS在选择反应监测模式下对甲哌啶等10种PGRs目标物残留进行测定。【结果】在5~100 μg/kg范围内,10种PGRs质量浓度与对应的峰面积呈良好线性,相关系数(r2)均>0.9950;检出限范围为0.03~0.60 μg/kg。在10、25和100 μg/kg 3个添加水平范围内,平均回收率在71.8%~109.2%,相对标准偏差(RSD)在0.6%~10.0%。用优化的QuEChERS净化-UPLC-MS/MS对40份荔枝样品进行检测,其中1份样品检出多效唑,1份样品检出芸苔素内酯,PGRs检出率为5.0%。【结论】建立的QuEChERS净化-UPLC-MS/MS简便、快速,具有良好的灵敏度、准确度和精密度,可用于同步测定甲哌啶等10种PGR在荔枝中的残留。
关键词: 荔枝;QuEChERS;植物生长调节剂(PGRs);超高效液相色谱—串联质谱(UPLC-MS/MS)
中图分类号: S482.8 文献标志码: A 文章编号:2095-1191(2020)10-2532-08
Simultaneous determination of ten plant growth regulators residues in litchi by QuEChERS clean up-ultra high perfor-mance liquid chromatography-tandem mass spectrometry
WU Xue-jin, LIU Chun-hua*, LUO Jin-hui, LI Chun-li, MA Chen, LE Yuan, WU Nan-cun
(Analysis and Testing Center, Chinese Academy of Tropical Agricultural Sciences/Hainan Provincial Key Laboratory of Quality and Safety for Tropical Fruits and Vegetables, Haikou 571101,China)
Abstract:【Objective】A method for simultaneous determination of ten plant growth regulators(PGRs) residues in litchi,such as meperidine,chlorpromazine and others,was developed by using ultra high performance liquid chromatography-tandem mass spectrometry(UPLC-MS/MS) in combination with QuEChERS methodology, to provide reference for simultaneous determination of multiple PGRs residue in litchi. 【Method】The litchi samples were extracted with acetonitrile containing 1%(v/v) acetic acid and purified by the optimized QuEChERS pretreatment method, then the purified sample extracting solutions were separated in Agilent InfinityLab Poroshell 120 EC-C18 column with methanol-5 mmol/L ammonium acetate solution(containing 0.1% formic acid,v/v) as mobile phase by gradient program,and analyzed by using UPLC-MS/MS in selective reaction monitoring(SRM) mode for mepiquat chloride and other nine PGRs residues in samples. 【Result】The mass concentrations of ten PGRs showed good linearity with the corresponding peak area in the range of 5-100 μg/kg,and the correlation coefficient(r2) was more than 0.9950. The limits of detection(LODs) ranged from 0.03 to 0.60 μg/kg. The average recoveries at three spiked levels of 10,25,100 ?g/kg for all target compounds in the samples were in the range of 71.8%-109.2%,with relative standard deviations(RSD) between 0.6% and 10.0%. The optimized UPLC-MS/MS in combination with QuEChERS methodology mention above was used to detect 40 litchi samples,paclobutrazol was detected in one sample and so was brassinolide ,the detection rate of PGRs was 5.0%. 【Conclusion】The QuEChERS purofied-UPLC-MS/MS method is simple,rapid with high sensitivity and good repeatability, accuracy and precision, which can be used for simultaneous determination of ten PGR residues above mentioned in litchi.
Key words: litchi; QuEChERS; plant growth regulators(PGRs); ultra high performance liquid chromatography-tandem mass spectrometry(UPLC-MS/MS)
Foundation item: Major Project of National Agricultural Product Quality and Safety Risk Assessment(GJFP2019 013);Basic Research Project of Chinese Academy of Tropical Agricultural Sciences(1630082020009,1630082017001,1630082020002)
0 引言
【研究意义】荔枝(Litchi chinensis Sonn)是无患子科(Sapindaceae)荔枝属(Litchi Sonn.)果树,在我国有2000多年的种植记载历史。荔枝果实口感鲜甜,营养丰富,深得大众青睐。荔枝作为大众果盘的重要水果,其鲜果的产品质量安全一直受到密切关注,但长期以来人们更多关注于荔枝中的农药残留(王运儒等,2018),却忽视了荔枝中植物生长调节剂(Plant growth regulators,PGRs)的残留。PGRs是化学合成与植物内源激素有相似生理作用的一类物质,能调节植物的生长发育和代谢过程,达到增产增效、改善品质等目的,在现代高效农业生产中得到广泛应用。尽管大多数的PGRs在进入植物体内会随着植物的新陈代谢而逐渐降解,具有高效、低毒、低残留的特点,但滥用PGRs也会造成安全隐患,残留的PGRs或其降解产物通过食物链积累和生物放大,会造成发育毒性,甚至可致畸、致癌、致突变等严重后果(马晨等,2019;张新中等,2019)。目前我国对PGRs实行登记管理,有40多种在我国作物上登记使用(张宏军等,2017),但GB 2763—2019《食品安全国家标准 食品中农药最大残留限量》中仅规定了2,4-D、矮壮素、胺鲜脂、单氰胺、丁酰肼、多效唑、氟节胺、复硝酸钠、甲哌鎓(助壮素)、抗倒酯、氯苯胺灵、氯吡脲、萘乙酸、噻苯隆、噻节因、四氯硝基苯、调环酸钙、烯效唑、乙烯利和抑芽丹等20种PGRs残留限量标准及配套的检测标准;S-诱抗素、超敏蛋白、三十烷醇、几丁聚糖、氨基寡糖素和香菇多糖等6种PGRs因不存在安全风险,按照国际惯例列入豁免制定限量标准农药名单,不需要制定残留标准;其他PGRs的残留限量标准和相关检测标准还有待进一步研究制定。总体上,我国PGRs残留限量标准的项目数量和覆盖食品类别不足,对PGRs缺乏完整的控制标准,其相关的残留检测技术也在发展和完善中。因此,研究开发快速、简便地检测多组分PGRs在荔枝中残留的方法,不仅可进一步完善荔枝产业技術体系建设,而且对于提高荔枝产品质量安全、促进荔枝产业健康发展,乃至保障人民群众的食品安全均具有重要意义。【前人研究进展】目前PGRs残留的检测方法有气相色谱法(周艳明等,2010)、气相色谱—质谱法(张文华等,2016)、液相色谱法(胡晓科等,2018)和液相色谱—质谱法(邱世婷等,2018)等。其中,气相色谱法有时需对样品进行衍生反应处理,步骤繁琐,且易衍生不完全导致定量检测不准确;液相色谱法在检测复杂基质样品时,存在基质干扰及检测的假阳性现象;此外,气相和液相在PGRs检测过程中还存在确证性不足的缺陷,因此当前PGRs残留检测多以色谱—串联质谱联用技术为主(莫迎等,2019)。由于大部分PGRs极性大、不易挥发、热稳定性差,应用液相色谱—串联质谱法具有样品不需衍生化反应、检测灵敏度高、选择性好等优点,因而成为PGRs残留检测的优选方法。QuEChERS样品前处理方法是近年来国际上发展起来的一种用于农产品中农药残留检测的快速样品前处理技术,该技术具有溶剂使用量少、污染小、成本低廉、操作简便、分析速度快等优点,已被广泛应用于蔬菜水果基质中多种农药残留检测的前处理(严煌倩等,2018)。目前已陆续有QuEChERS结合超高效液相色谱—串联质谱法(UPLC-MS/MS)同步测定多组分PGRs在水果残留的报道。邱暑婷等(2017)采用乙二胺-N-丙基硅烷化硅胶(PSA)和无水硫酸镁(MgSO4)作为QuEChERS前处理的净化剂,建立了UPLC-MS/MS同时测定葡萄中18种PGRs残留的方法,该方法的平均回收率为71.0%~120.2%,定量限(LOQ)为0.56~8.70 μg/kg。夏虹等(2018)采用PSA、C18和MgSO4作为QuEChERS前处理的净化剂,建立了测定柑橘中矮壮素等12种PGRs残留的UPLC-MS/MS方法,其平均回收率为70.3%~109.7%,相对标准偏差(RSD)为0.9%~10.1%。乐渊等(2018a)采用C18和MgSO4作为QuEChERS前处理的净化剂,建立了UPLC-MS/MS同时测定莲雾中氯吡脲等18种PGRs残留的方法,该方法的平均回收率为71.0%~124%,RSD为0.6%~11.2%,定量限为0.30~5.0 μg/kg。孔祥吉等(2019)采用PSA和MgSO4作为QuEChERS前处理的净化剂,建立了苹果中胺鲜酯残留的气相质谱检测方法,其评价平均回收率为74.1%~84.2%,RSD为1.5%~4.1%,定量限为8.0 μg/kg。【本研究切入点】尽管目前已有采用QuEChERS结合UPLC-MS/MS测定多组分PGRs在多种水果基质中残留的研究报道,但针对多组分PGRs在荔枝残留的检测尚未见相关研究报道。【拟解决的关键问题】通过优化MgSO4、PSA和C18等净化材料组合,建立QuEChERS样品前处理结合UPLC-MS/MS同步测定甲哌啶等10种PGRs在荔枝基质中残留快速检测方法,为多组分PGRs在荔枝残留检测、风险评估及标准制定等相关食品质量安全监督工作提供参考依据,以促进我国荔枝产业持续健康发展。
1 材料与方法
1. 1 试验材料
试验所用荔枝样品采自海南、广东和广西3省(区),共40份。矮壮素(Chlormequat chloride,CCC)、甲哌啶(Mepiquat chloride,DPC)、氯吡脲(Forchlorfenuron,CPPU)和噻苯隆(Thidiazuron,TDZ)购自美国Cato公司;胺鲜酯(Diethyl aminoethyl hexanoate,DA-6)、6-苄基腺嘌呤(6-benzylaminopurine,6-BA)、芸苔素内酯(Brassinolide,BR)、抑芽唑(Triapentheno)和抗倒酯(Trinexapac-ethyl)购自德国Dr. Ehrenstorfer公司;多效唑(Paclobutrazol,PP333,1000 mg/L)购自农业农村部环境质量监督检验测试中心。以上标准物质质量浓度均大于97%。甲醇、乙腈和甲酸(HPLC级)购自美国Fisher公司;乙酸铵(HPLC级)购自美国TEDIA公司;试验用水经Milli-Q超纯水系统制备;乙二胺—丙基硅烷(PSA,50~70 μm)购自美国安捷伦公司;石墨化炭黑(GCB,50~120 μm)和碳十八吸附剂(C18,50 μm)购自上海安谱科学仪器有限公司;氯化钠(NaCl)和MgSO4(分析纯)购自广州化学试剂有限公司。
主要仪器设备:TSQ Quantum Access MAX超高压液相—三重四极杆质谱仪(美国Thermo Scientific公司);梅特勒AB-204N型电子天平(梅特勒—托利多仪器有限公司);MS 3basic圆周振荡器(德国IKA公司);Eppendorf 5415R小型冷冻离心机(艾本德中国有限公司);LXJ-Ⅱ型B离心机(上海安亭科学仪器厂);TXW-80A微型涡旋混合仪(上海沪西分析仪器厂有限公司)。
1. 2 试验方法
1. 2. 1 标准溶液配制 标准工作液:分别将甲哌啶等10种PGRs标准品用甲醇配制成1.0 mg/L的标准工作液,用于质谱工作条件优化;将该溶液置于4 ℃冰箱内避光保存(有效期7 d)。
溶剂混合标准溶液:将甲哌啶等10种PGRs标准品用甲醇配制成质量浓度为5、10、25、50和100 μg/L系列混合标准上机溶液,置于4 ℃冰箱内避光保存(有效期7 d)。
基质混合标准上机溶液:将甲哌啶等10种PGRs标准品用空白荔枝基质溶液配制成质量浓度为5、10、25、50和100 μg/kg系列基质混合标准上机溶液,置于4 ℃冰箱内避光保存(有效期7 d)。
1. 2. 2 样品前处理 荔枝鲜果样品取全果去核打碎匀浆,制成待测样品,分装于洁净容器,置于-18 ℃冰箱中备用。
样品提取:准确称取10.00 g样品置于50 mL具塞离心管中,加入10.0 mL含1%(v/v)乙酸—乙腈溶液,加入2.0 g NaCl在MS 3basic圆周振荡器于1800 r/min振荡匀质2 min;然后以4500 r/min离心3 min。
样品净化:取1.5 mL上清液置于2 mL QuEChERS分散净化试剂管(内含优化确定后净化材料组合),涡旋混匀1 min后于12000 r/min离心3 min;上清液用一次性注射器吸取,过0.22 μm有机滤膜,滤液按仪器优化工作条件进行测定。
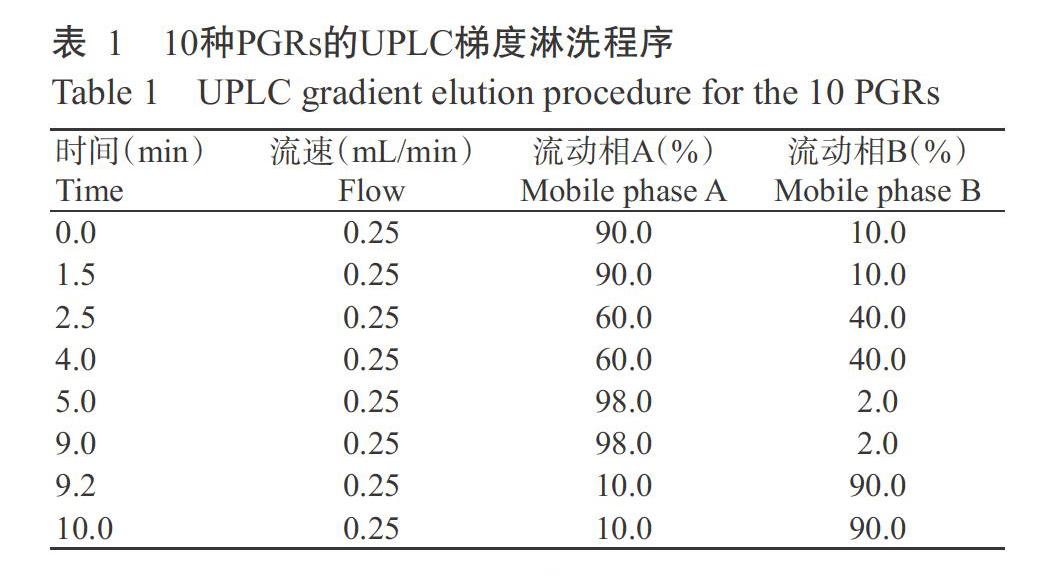
1. 2. 3 仪器工作条件 UPLC条件:采用Agilent InfinityLab Poroshell 120 EC-C18(3.0 mm×100 mm,2.7 μm)色谱柱;柱温35 ℃,样品室温35 ℃,进样体积2.0 μL,流速0.25 mL/min;流动相A为5 mmol/L乙酸铵和0.1%甲酸(v/v)水缓冲溶液,流动相B为甲醇;梯度洗脱程序如表1所示。
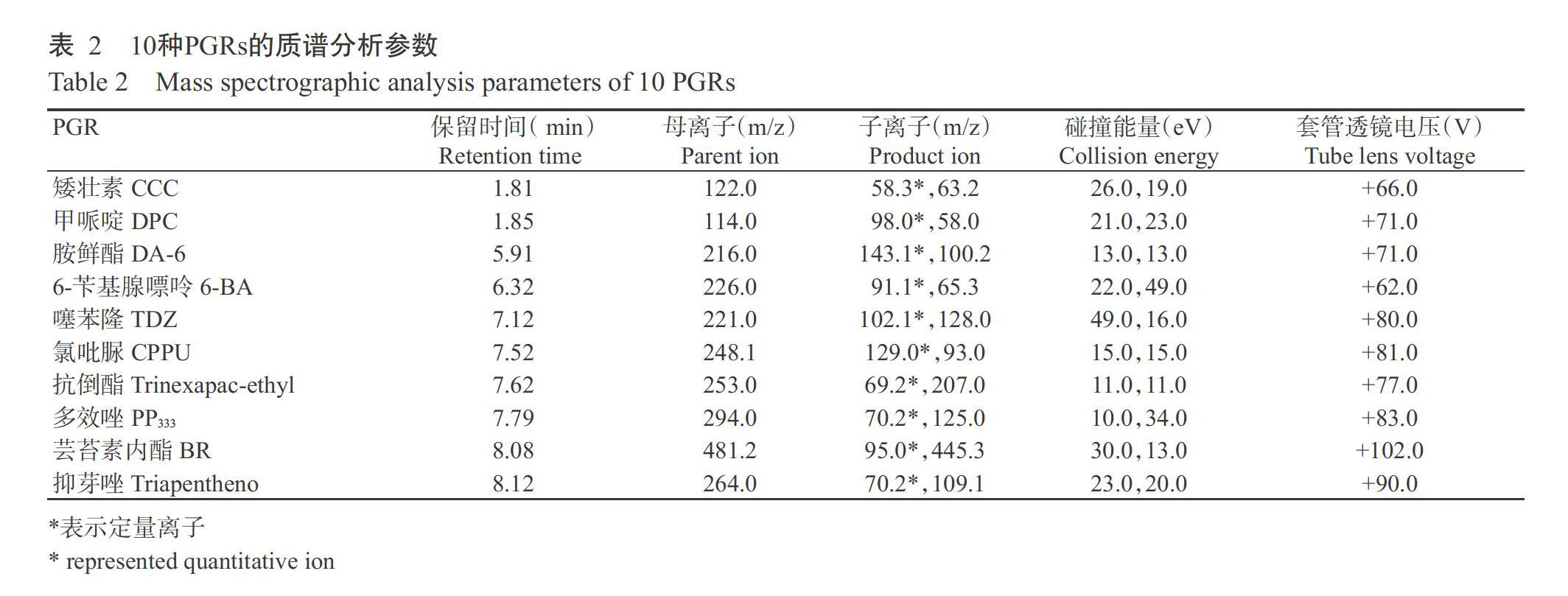
ESI-MS/MS条件:采用电喷雾离子源(ESI),选择反应监测(SRM)扫描;离子化温度350 ℃,离子传输管温度320 ℃,离子化电压+3200 V;鞘气压力45.0 Arb;辅助气压力8.0 Arb。10种PGRs的定量、定性离子对、锥孔电压和碰撞能量等其他具体参数见表2。
1. 2. 4 净化方案设计 设计5种组合方案:①150 mg MgSO4+50 mg PSA;②150 mg MgSO4+50 mg PSA+50 mg C18;③150 mg MgSO4+50 mg PSA+50 mg C18+50 mg GCB;④150 mg MgSO4+50 mg PSA+50 mg C18+25 mg GCB;⑤150 mg MgSO4+50 mg PSA+50 mg C18+7.5 mg GCB,用以考察不同净化材料组合对待测PGRs化合物回收率的影响。
取空白提取样品,配制质量浓度为0.50 μg/kg的上述10种PGRs基质标准混合液,吸取1.5 mL混合标准液加入2 mL QuEChERS分散净化试剂管(分别内含上述5种不同净化材料组合),涡旋混匀1 min后于12000 r/min离心3 min;上清液用一次性注射器吸取,过0.22 μm有機滤膜,滤液按仪器优化工作条件进行测定。每种净化方案做6个平行样品。通过考察其平均回收率评价不同方案的净化效果,最终确定样品的净化方案。
1. 2. 5 基质效应评价 以荔枝的空白基质溶液和甲醇稀释一系列相同浓度标准溶液,分别计算基质标准曲线与甲醇标准曲线的斜率比值(胡胜杰等,2019),以比值评价其基质效应(ME)。ME按下式计算:
ME(%)=[kmatrixksolvent-1]×100
式中,kmatrix为基质匹配标准曲线的斜率,ksolvent为溶剂标准曲线的斜率。当ME>0时,表明基质对待测物有基质增强效应,ME<0为基质抑制效应;若|ME|≤20%,表明基质效应不明显;若20%<|ME|≤50%,表明基质效应中等;若|ME|>50%,则表明基质效应很强(乐渊等,2018b)。
2 结果与分析
2. 1 UPLC-MS/MS工作条件优化结果
采用ESI,在正、负离子互切换监测模式下,通过蠕动泵将上述质量浓度为1.0 mg/L的10种PGRs单标准溶液以50 μL/min流速分别持续注入离子源,通过全扫描模式确定丰度较高且稳定的母离子及对应套管透镜电压值,而后进一步优化喷雾电压、鞘气压力、辅助气压力等参数。在此基础上,对确定母离子给予一定的碰撞能量,做子离子碎片扫描,每个化合物选取2对丰度相对较高、干扰小的碎片离子分别作为定量和定性离子对。在10种PGRs中,6-苄基腺嘌呤、氯吡脲、噻苯隆和芸苔素内酯在正、负离子模式下均有响应,但正离子模式下响应值较高,最终10种PRGs均采用正离子模式扫描,其具体优化条件见表2。图1是标准质量浓度为100 μg/kg 10种PGRs的SRM色谱图。
2. 2 色谱柱条件的考察选用
由于C18色谱柱对强极性化合物的保留性不佳,因此本研究选用极性较强的甲哌啶在色谱柱保留的峰形作为色谱柱选取的考察指标,考察其在以下色谱柱:(a)Thermo Hypersil Gold C18柱(100 mm×2.1 mm,1.9 μm);(b)Waters Acquity BEH C18(100 mm×2.1 mm,1.7 μm);(c)Agilent ZORBAX Eclipse Plus C18(2.1 mm×150 mm,1.8 μm);(d)Agilent InfinityLab Poroshell 120 SB-C18(2.1 mm×100 mm,2.7 μm);(e)Agilent InfinityLab Poroshell 120 EC-C18(3.0 mm×100 mm,2.7 μm);(f)Agilent ZORBAX SB-Aq C18(2.1 mm×100 mm,1.8 μm)的保留时间和峰形,结果见图2。如图所示,甲哌啶在6种色谱柱保留的时间分别为0.41、0.59、0.89、1.05、1.83和5.83 min,其中在前4种色谱柱的保留时间均小于或接近1.00 min,尽管在第6种色谱柱的保留时间为5.83 min,但其保留峰拖尾严重,也不适合选用;故最终选用Agilent InfinityLab Poroshell 120 EC-C18作为后续试验的分离柱。
2. 3 流动相的考察选用
采用100 μg/L甲哌啶标准溶液为考察指示待测物,在不同的流动相[①乙腈—水;②甲醇—水;③甲醇—水(含0.1%甲酸,v/v)]下,以甲哌啶在Agilent InfinityLab Poroshell 120 EC-C18的保留时间和响应值作为选用流动相的依据。如图3所示,甲哌啶在①乙腈—水的保留时间为1.52 min,响应值为1.93×106 AU,在②甲醇—水的保留时间为3.37 min,响应值为1.12×106 AU,且峰形稍有拖尾,两者响应值均能满足检测需要,但从环保和成本角度考虑,优选②甲醇—水。进一步考察还发现,在②甲醇—水加入0.1%甲酸后,甲哌啶的保留时间为1.83 min,响应值为7.24×105 AU,且峰形更尖锐对称;在水相中加入5.0 mmol/L的乙酸铵后,甲哌啶的保留时间为1.83 min,但响应值增至7.95×105 AU。根据目标待测物的保留峰形和响应值,最终确定甲醇—5 mmol/L乙酸铵水溶液(含0.1%甲酸,v/v)缓冲溶液体系作为后续试验的流动相。
2. 4 净化方案选择结果
5种净化方案的回收率见表3,结果表明,PSA和C18对氯吡脲等10种PGRs均无明显吸附作用,但同时含有PSA和C18的方案②净化效果比只含有PSA的方案①更佳,其回收率在86.5%~107.7%;GCB对氯吡脲、噻苯隆、6-苄基腺嘌呤和芸苔素内酯均有吸附,当方案③的GCB用量为50 mg时,氯吡脲和噻苯隆的回收率分别为4.7%和6.1%,6-苄基腺嘌呤和芸苔素内酯的回收率分别为38.9%和34.2%;随着GCB用量由50 mg降至25 mg,噻苯隆、6-苄基腺嘌呤和芸苔素内酯的回收率上升(方案④),当GCB用量降至7.5 mg时,芸苔素内酯和6-苄基腺嘌呤的回收率分别达84.8%和68.7%,而噻苯隆和氯吡脲的回收率也达42.6%和35.6%(方案⑤)。由此可见,GCB对具有平面结构的PGRs化合物有吸附作用,特别是对噻苯隆和氯吡脲具有强吸附效应。综上考虑,最终确定150 mg MgSO4+50 mg PSA+50 mg C18(方案②)作为后续试验样品净化方案。
2. 5 基质效应评价结果
10种PGRs的基质效应分析结果见表4,6-苄基腺嘌呤的ME为438%,为显著基质增强效应;其余9种PGRs的|ME|≤20%,表明其基质效应不明显。为校正基质效应的影响,提高定量的准确度和可靠性,采用基质匹配外标校准曲线对样品残留的PGRs残留进行定量。
2. 6 方法的线性范围、检出限和定量限
经优化比较,最終确定QuEChERS净化-UPLC-MS/MS为:仪器条件见1.2.3,选用Agilent InfinityLab Poroshell 120 EC-C18作为分离色谱柱;样品前处理方法见1.2.2,其中提取液为1%(v/v)乙酸—乙腈溶液,样品净化材料为150 mg MgSO4+50 mg PSA+50 mg C18。
以空白荔枝样品净化液配制成质量浓度为5、10、25、50和100 μg/kg系列基质混合标准工作溶液,在经优化后确定的UPLC-MS/MS条件下进行测定。以待测目标化合物定量离子的峰面积y为纵坐标、质量浓度x(μg/kg)为横坐标绘制标准曲线,即得到10种PGRs的线性方程及相关系数(表4)。结果显示,在质量浓度为5~100 μg/kg范围内,10种PGRs校正曲线呈良好的线性,其相关系数(r2)>0.9950。
选择较低浓度的基质标准溶液进样,逐级稀释上机检测,分别以3倍信噪比(S/N≥3)计算上述方法的检出限,以10倍信噪比(S/N≥10)计算该方法的定量限,结果见表4。氯吡脲等10种PGRs的检出限在0.03~0.60 μg/kg,定量限在0.10~2.00 μg/kg。
2. 7 添加回收试验结果
在荔枝空白样品添加浓度分别为10、25和100 μg/kg 3个水平,每个水平各6份(n=6),采用基质匹配标准结合外标法定量,计算平均回收率和RSD,考察方法的准确度和精密度,结果见表5。结果显示,10种PGRs在10、25和100 μg/kg 3个水平的回收率为71.8%~109.2%,RSD为0.6%~10.0%,符合方法学要求。
2. 8 实际样品检测结果
采用建立优化后的QuEChERS净化-UPLC-MS/MS测定采集于海南、广东和广西3省(区)荔枝样品40份,共有2份样品检出PRGs,检出率为5.0%;其中1份样品检出多效唑,残留值为0.12 mg/kg,1份样品检出芸苔素内酯,残留值为0.18 mg/kg。检测结果表明当前PGRs在荔枝的残留现象存在,其安全隐患不容忽视。
3 讨论
多组分PRGs残留快速检测方法的建立需要考虑两方面:一是考察仪器对目标待测物检测的可行性和检测条件的优化,如胺鲜酯的分子结构仅有1个羧基,羧基的吸收波长多为100~200 nm,不具备产生紫外吸收的C=C共轭及苯环结构,因此胺鲜酯不适合用HPLC—光电二极管阵列检测器检测(孔祥吉等,2019);二是样品的前处理环节。
本研究选取的10种PGRs在液相串联质谱是可行的,其仪器检测的条件优化包括质谱参数、色谱柱和流动相条件优化选取。当应用不同液相—串联质谱仪检测相同目标化合物时,在仪器最优的条件下,目标待测物的主要离子碎片大小和丰度差异不明显,即其定性定量离子对质量数差异不大,但所对应的碰撞电压和碰撞能量等质谱仪参数因仪器不同会有所差异,应以仪器具体优化参数为准,不能一概而论。因此,本研究优化所得10种PGRs的液相串联质谱检测的定量和定性离子对与邱世婷等(2018)的研究结果差异不大,但碰撞能量等具体仪器参数以本研究应用的仪器优化条件为准。其次是由于不同色谱柱填料极性不同,目标待测物在不同色谱柱的保留时间和峰形有所差异,多组分分析方法的建立需兼顾极性差异较大的各种化合物。C18色谱柱对极性强的化合物保留较差,极性较强的化合物在C18色谱柱出峰较快,甚至是在色谱柱的出峰“死时间”附近。因此,在色谱柱考察过程中,本研究选择极性较强的甲哌啶保留状况作为色谱柱选取的考察指标,根据甲哌啶在6种色谱柱的保留时间,并综合考虑待测物的峰形、响应值和分离度,最终选用Agilent InfinityLab Poroshell 120 EC-C18色谱柱作为后续试验的分离柱。另外,液相流动相的组成不仅会影响目标化合物的保留时间和保留峰形,还会影响离子化效率,进而影响检测灵敏度和准确性。经考察,在乙腈—水和甲醇—水这2个流动相体系中,10种PGRs待测化合物均具有良好的分离度和响应值,从节约成本和环保角度考虑,优选甲醇—水流动相体系。进一步考察发现,在甲醇—水中加入0.1%甲酸能有效改善目标待测物的峰形;在水相中加入5.0 mmol/L乙酸铵后,化合物电离的效果得到改善,更能促进目标化合物的保留、分离及改善化合物保留峰形。因此最终确定甲醇—5.0 mmol/L乙酸铵水溶液(含0.1%甲酸,v/v)缓冲溶液体系作为后续试验的流动相。
样品前处理是多组分农药残留快速检测方法建立的一个重要环节。PGRs在植物体内经代谢后残留量较少,处于微量和痕量水平,且荔枝果肉含有大量的多糖、维生素、脂肪酸和黄酮醇类等干扰成分会使检测灵敏度降低,影响目标化合物检测的准确度,因此荔枝的提取液在仪器检测前需进行净化处理。QuEChERS样品前处理方法中常用MgSO4作为除水剂,用PSA、C18及GCB作为净化材料。PSA可利用乙二胺-N-丙基官能团极性作用和离子交换作用去除待测样品中的有机酸、脂肪酸和糖分等干扰物质;C18具有非极性吸附作用,对样品中所含有极性较弱的脂肪酸、烯烃类和甾醇类具有较好的吸附效果;GCB具有片层结构,可去除叶绿素、类胡萝卜素及固醇类杂质,有很好的吸附效果,但同時对平面结构特别是含有芳香环及对称性结构的农药也具有较强的吸附作用,会导致部分具有平面结构农药化合物的回收率偏低。净化试验结果表明,PSA和C18 的用量均为50 mg时,对目标待测物无吸附作用,但GCB用量为50 mg时,对氯吡脲、噻苯隆、6-苄基腺嘌呤和芸苔素内酯具有吸附作用,即使GCB用量降为7.5 mg时,对噻苯隆和氯吡脲仍存在吸附作用。因此,本研究只选用PSA和C18作为净化材料,且3个添加水平的回收率也取得较好效果。
当前,针对PGRs这一大类农业生产化学投入品,我国在PGRs残留限量标准的项目数量和覆盖食品类别不足,且相应检测技术方法标准不完善,难以满足日趋严苛的残留限量要求。如我国国家标准GB 2763—2019《食品安全国家标准 食品中农药最大残留限量》仅规定多效唑在荔枝的残留限量为0.5 mg/kg;对胺鲜酯、噻苯隆和抗倒酯仅在水果规定临时限量值(未针对荔枝);而对甲哌啶、矮壮素、氯比脲、6-苄基腺嘌呤、芸苔素内酯和抑芽唑未规定其在水果的残留限量值。此外,在GB 2763—2019中目前尚未指定胺鲜酯的检测方法;甲哌啶、矮壮素、6-苄基腺嘌呤、多效唑和抗倒酯这5种PGRs指定检测方法GB/T 20769—2008《水果和蔬菜中450种农药及相关化学品残留量的测定 液相色谱—串联质谱法》规定其检出限分别为0.23、0.03、17.7、0.14和17.67 μg/kg;甲哌啶、苄腺嘌呤和氯吡脲指定检测方法GB/T 20770—2008《粮谷中486种农药及相关化学品残留量的测定 液相色谱—串联质谱》规定其检出限分别为0.45、35.40和5.70 μg/kg;而矮壮素仅在粮油规定其残留限量值,相应指定检测方法GB/T 5009.219—2008《粮谷中矮壮素残留量的测定》规定矮壮素的检出限为10 μg/kg。本研究建立的10种PGRs检测方法的检出限与GB 2763—2019中所指定的检测方法相比较,其检出限均符合相应的检测技术要求。
4 结论
通过优化质谱条件和色谱条件,考察不同流动相和净化材料,建立的QuEChERS净化-UPLC-MS/MS简便、快速,具有良好的灵敏度、准确度和精密度,可用于同步测定甲哌啶等10种PGRs在荔枝中的残留。
參考文献:
胡胜杰,李优,周莹,伊雄海,邓晓军,陈沁,徐敦明,钮冰. 2019. QuEChERS法结合液相色谱—串联质谱测定保健食品中50种非食用添加物[J]. 色谱,37(7):701-711. [Hu S J,Li Y,Zhou Y,Yi X H,Deng X J,Chen Q,Xu D M,Niu B. 2019. Determination of 50 non-edible additives in health food using the QuEChERS method and liquid chromatography-tandem mass spectrometry[J]. Chinese Journal of Chromatography,37(7):701-711.]
胡晓科,孙丹红,文君,杨晓松. 2018. 荧光衍生-HPLC法检测豆芽中苯氧乙酸类植物生长调节剂残留[J]. 分析试验室,37(11):1320-1323. [Hu X K,Sun D H,Wen J,Yang X S. 2018. Determination of phenoxyacetic acid phytohormones residues based on fluorescence derivatization[J]. Chinese Journal of Analysis Laboratory,37(11):1320-1323.]
孔祥吉,孔顺,张雪梅,孔德洋. 2019. 改进QuEChERS-气相色谱—质谱法测定苹果中胺鲜酯残留[J]. 色谱,37(12):1363-1367. [Kong X J,Kong S,Zhang X M,Kong D Y. 2019. Determination of diethyl aminoethyl hexanonate residues in apples by gas chromatography-mass spectro-metry combined with improved QuEChERS[J]. Chinese Journal of Chromatography,37(12):1363-1367.]
乐渊,李春丽,张振山,吴南村,刘春华. 2018a. QuEChERS净化—超高效液相色谱—串联质谱法测定莲雾中植物生长调节剂[J]. 分析科学学报,34(2):234-238. [Le Y,Li C L,Zhang Z S,Wu N C,Liu C H. 2018a. Determination of plant growth regulators in wax apple using QuEChERS method coupled to ultra high performance liquid chromatography-tandem mass spectrometry[J]. Journal of Analytical Science,34(2):234-238.]
乐渊,刘春华,张振山,李春丽. 2018b. 超高效液相色谱—串联质谱法测定莲雾中51种农药残留量[J]. 理化检验(化学分册),54(10):1129-1137. [Le Y,Liu C H,Zhang Z S,Li C L. 2018b. UPLC-MS/MS determination of 51 pesticide residues in Syzygium samarangense[J]. Physical Testing and Chemical Analysis(Part B:Chemical Analysis),54(10):1129-1137.]
马晨,张群,段云,张学强,张利强. 2019. 荔枝上植物生长调节剂使用与残留现状分析[J]. 热带农业科学,39(4):67-75. [Ma C,Zhang Q,Duan Y,Zhang X Q,Zhang L Q. 2019. Usage and residues of plant growth regulators on litchi[J]. Chinese Journal of Tropical Agriculture,39(4):67-75.]
莫迎,张荣林,范兴,薛亚馨,苏海雁,陆小康,韦钰. 2019. 植物源食品中植物生长调节剂检测标准与分析技术研究进展[J]. 食品安全质量检测学报,10(10):2903-2911. [Mo Y,Zhang R L,Fan X,Xue Y X,Su H Y,Liu X K,Wei Y. 2019. Research progress in the detection standards and analytical techniques of plant growth regulators in plant-derived foods[J]. Journal of Food Safety & Quality, 10(10):2903-2911.]
邱世婷,韩梅,侯雪,郭灵安,雷绍荣,陈巧. 2018. 超高效液相色谱—串联质谱法快速检测蔬菜中23种植物生长调节剂[J]. 分析测试学报,37(6):660-668. [Qiu S T,Han M,Hou X,Guo L A,Lei S R,Chen Q. 2018. Rapid detection of 23 plant growth regulators in vegetables by ultra high performance liquid chromatography-tandem mass spectrometry[J]. Journal of Instrumental Analysis,37(6):660-668.]
邱暑婷,林学飞,傅冰梦,金鸿铭,许方鑫,吴淑春. 2017. QuEChERS/高效液相色谱—串联质谱法同时测定葡萄中18种植物生长调节剂残留[J]. 中国卫生检验杂志,27(7):931-936. [Qiu S T,Lin X F, Fu B M,Jin H M,Xu F X,Wu S C. 2017. Simultaneous determination of 18 plant growth regulators in grape by QuEChERS-extraction and high performance liquid chromatography-tandem mass spectrometry[J]. Chinese Journal of Health Laboratory Technology,27(7):931-936.]
王运儒,邓有展,陈永森,李乾坤,吴静娜,杨秀娟,韦璐阳,吴凤,陆仲烟,秦玉燕. 2018. 广西荔枝农药残留现状及膳食风险评估[J]. 南方农业学报,49(9):1804-1810. [Wang Y R,Deng Y Z,Chen Y S,Li Q K,Wu J N,Yang X J,Wei L Y,Wu F,Lu Z Y,Qin Y Y. 2018. State and dietary intake risk assessment of pesticide residue in litchi in Guangxi[J]. Journal of Southern Agriculture,49(9):1804-1810.]
夏虹,彭茂民,劉丽. 2018. QuEChERS-超高效液相色谱—串联质谱法同时测定柑橘中12种植物生长调节剂残留[J]. 食品科技,43(10):340-344. [Xia H,Peng M M,Liu L. 2018. Using QuEChERS method to determine twelve plant growth regulator residues in orange by ultra performance liquid chromatography-mass spectrometry[J]. Food Science and Technology,43(10):340-344.]
严煌倩,李勇,翟丽菲,龙玲,程金金,陈小龙,葛静,杨丽璇,余向阳. 2018. 气相色谱—质谱法结合QuEChERS法快速检测青椒中15种邻苯二甲酸酯[J]. 江苏农业学报,34(2):459-465. [Yan H Q,Li Y,Zhai L F,Long L,Cheng J J,Chen X L,Ge J,Yang L X,Yu X Y. 2018. Determination of 15 phthalate acid esters in pepper by gas chromatography-mass spectrometry with QuEChERS method[J]. Jiangsu Journal of Agricultural Sciences,34(2):459-465.]
张宏军,张佳,李富根,周普国. 2017. 植物生长调节剂最新登记情况分析[J]. 农药科学与管理,38(3):6-14. [Zhang H J,Zhang J,Li F G,Zhou P G. 2017. Analysis on the newly registered plant growth regulators[J]. Pesticide Science and Administration,38(3):6-14.]
张文华,谢文,侯建波,童赟恺,陆顺,汪鹏. 2016. 气相色谱—串联质谱法测定豆芽与番茄中6种植物生长调节剂[J]. 分析测试学报,35(10):1241-1247. [Zhang W H,Xie W,Hou J B,Tong Y K,Liu S,Wang P. 2016. Determination of 6 plant growth regulators in bean sprout and tomato by gas chromatography-tandem mass spectrometry[J]. Journal of Instrumental Analysis,35(10):1241-1247.]
张新中,彭涛,李晓春,张文,苗茜,李晨曦. 2019. 植物生长调节剂的残留与安全性分析[J]. 食品安全质量检测学报,10(3):614-619. [Zhang X Z,Peng T,Li X C,Zhang W,Miao Q,Li C X. 2019. Analysis on the residue and safety of plant growth regulators[J]. Journal of Food Safety & Quality,10(3):614-619.]
周艳明,付婷,胡睿. 2010. 气相色谱法测定蔬菜中三碘苯甲酸残留量[J]. 食品科学,31(12):178-181. [Zhou Y M,Fu T,Hu R. 2010. GC determination of 2,3,5-triiodobenzoic acid residue in vegetables[J]. Food Science,31(12):178-181.]
(责任编辑 罗 丽)
