盐穗木病程相关蛋白HcPR10抗血清的制备及鉴定
2020-01-18张花杨涛衡友强王艳
张花 杨涛 衡友强 王艳


摘 要:病程相關蛋白(PRs)在植物抗病抗逆过程中发挥重要作用。盐穗木病程相关蛋白基因HcPR10(GenBank:KF673356)来自盐穗木(Halostachys capsica)在600 mmol·L-1 NaCl胁迫下的盐抑制差减文库。为探究盐穗木病程相关蛋白HcPR10发挥生物学功能的机制,该研究通过体外表达和纯化HcPR10重组蛋白制备特异性的HcPR10多克隆抗体。并采用双酶切构建原核重组表达载体pET28a-HcPR10,转化至大肠杆菌(Escherichia coli)BL21诱导表达,通过正交分析优化重组蛋白可溶性诱导表达的条件,利用Ni-NTA亲和层析柱纯化融合蛋白,免疫BALB/c小鼠制备多克隆抗体,基于纯化获得的His-HcPR10重组蛋白和转HcPR10拟南芥总蛋白,分别利用ELISA和Western Blotting检测抗血清效价和特异性。结果表明:成功构建重组表达载体pET28a-HcPR10;正交结果显示诱导温度27 ℃,诱导转速200 r·min-1,IPTG浓度0.7 mmol·L-1,诱导时间6 h条件下可诱导表达大量可溶性目的蛋白;ELISA检测抗HcPR10血清效价达1∶243 000,Western Blotting印迹结果显示制备的抗血清可以与重组蛋白和转基因拟南芥(Arabidopsis thaliana)中异源表达的HcPR10蛋白特异性结合。该研究获得了效价高、特异性强的盐穗木病程相关蛋白HcPR10抗血清,为进一步研究HcPR10的亚细胞定位及生物学功能奠定了基础。
关键词:盐穗木病程相关蛋白HcPR10, 原核表达, 蛋白纯化, 抗体制备及鉴定
中图分类号:Q946.1
文献标识码:A
文章编号:1000-3142(2020)12-1732-08
Abstract:Pathogenesis-related proteins (PRs) play important roles in plants in response to pathogen attack and diverse environmental stresses. HcPR10 (GenBank:KF673356) was isolated from the Suppression Subtractive Hybridization cDNA libraries of Halostachys caspica under the stress of 600 mmol·L-1 NaCl. In order to investigate the biological function of HcPR10, the specific polyclonal antibody of HcPR10 was prepared by expression and purification of recombinant HcPR10 protein in vitro. In this study, recombinant prokaryotic expression vector pET28a-HcPR10 was constructed by double digestion and then was transformed into Escherichia coli strain BL21 to induce HcPR10 expression. We explored the optimal expression condition for soluble recombinant protein in BL21 by orthogonal analysis. Fusion proteins which were purified by the Ni-NTA affinity chromatography column were injected to BALB/c mice for preparing the HcPR10 polyclonal antibody. The titer and specificity of HcPR10 antiserum were detected respectively by ELISA and Western Blotting using recombinant protein His-HcPR10 and total protein of transgenic HcPR10 Arabidopsis thaliana. The results were as follows:The recombinant expression vector pET28a-HcPR10 was successfully constructed; The maximum amount of soluble fusion protein was obtained under the 27 ℃, 200 r·min-1 and 0.7 mmol·L-1 IPTG for induction 6 h; The antiserum for HcPR10 possessing 1∶243 000 titer could bind specifically to recombinant protein His-HcPR10 and the heterologous protein from transgenic HcPR10 Arabidopsis thaliana. The high titer and specific antiserum for HcPR10 has been prepared successfully, the results of this study provide the foundation for further investigating the subcellular localization and biological function of HcPR10.
Key words:pathogenesis-related protein 10 from Halostachys caspica (HcPR10), prokaryotic expression, protein purification, antibody preparation and identification
病程相關蛋白(pathogenesis-related proteins,PRs)是植物受到生物或非生物胁迫时诱导表达的一类特异性蛋白,在植物疾病防御、响应生物和非生物胁迫过程中发挥重要作用(温韵洁等,2008)。病程相关蛋白广泛存在于单子叶和双子叶植物中,根据它们的电泳迁移率、植物起源、血清学关系和氨基酸序列同源性,病程相关蛋白被分为17个家族,其中PR10因包含100多个成员而备受关注(Van et al., 2006;Sels et al., 2008)。
PR10首次在体外培养的欧芹(Petroselinum crispum)细胞中发现(Somssich et al., 1988),之后又相继鉴定了水稻(Oryza sativa)、甘蔗(Saccharum officinarum)、三七(Panax notoginseng)和鹰嘴豆(Cicer arietinum)的病程相关蛋白10(Wu et al., 2016;Peng et al., 2017;Tang et al., 2019;Chatterjee et al., 2019),其蛋白分子量在15~19 kDa之间,等电点偏酸性、无信号肽序列、属胞内蛋白(Radauer et al., 2008),是一类结构保守并发挥多种生物学功能的蛋白质(杨涛和王艳,2017)。过表达不同来源的PR10基因能够显著提高转基因植株对多种病原体的抗性(Zandvakili et al., 2017;Tang et al., 2019),目前普遍认为RNase活性是PR10发挥生物胁迫抗性的关键(Peng et al., 2017;Finkina et al., 2017)。体外研究显示具有RNase活性的烟草(Nicotiana tabacum)NtPR10对烟草赤星病菌(Alternaria alternata)具有抑菌活性(张玉等,2018);过表达茉莉酸诱导的病程相关蛋白10(JIOsPR10)增强了水稻对稻瘟病菌(Magnaporthe oryzae)的耐受性(Wu et al., 2016);玉米(Zea mays)ZmPR10也显示出广谱的抗真菌活性(Zandvakili et al., 2017)。近年来,一些研究发现PR10基因也受盐、干旱、寒冷等非生物因子的诱导,在植物非生物胁迫防御中同样发挥重要作用。旱柳(Salix matsudana)SmPR10的过表达增加了拟南芥的盐胁迫抗性,水稻RSOsPR10的过表达增强了水稻对干旱胁迫及剪股颖(Agrostis stolonifera)对干旱和盐胁迫的耐受性(Takeuchi et al., 2016;Han et al., 2017;汪志星等,2018)。除具有抗病和抗逆功能外,近年研究发现来自麝香百合(Lilium longiflorum)的LlPR10、水稻JIOsPR10和水稻OsPR10A的过表达调节了植株的生长发育(Hsu et al., 2014;Wu et al., 2016;张彤等,2019)。虽然植物病程相关蛋白家族PR10已被广泛研究,但其发挥作用的机制仍不清楚。
蛋白质功能的发挥与其在细胞中的位置密切相关(Scott et al., 2005;He et al., 2013),亚细胞定位是蛋白质功能研究的关键特征之一。目前,大部分PR10蛋白亚细胞定位的研究方法主要采用融合报告基因进行显微观察,例如,通过构建融合GFP表达载体,显示辣椒(Capsicum annuum)PR10-LRR1复合物的细胞质定位是引发辣椒叶片细胞死亡的前提(Choi et al., 2012);鹰嘴豆CaABR18蛋白则是一个具有双重作用模式的细胞核定位蛋白,其可通过增加真菌膜的通透性和核崩解从而发挥抗真菌活性(Chatterjee et al., 2019)。此外,采用免疫胶体金技术显示华东葡萄(Vitis pseudoreticulata)VpPR10.2蛋白分布在叶绿体和细胞壁,从而发挥其酶活性并抵抗病原体的早期入侵(He et al., 2013)。以上结果表明不同PR10蛋白定位于不同细胞器,进而通过不同的机制发挥生物学功能。
盐穗木是新疆盐碱环境分布最广泛的建群种和优势种,是盐生植物的先锋代表,有着极强的生命力(郗金标等,2006;Zeng et al., 2015)。HcPR10(GenBank:KF673356)是盐穗木中的一个盐响应基因,前期研究发现该基因受到各种非生物胁迫诱导且可显著提高转基因植物的耐盐和耐旱性(文章未发表),但对其参与生物学功能的机制仍不清楚。PSORT(http://psort.hgc.jp/form.html)在线预测显示盐穗木病程相关蛋白HcPR10可能定位表达在线粒体基质、细胞质和过氧化物酶体等亚细胞水平的结构中。因此,本研究通过构建原核表达载体pET28a-HcPR10,利用大肠杆菌系统表达并纯化融合蛋白His-HcPR10,免疫小鼠,制备效价高、特异性强的盐穗木病程相关蛋白HcPR10的多克隆抗体,为HcPR10的组织和细胞定位及生物学功能研究奠定基础。
1 材料与方法
1.1 材料和试剂
1.1.1 实验材料 拟南芥为Columbia-0(Col-0)生态型,本小组前期通过农杆菌(Agrobacterium)介导的花序浸染法获得了转HcPR10拟南芥OE1和OE9两个纯系植株。大肠杆菌DH5α和BL21感受态细胞购自北京全式金生物技术有限公司,DH5α-pET28a(+)和DH5α-pMD18-T-HcPR10为本实验室保存菌种。
1.1.2 试剂 限制性内切酶Hind Ⅲ、Eco RⅠ、Taq酶及T4 DNA连接酶均购自TaKaRa公司。蛋白和DNA Marker均购自生工生物工程(上海)股份有限公司;BCA法和Bradford法蛋白浓度测定试剂盒购自北京索莱宝科技有限公司;SDS-PAGE电泳各项试剂均为北京赛驰生物科技有限公司产品;辣根过氧化物酶标记的山羊抗小鼠IgG抗体购自北京康为世纪生物科技有限公司;DAB显色试剂盒购自北京中杉金桥生物技术有限公司;其他常用试剂为国产分析纯试剂。
1.2 方法
1.2.1 原核表达载体pET28a-HcPR10的构建 根据本实验前期克隆获得的盐穗木病程相关蛋白HcPR10基因序列(GenBank登录号:KF673356),分别设计上游含Eco RⅠ、下游含Hind Ⅲ限制性内切酶位点的引物,上游引物HcPR10 EP1:5′-cggGAATTCATGGGTGTATTTACAT-3′;下游引物HcPR10 HP2:5′-tgtAAGCTTTCAAGCATAAAGCTG
AGG-3′(下劃线表示相应的酶切位点,小写字母为保护碱基)。以pMD18-T-HcPR10质粒为模板,进行PCR扩增,用1%的琼脂糖凝胶电泳检测。HcPR10 PCR产物和pET28a表达载体双酶切后回收,T4连接酶16 ℃过夜连接,将连接产物转化DH5α菌株,获得的重组质粒pET28a-HcPR10经双酶切鉴定正确后送生工生物工程(上海)股份有限公司测序。
1.2.2 重组蛋白的原核表达、优化及纯化 将测序正确的重组质粒pET28a-HcPR10转化大肠杆菌BL21,按照张冀等(2018)的方法诱导表达目的蛋白,将诱前、诱后、诱后上清和诱后沉淀于4 ℃,12 000 r·min-1,离心2 min,各取20 SymbolmA@
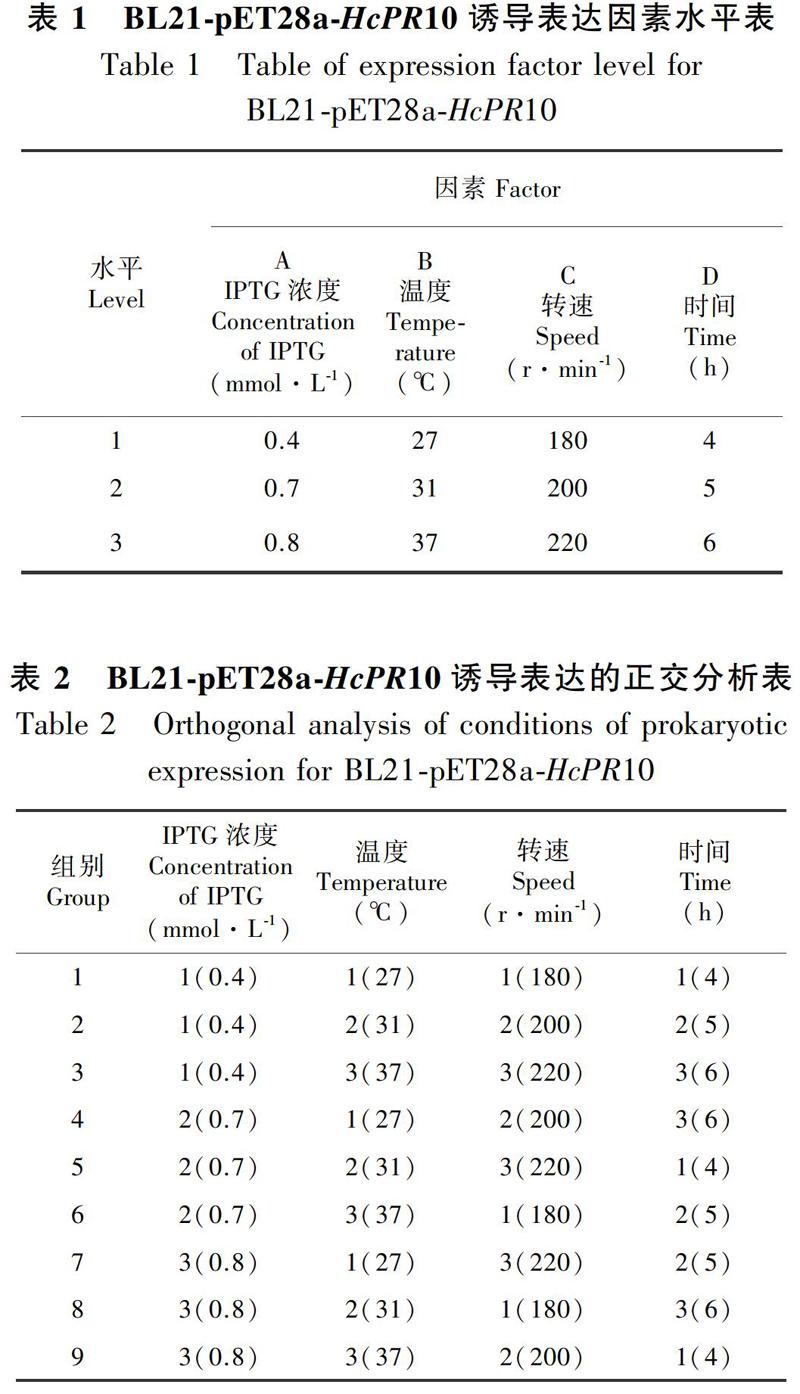
L点样,用15% SDS-PAGE检测。以可溶性融合蛋白占总蛋白含量的百分比为依据,对诱导的IPTG浓度(0.4、0.7、1.0 mmol·L-1)、温度(27、31、37 ℃)、转速(180、200、220 r·min-1)和时间(4、5、6 h)进行4因素3水平正交试验(表1),设计正交分析表(表2),分析这4个因素对HcPR10重组蛋白可溶性的影响,优化表达体系。对正交实验9组不同条件下诱导的蛋白进行SDS-PAGE电泳,并通过ImageJ对电泳条带进行灰度扫描,确定HcPR10原核诱导表达的最佳条件。在最佳诱导条件下表达重组蛋白His-HcPR10,收集菌体,超声破碎,8 000 r·min-1,离心10 min收集上清,上镍柱纯化蛋白,然后用200 mmol·L-1的咪唑洗脱,SDS-PAGE检测洗脱蛋白,用索莱宝公司BCA蛋白定量试剂盒进行定量,分装置于-80 ℃冰箱保存。
1.2.3 抗血清的制备 以纯化的His-HcPR10融合蛋白为抗原,采集免疫前BALB/c小鼠血清为阴性对照。取50 μg抗原与等体积弗氏完全佐剂乳化,采用腹腔注射法对小鼠进行初次免疫,并分别在第10天、第29天、第33天用等体积弗氏不完全佐剂乳化的目的蛋白加强免疫,每只50 μg剂量。第4次免疫4 d后采用眼部取血法采血,将收集的血清37 ℃孵育2 h,4 ℃过夜,5 000 r·min-1,离心15 min分离血清,于-80 ℃保存。
1.2.4 多克隆抗体的效价检测 以纯化的His-HcPR10融合蛋白为抗原每孔加1 μg包被ELISA板,4 ℃过夜,用TTBS洗涤3次,每次10 min,用200 μL 1% BSA封闭液37 ℃封闭1 h。先加入用1% BSA封闭液梯度稀释的免疫前和免疫后血清(每孔100 μL),37 ℃孵育1 h,用TTBS洗涤3次,每次3 min,再加入1∶1 000的HRP标记的山羊抗小鼠IGg二抗,37 ℃孵育1 h,用TTBS洗涤4次,每次3 min,最后以TMB为底物进行显色,待呈现梯度蓝色后每孔加入50 μL 2 mol·L-1的H2SO4终止反应,检测450 nm波长下的吸光度。免疫前血清为对照,免疫前后A450值分别为N和P,以P/N>2.1为标准判断血清有效效价。
1.2.5 Western Blotting检测 以营养土中生长4周龄的拟南芥为材料,按照Koteyeva et al.(2011)所述的方法提取植物总蛋白,用Bradford蛋白浓度测定试剂盒进行蛋白定量。分别取10 μg His-HcPR10重组蛋白和10 μg拟南芥植株总蛋白,经15% SDS-PAGE分离后转印至NC膜上,用含5%脱脂奶粉的PBST 4 ℃过夜封闭,用1∶1 500(v/v)一抗,37 ℃孵育2 h,PBST洗膜3次,每次10 min;加入1∶2 000(v/v)的辣根过氧化物酶标记的山羊抗小鼠IgG,37 ℃孵育2 h,PBST洗涤3次,每次10 min,洗涤后DAB显色。
2 结果与分析
2.1 原核表达载体pET28a-HcPR10的构建及鉴定
提取构建获得的重组质粒pET28a-HcPR10,采用Eco RⅠ和Hind Ⅲ进行双酶切鉴定,经1%琼脂糖凝胶电泳获得了与预期486 bp大小相符的目的基因片段和载体片段(图1),测序结果正确,表明原核表达载体pET28a-HcPR10构建成功。
2.2 重组蛋白HcPR10的原核表达条件优化及纯化
2.2.1 重组蛋白HcPR10的原核表达 将重组质粒pET28a-HcPR10转化到大肠杆菌BL21中,随机挑取4个BL21-pET28a-HcPR10单克隆,在0.7 mmol·L-1 IPTG、37 ℃诱导温度、220 r·min-1诱导转速下进行4 h初步诱导表达,SDS-PAGE电泳结果显示,与诱导前相比,经IPTG诱导后4个单克隆均在约25 kDa处诱导出一条增强的蛋白条带(图2:A),且单克隆间无表达量的差异,表明该蛋白在BL21大肠杆菌中成功表达。对诱导后的蛋白进行超声破碎,用15% SDS-PAGE检测诱导前、诱导后、诱导后上清、诱导后沉淀样品,结果表明重组蛋白HcPR10以可溶性和包涵体两种形式存在(图2:B)。
2.2.2 重组蛋白HcPR10的原核表达优化及纯化 为获得大量可溶性HcPR10重组蛋白,对正交实验9组不同条件下诱导表达的蛋白超声并进行SDS-PAGE检测,使用ImageJ对条带进行灰度扫描,进行含量计算和统计学分析(图3),根据数据显示可知,9组正交实验中第8组的可溶性蛋白含量最低,第4组的可溶性蛋白含量最高,约为第8组的3.5倍,因此,BL21-pET28a-HcPR10菌种在IPTG浓度0.7 mmol·L-1、温度27 ℃、转速200 r·min-1下诱导6 h时表达的可溶性HcPR10重组蛋白量最大。在最优条件下对含有pET28a-HcPR10重组质粒的菌种进行大量表达,收集大肠杆菌菌体,超声破碎,离心取上清液,用组氨酸标签亲和层析柱对上清液中的融合蛋白进行纯化,对诱导前、诱导后、诱导后上清、诱导后沉淀、纯化的His-HcPR10蛋白进行SDS-PAGE检测,结果显示在最优条件下诱导表达后,诱导的目的蛋白大部分以可溶性形式存在,并在純化后得到分子量大小约为25 kDa的目的重组蛋白HcPR10(图4)。以BCA蛋白定量试剂盒测得纯化蛋白浓度为500 μg·mL-1。
2.3 多克隆抗体的免疫效价及特异性分析
采用间接ELISA法检测抗血清效价。将抗血清用1%BSA封闭液按1∶1 000、1∶3 000、1∶9 000、1∶27 000、1∶81 000、1∶243 000稀释后进行测定,结果如图5:A所示。由图5可知,当抗血清稀释243 000倍时,小鼠抗血清的光吸收值与阴性对照相比大于2.1,即抗血清效价达1∶243 000,表明该抗血清滴度较高。以纯化的His-HcPR10重组蛋白、野生型及两个转HcPR10基因拟南芥植株总蛋白为样品进行Western Blotting鉴定,结果显示纯化的重组蛋白在约25 kDa处出现了一条杂交条带(图5:B),两个转HcPR10基因拟南芥株系总蛋白在约18 kDa(图5:C)处均出现了与预期分子量大小一致的特异性杂交条带,而野生型拟南芥总蛋白没有出现杂交条带,说明制备的HcPR10抗血清不仅能与重组的His-HcPR10蛋白结合,而且也能够特异地识别拟南芥中异源表达的HcPR10蛋白。效价高、特异性强的His-HcPR10融合蛋白抗血清制备成功。
3 讨论与结论
高效的蛋白表达系统是研究蛋白结构、定位及功能的基础。本研究的核心目的是纯化目的蛋白,制备效价高、特异性好的盐穗木病程相关蛋白HcPR10的抗血清。大肠杆菌是最常用的原核表达系统,具有遗传背景清楚、遗传稳定、表达量高、成本低廉、表达产物易纯化及使用范围广等优点(Nuc & Nuc, 2006)。此外,本研究选择pET28a作为表达载体,不仅由于其含有高表达目的蛋白的噬菌体T7启动子,且其N端和C端各有一个可编码6个连续His的标签,方便后续融合蛋白的纯化。本试验将构建成功的盐穗木重组表达载体pET28a-HcPR10导入大肠杆菌BL21中诱导表达,诱导后的蛋白以可溶性和包涵体两种形式存在,影响了蛋白的大量获得及后续纯化工作的开展。诱导温度、IPTG浓度、诱导时间和诱导转速是影响原核表达及蛋白可溶性的主要因素,正交试验设计可减少试验次数和缩短试验周期,并能明确各因素对试验结果的影响是否显著以及各因素的交互作用,常被用于多因素多水平的最优搭配探索(温耀安等,2014)。本试验采用正交设计对原核诱导表达条件进行优化,最终确定在温度27 ℃、IPTG 0.7 mmol·L-1、时间6 h、转速200 r·min-1时,融合蛋白HcPR10在大肠杆菌内的可溶性含量最高,从而增加了HcPR10重组蛋白的数量和纯化效率,有助于蛋白纯化及多克隆抗体的制备。赵乐等(2015)选择pET32a作为表达载体,采用控制变量法对诱导温度、诱导时间、IPTG浓度及诱导起始宿主菌密度这4个因素对蛋白表达的影响研究发现,诱导温度30 ℃、IPTG浓度0.4 mmol·L-1、起始宿主菌密度A600为0.8、诱导时间8 h为蛋白可溶性表达的最佳条件。张玉等(2018)选择pCold Ⅱ低温表达载体对目的蛋白表达条件研究显示,与37 ℃相比,15 ℃条件下融合蛋白表达量更大,可溶性更高。因此,推测蛋白诱导表达的最佳培养条件与所选择的表达载体和目的蛋白自身的性质密切相关。
在最佳条件下诱导表达重组蛋白,用Ni2+亲和层析获得纯化的目的蛋白,免疫小鼠获得HcPR10抗血清,ELISA检测结果显示制备的HcPR10抗血清效价达1∶243 000。抗体对抗原蛋白的专一性是抗体应用的关键,本研究提取了野生型和转HcPR10基因拟南芥中的总蛋白,通过Western Blotting鉴定HcPR10抗血清的特异性,结果两个转基因株系OE1、OE9在18 kDa附近均出现一条特异条带,而野生型拟南芥总蛋白没有出现杂交条带,因此,制备的HcPR10抗血清具有高特异性。以上结果为利用该抗血清进一步研究HcPR10蛋白的组织和细胞定位及生物学功能奠定了基础。
综上所述,本研究成功构建了盐穗木病程相关蛋白HcPR10的原核表达载体pET28a-HcPR10。通过4因素3水平正交试验获得了可溶性His-HcPR10重组蛋白表达的最优诱导条件:温度27 ℃、IPTG 0.7 mmol·L-1、时间6 h、转速200 r·min-1,并纯化获得500 μg·mL-1的重组蛋白。制备的多克隆抗体效价达1∶243 000,Western Blotting检测该血清能与转基因植物中异源表达的HcPR10特异性结合,可用于HcPR10的亚细胞定位研究。
参考文献:
CHATTERJEE M, CHAKRABORTY J, DAS S, 2019. Abscisic acid-responsive 18 (CaABR18) protein from chickpea inhibits the growth of the wilt-causing Fusarium oxysporum f. sp. ciceri race1[J]. Plant Mol Biol Rep, 37(3):170-185.
CHOI DS, HWANG IS, HWANG BK, 2012. Requirement of the cytosolic interaction between pathogenesis-related protein10 and leucine-rich repeat protein1 for cell death and defense signaling in pepper[J]. Plant Cell, 24(4):1675-1690.
FINKINA EI, MELNIKOVA DN, BOGDANOV IV, et al., 2017. Plant pathogenesis-related proteins PR-10 and PR-14 as components of innate immunity system and ubiquitous allergens[J]. Curr Med Chem, 24(17):1772-1787.
HAN XJ, HE XL, QIU WM, et al., 2017. Pathogenesis-related protein PR10 from Salix matsudana Koidz exhibits resistance to salt stress in transgenic Arabidopsis thaliana[J]. Environ Exp Bot, 141:74-82.
HE MY, XU Y, CAO JL, et al., 2013. Subcellular localization and functional analyses of a PR10 protein gene from Vitis pseudoreticulatain response to Plasmopara viticola infection[J]. Protoplasma, 250(1):129-140.
HSU SW, LIU MC, ZEN KC, et al., 2014. Identification of the tapetum/microspore-specific promoter of the pathogenesis-related 10 gene and its regulation in the anther of Lilium longiflorum[J]. Plant Sci, 215-216:124-133.
KOTEYEVA NK, VOZNESENSKAYA E, ROALSON EH, et al., 2011. Diversity in forms of C4 in the genus Cleome (Cleomaceae)[J]. Ann Bot, 107(2):269-283.
NUC P, NUC K, 2006. Recombinant protein production in Escherichia coli[J]. Postepy Biochem, 52 (4):448-456.
PENG Q, SU YC, LING H, et al., 2017. A sugarcane pathogenesis-related protein, ScPR10, plays a positive role in defense responses under Sporisorium scitamineum, SrMV, SA, and MeJA stresses[J]. Plant Cell Rep, 36(9):1427-1440.
RADAUER C, LACKNER P, BREITENEDER H, 2008. The Bet v1 fold:an ancient, versatile scaffold for binding of large, hydrophobic ligands[J]. Bmc Evol Biol, 8(1):286-295.
SCOTT MS, GOSLINE SJC, THOMAS DY, et al., 2005. Refining protein subcellular localization[J]. Plos Comput Biol, 1(6):e66.
SELS J, MATHYS J, CONINCK BMAD,et al., 2008. Plant pathogenesis-related (PR) proteins:A focus on PR peptides[J]. Plant Physiol Biochem, 46(11):941-950.
SOMSSICH IE, SCHMELZER E, KAWALLECK P, et al., 1988. Gene structure and in situ transcript localization of pathogenesis-related protein 1 in parsley[J]. Mol Gen Genet, 213(1):93-98.
TAKEUCHI K, HASEGAWA H, GYOHDA A, et al., 2016. Overexpression of RSOsPR10, a root-specific rice PR10 gene, confers tolerance against drought stress in rice and drought and salt stresses in bentgrass[J]. Plant Cell Tiss Organ Cult, 127(1):35-46.
TANG BF, LI X, PU LM, et al., 2019. A pathogenesis-related protein 10 gene PnPR10-3 was involved in molecular interaction between Panax notoginseng and Fusarium solani[J]. Austr Plant Pathol, 48(5):447-456.
VAN LC, REP M, PIETERSE CMJ, 2006. Significance of inducible defense-related proteins in infected plants[J]. Ann Rev Phytopathol, 44(1):135-162.
WANG ZX, LIU N, NI ZY, et al., 2018. Cloning and expression analysis of GhPR-10 gene related to drought stress in Gossypium hirsutum[J]. Genom Appl Biol, 37(5):1993-2002.[汪志星, 刘娜, 倪志勇, 等, 2018. 陆地棉干旱胁迫相关基因GhPR-10的克隆及表达分析[J]. 基因组学与应用生物学,37(5):1993-2002.]
WEN YA, ZHU Z, SHI Y, et al., 2014. Research on optimization expression conditions of plectasin prokaryotic expressions by the orthogonal experiment[J]. Pharm Biotechnol, 21(5):424-428.[温耀安,朱哲,石羽,等,2014. 抗菌肽Plectasin原核表达条件的正交试验优化研究[J]. 药物生物技术,21(5):424-428.]
WEN YJ, HE HW, HUANG QS, et al., 2008. Roles of pathogenesis-relative protein 10 in plant defense response[J]. Plant Physiol J, 44(3):585-592.[温韵洁,何红卫,黄群声,等,2008. 病程相关蛋白10在植物防御反应中的作用[J]. 植物生理学报,44(3):585-592.]
WU JN, KIM SG, KANG KY, et al., 2016. Overexpression of a pathogenesis-related protein 10 enhances biotic and abiotic stress tolerance in rice[J]. Plant Pathol J, 32(6):552-562.
YANG T, WANG Y, 2017. Research progress on plant pathogenesis related protein PR-10[J]. Plant Physiol J, 53(12):2057-2068.[杨涛,王艳,2017. 植物病程相关蛋白PR-10的研究进展[J]. 植物生理学报, 53(12):2057-2068.]
ZANDVAKILI N, ZAMANI M, MOTALLEBI M,et al., 2017. Cloning, overexpression and in vitro antifungal activity of, Zea Mays PR10 protein[J]. Iran J Biotechnol, 15(1):42-49.
ZENG YL, LI L, YANG RR, et al., 2015. Contribution and distribution of inorganic ions and organic compounds to the osmotic adjustment in Halostachys caspica response to salt stress[J]. Sci Rep, 5(1):13639.
ZHAI JB, TIAN CY, YAN P, et al., 2006. Primary research on the halophyte flora in Xinjiang[J]. Chin J Eco-Agric, 14(1):7-10.[郗金标,田长彦,阎平,等,2006. 新疆盐生植物区系初探[J]. 中国生态农业学报,14(1):7-10.]
ZHANG J, ZHANG LL, ZHANG BB, et al., 2018. Prokaryotic expression of Halostachys caspica HcDMC1 and preparation of its antiserum[J]. Bull Bot Res, 38(3):399-405.[张冀,张丽丽,张贝贝,等,2018. 盐穗木HcDMC1的原核表达和抗血清的制备[J]. 植物研究,38(3):399-405.]
ZHANG T, GUO YL, CHEN Y, et al., 2019. Expression characterization of rice OsPR10A and its function in response to drought stress[J]. Chin Bull Bot, 54(6):711-722.[张彤,郭亚璐,陈悦,等,2019. 水稻OsPR10A的表达特征及其在干旱胁迫应答过程中的功能[J]. 植物学报,54(6):711-722.]
ZHANG Y, WANG J, ZHOU SQ, et al., 2018. Biological activity of tobacco PR10 protein and expression analysis induced by Alternaria alternata[J]. J Plant Protect, 45(3):455-462.[张玉,王杰,周世奇,等,2018. 烟草PR10蛋白生物活性及赤星病菌Alternaria alternata诱导下的表达分析[J]. 植物保护学报,45(3):455-462.]
ZHAO L, MA LG, WANG ZS, et al., 2015. Cloning and expression analysis of pathogenesis-related protein 10 gene of Salvia miltiorrhiza[J]. Acta Bot Boreal-Occident Sin, 35(6):1078-1084.[趙乐,马利刚,王志霜,等,2015. 丹参病程相关蛋白基因PR10的克隆与表达分析[J]. 西北植物学报,35(6):1078-1084.]
(责任编辑 周翠鸣)
