中华鳖腿肉蛋白的理化性质
2020-01-13马梦娇荆慧娟符安卫王洪新吕文平
马梦娇,荆慧娟,符安卫,王洪新,3,吕文平*
1(江南大学 食品学院,江苏 无锡,214122)2(广西亿泰宁生物科技有限公司,广西 南宁,530029) 3(江南大学国家功能食品工程技术研究中心,江苏 无锡,214122)
中华鳖(Chinese soft-shelled turtle)又称甲鱼,味道鲜美,营养丰富,自古就是我国传统食疗滋补佳品[1],具有提高免疫力、促进伤口愈合与新陈代谢、抗疲劳等功效[2]。
目前,对于中华鳖肉的研究大多集中在营养成分的分析等方面[3-4]。而中华鳖蛋白组成及其结构表征和功能特性等方面的研究鲜有报道[1,5]本研究以中华鳖肉为原料,对其蛋白质的氨基酸组成及蛋白组分进行了分析,并通过碱溶酸沉法提取得到鳖肉蛋白,并对其结构与功能特性进行研究,为鳖肉蛋白的综合利用提供了理论基础。
1 材料与方法
1.1 材料与试剂
中华鳖,广西亿泰宁生物科技有限公司提供;标准分子质量蛋白,大连宝生物试剂有限公司;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)蛋白上样缓冲液(2×)、蛋白质浓度测定试剂盒,上海碧云天生物科技有限公司;Na2HPO4、NaH2PO4、KH2PO4、KI、十二烷基硫酸钠(SDS),国药化学试剂有限公司。
1.2 仪器与设备
氨基酸分析仪,美国Agilent公司;M5全波长酶标仪,美国Molecular Devices公司;Chirascan V100圆二色光谱仪,英国Applied Photophysics公司;Q200差示扫描量热仪,美国TA Instruments公司;NEXUS傅里叶变换红外光谱仪,美国Thermo Nicolet公司;SCIENTZ-10N真空冷冻干燥机,宁波新芝生物科技股份有限公司;MBL50实验室高剪切分散乳化机,默格机械上海有限公司。
1.3 实验方法
1.3.1 原料的预处理
新鲜的中华鳖宰杀、放血并洗净血水,去除内脏及附带筋皮,取腿肉,组织捣碎制成肉糜。
1.3.2 营养成分测定
水分含量的测定,GB 5009.3—2016《食品中水分的测定》;灰分含量的测定,GB 5009.4—2016《食品中灰分的测定》;蛋白质含量的测定:GB 5009.5—2016《食品中蛋白质的测定》;脂肪含量的测定,GB 5009.6—2016《食品中脂肪的测定》。水解氨基酸的测定,参照GB 5009.124—2016《食品中氨基酸的测定》并略作修改。
其中,利用氨基酸评分(amino acid score,AAS)、化学评分(chemical score,CS)和氨基酸的支/芳值(BCAA/AAA)对中华鳖肉的氨基酸营养进行评价。
(1)
(2)
(3)
1.3.3 肌红蛋白含量测定
称取2.0 g样品,加入20 mL磷酸缓冲液(0.04 mol/L,pH 6.8),10 000 r/min均质25 s,冰浴静置1 h,10 000 r/min离心30 min(4℃),用Whatman Grade 1滤纸过滤,滤液用缓冲液定容至25 mL,分别测定572、565、545和525 nm处的吸光值[6]。肌红蛋白(myoglobin,Mb)、脱氧肌红蛋白(deoxymyoglobin,DMb)、氧合肌红蛋白(oxymyoglobin,MbO2)和高铁肌红蛋白的(metmyoglobin,MMb)含量按照公式(4)、(5)、(6)和(7)计算:
Mb/(mmol·L-1)=-0.166A572+0.086A565+0.088A545
+0.099A525
(4)
DMb/%=(0.361R1+1.140R2-0.941R3+0.015)×100
(5)
MbO2/%=(0.882R1-1.267R2+0.809R3-0.361)×100
(6)
MMb/%=(-2.541R1+0.777R2+0.800R3+1.098)×
100
(7)
式中:A572、A565、A545和A525分别为572、565、545和525 nm处的吸光值;R1=A572/A525,R2=A565/A525,R3=A545/A525。
1.3.4 蛋白质组成分析
取样品20 g,分别以10倍体积的0.03 mol/L磷酸缓冲溶液(pH 7.4),10 000 rpm匀浆1 min,4℃提取1.5 h,5000 rpm离心20 min取上清液,重复2次,上清液为肌浆蛋白;在肌浆蛋白中加入30 g/L三氯乙酸(使三氯乙酸终浓度为100 g/L),3 000 r/min离心15 min,上清液为非蛋白氮。向提取肌浆蛋白后所得的沉淀中加入10倍体积0.1 mol/L磷酸缓冲溶液(含1.1 mol/L KI,pH 7.4),提取方法同上,上清液为肌原纤维蛋白;沉淀用去离子水洗涤2次后分成3份。第1份溶于10倍体积氯仿-甲醇(体积比3∶1)溶液,60℃水浴1 h除去脂肪,得总基质蛋白;第2份溶于10倍体积0.1 mol/L乙酸溶液,25℃提取24 h(200 r/min振摇),5 000 r/min离心20 min取上清液,得酸溶性基质蛋白;第3份溶于10倍体积0.1 mol/LNaOH溶液,25℃提取10 h(200 r/min振摇),5 000 r/min离心20 min,上清液为碱溶性基质蛋白,沉淀经中和、水洗及除去脂肪后,得碱不溶性基质蛋白。采用凯氏定氮法分别测定非蛋白氮、肌浆蛋白、肌原纤维蛋白、酸溶蛋白和碱溶蛋白的含量,总基质蛋白与碱不溶蛋白于105℃恒重测定其含量[7-8]。
1.3.5 蛋白质溶解性测定
取等量样品,加入9倍体积去离子水,10 000 r/min匀浆2 min,分别调节pH为2.0~12.0,4℃浸提30 min,10 000 r/min离心20 min取上清液,BCA(bicinchoninic acid)法测定蛋白含量,根据公式(8)计算蛋白质的溶解度。
(8)
1.3.6 蛋白质的提取
通过碱溶酸沉法提取鳖肉蛋白,加入2倍体积的去离子水,调节pH至中性,用30倍体积的去离子水透析,冷冻干燥后得到鳖肉蛋白,凯氏定氮法测定其蛋白含量,计算提取率。
1.3.7 SDS-PAGE分析
参考LAEMMLI[9]和YONGSAWATDIGUL等[10]的方法。配制2 mg/mL的蛋白溶液,与上样缓冲液以体积比4∶1混合,100℃预热10 min,取上清液10 μL进行电泳,浓缩胶与分离胶的质量分数分别为5%和12%。考马斯亮蓝R-250(质量分数0.1%)染色,甲醇-乙酸脱色液脱色。
1.3.8 红外光谱测定
称取1 mg蛋白样品与一定量光谱纯溴化钾于玛瑙研钵中研磨至粉末状,装样并压制成透明薄片,在400~4 000 cm-1进行扫描。对酰胺Ι带(1 600~1 700 cm-1)作傅里叶去卷积与二阶导数图谱,并采用Gausse函数拟合,计算各二级结构的相对百分含量[11-12]。
1.3.9 热特性分析
称取5 mg蛋白于铝制坩埚中,压制密封,以空铝坩埚为空白对照,利用差式扫描量热仪进行分析,扫描范围40~100℃、升温速率10℃/min。
1.3.10 乳化性与乳化稳定性
将蛋白溶于30 mmol/L的磷酸缓冲液(含0.6 mol/L NaCl,pH 7.0),配制1 mg/mL蛋白溶液25 mL,加入10 mL葵花油,10 000 r/min均质1 min,分别在乳化0和10 min时于底部吸取200 μL,以0.1% SDS稀释至10 mL,在500 nm处测定吸光值,乳化活性(emulsification activity,EA)与乳化稳定性(emulsification stabitity,ES)按照式(9)和(10)计算[13-14]:

(9)
(10)
式中:φ为油相体积分数,φ=2/7;C为蛋白质质量浓度,g/mL;A0与A10分别为乳状液在0 min和10 min的吸光值。
1.3.11 起泡性与起泡稳定性
配制质量浓度1 mg/mL的蛋白溶液(方法同1.3.10)100 mL于量筒中,10 000 r/min均质2 min,记录均质后的体积,静置30 min后再次记录体积。起泡能力(foaming capacity,FC)和泡沫稳定性(foaming stabitity,FS)的计算公式(11)和(12)如下[15]:
(11)
(12)
式中:V0,初始体积,V1和V2分别为均质后和静置30 min后的体积。
1.3.12 表面疏水性
取1 mg/mL的鳖肉蛋白溶液1 mL,加入1 mg/mL的溴酚蓝溶液200 μL混合,室温振荡10 min,2 000×g离心15 min,取上清液1 mL稀释10倍,以磷酸盐缓冲液作为对照,于595 nm处测定其吸光度值A,蛋白表面疏水性以蛋白结合溴酚蓝的量(BPB)表示,按公式(13)计算:
(13)
1.3.13 数据统计与分析
所有试验均重复3次,数据以平均值±标准偏差表示,采用SPSS 17.0和Origin 8.2进行数据分析处理。
2 结果与分析
2.1 基本成分分析
由表1可得,中华鳖肉中的蛋白质含量为(18.61±0.67)%,明显高于猪肉(肥瘦)13.2%、鸭肉15.5%以及河虾16.4%、草鱼16.6%和河蟹17.5%,略低于羊肉(肥瘦)19.0%、牛肉(肥瘦)19.9%和鸡肉19.3%[16],因此中华鳖肉是一种高蛋白、低脂肪的肉类食品原料。

表1 中华鳖肉基本营养成分Table 1 The nutritional components of Chinesesoft-shelled tutle meat
2.2 氨基酸组成分析
中华鳖肉的氨基酸的组成如表2所示。由氨基酸组成可知,谷氨酸是鳖肉中含量最丰富的氨基酸,占氨基酸总量(total amino acid,TAA)的18.52%,其次为天冬氨酸9.29%、赖氨酸9.15%、亮氨酸8.23%以及精氨酸6.13%。其中必需氨基酸总含量(essential amino acid,EAA)占氨基酸总量的40.82%,非必需氨基酸含量(nonessential amino acid,NEAA)占氨基酸总量的49.32%。根据FAO/WHO的理想模式,蛋白质氨基酸组成的EAA与TAA的比值在0.4左右且EAA与NEAA的比值在0.6以上的蛋白质为优质蛋白质。中华鳖肉中EAA/TAA为0.41,EAA/NEAA为0.83,均优于FAO/WHO推荐标准。由此可见,中华鳖肉不仅氨基酸种类齐全,而且氨基酸之间的比例适宜,可以作为补充氨基酸的优质蛋白源。

表2 中华鳖肉的氨基酸组成Table 2 Amino acids composition of Chinesesoft-shelled tutle meat
2.3 氨基酸营养评价
本试验以FAO/WHO于1973年建议的每克氮中氨基酸评分标准模式和中国预防医学科学院营养与食品卫生研究所提出的全鸡蛋蛋白质氨基酸模式为依据,对中华鳖肉所含的人体必需氨基酸进行营养价值评定。将必需氨基酸含量(%,以干重计)数据乘以 0.625 换算成每克氮中含氨基酸的毫克数后,分别计算出它们的氨基酸评分(amino acid score,AAS)、化学评分(chemical score,CS)和必需氨基酸指数(essential amino acid index,EAAI),结果见表3。

表3 中华鳖肉的氨基酸营养评价Table 3 Amino acids nutrition valuation of Chinesesoft-shelled tutle meat
由表3可知,中华鳖肉必需氨基酸中苏氨酸、缬氨酸、异亮氨酸、亮氨酸、赖氨酸、色氨酸、蛋氨酸+半胱氨酸以及苯丙氨酸+酪氨酸的AAS均接近或大于1,CS除色氨酸和蛋氨酸+半胱氨酸外均大于0.5。这表明其必需氨基酸组成与人体的需求模式(FAO/WHO氨基酸评分标准模式)相对平衡,且含量也比较丰富。其中赖氨酸与异亮氨酸的氨基酸评分和化学评分均较高,明显高于FAO/ WHO理想蛋白模式。根据AAS结果和CS结果,中华鳖肉的第一限制性氨基酸均为色氨酸,第二限制性氨基酸均为蛋氨酸+半胱氨酸。
2.4 肌红蛋白含量
动物肌肉中的肌红蛋白含量是影响肉色的主要因素。中华鳖肉中肌红蛋白含量处于较高的水平(2.22±0.04)mg/g,明显高于猪肉1.26 mg/g、鸡肉0.99 mg/g[17]以及鲣鱼0.55 mg/g[18],这可能与肌红蛋白的贮氧功能以及中华鳖独特的呼吸方式有关。正常肌肉的色泽不仅与肌红蛋白含量有关还与其氧化还原状态有关。肌红蛋白在还原态时,为暗红色的脱氧肌红蛋白;在充氧状态时,为鲜红色的氧合肌红蛋白;在氧化状态,为褐色的高铁肌红蛋白[19]。如图1所示,中华鳖肉中肌红蛋白大多以氧合肌红蛋白的形式存在(69.57%),小部分以脱氧肌红蛋白的形式存在(15.63%),高铁肌红蛋白含量很少(0.97%),鳖肉整体颜色发亮发红,具有诱人的色泽,是新鲜肉的主要特征。

图1 不同形式肌红蛋白的含量Fig.1 The content of different forms of myoglobin
2.5 蛋白质组成分析
中华鳖肉的蛋白质组成如图2所示。中华鳖肉中各组分蛋白的含量为:肌原纤维蛋白>总基质蛋白>碱溶蛋白>碱不溶蛋白>肌浆蛋白>酸溶蛋白,分别占总蛋白含量的48.35%、17.25%、11.84%、10.84%、10.04%和1.54%。肌原纤维蛋白是组成鳖肉最主要的蛋白质,在很大程度上决定了蛋白质的功能特性。其次为总基质蛋白,主要由胶原蛋白及弹性蛋白组成,因此赋予鳖肉以具有较好的弹性口感[20]。碱不溶性蛋白的含量也与肉质有关,中华鳖肉中碱不溶性蛋白含量明显低于畜禽动物蛋白的16%~18%,高于鱼虾蛋白的3%~4%,即其肉质软嫩程度位于鱼虾和畜禽肉类之间[2,21]。

图2 中华鳖肉的蛋白质组成Fig.2 Protein components of Chinese soft-shelled turtle
2.6 蛋白质溶解度分析
根据蛋白质的pH溶解曲线可以确定蛋白质的最佳溶解及沉淀pH值。如图3所示,在pH 2.0~12.0,蛋白质的溶解度呈“U形”变化。当pH为5.0~6.0时,鳖肉蛋白质的溶解度最小,因此鳖肉蛋白质的等电点pI位于5.0~6.0,属于偏酸性蛋白。考虑到蛋白质较长时间处于极端pH条件下可能会发生变性或水解,且为了提高蛋白的提取率,一般选择碱性溶液提取酸性蛋白[22]。因此分别选用11.0和5.0作为蛋白质的溶解和沉淀的pH值。
2.7 蛋白提取效果
根据凯氏定氮法求得,利用碱溶酸沉法得到的鳖肉蛋白其蛋白含量为(77.58±1.43)%,蛋白提取率为(43.19±0.68)%。

图3 鳖肉蛋白在不同pH下溶解性的变化Fig.3 Solubility of Chinese soft-shelled turtle protein at a various pH
2.8 SDS-PAGE分析
鳖肉蛋白的电泳条带如图4所示。鳖肉蛋白的分子质量主要集中分布在29.0~200 kDa,在14.3~29.0 kDa也有小量条带分布。其中分子质量分别为36、43、200 kDa的原肌球蛋白(trpomyosin,Tm)、肌动蛋白(actin)和肌球蛋白重链(myosin heavy chain,MHC)是图谱中浓度较深的3条条带。鳖肉蛋白条带中还含有106.9 kDa的α-辅肌动蛋白(α-actinin)、70 kDa的原弹性蛋白(tropoelastin)、51 kDa的结蛋白(desmin)、30.2~35.5 kDa的α-原肌球蛋白(α-tropomyosin)、23 kDa与18 kDa的肌钙蛋白(troponin,TnI;tropninC,TnC)以及15~25 kDa的肌球蛋白轻链(myosin light chain,MLC)[23-24],60~95 kDa的不明条带则可能由于肌原纤维蛋白降解产生的。其中,肌球蛋白、原肌球蛋白、肌动蛋白等是构成肌原纤维蛋白的主要蛋白质,因此可以判断肌原纤维蛋白是组成鳖肉蛋白的主要蛋白质,这与2.5蛋白组成分析中的结论相一致。

图4 鳖肉蛋白的SDS-PAGE电泳图谱Fig.4 SDS-PAGE pattern of Chinese soft-shelled turtle protein
2.9 红外光谱与二级结构分析
图5为鳖肉蛋白的红外光谱图,该蛋白质的酰胺Ⅰ带(1 600~1 700 cm-1)的强吸收峰位于1 654 cm-1处,是由C=O伸缩振动引起的;酰胺Ⅱ带(1 600~1 500 cm-1)出现在1 534 cm-1处,是由C—N伸缩振动、N—H弯曲振动、CH2弯曲和COO—对称伸缩共同引起的。酰胺Ⅲ带(1 330~1 220 cm-1)位于1 309 cm-1和1 237 cm-1处,主要是由同相N—H弯曲振动和C—N伸缩振动共同引起的。其中由于酰胺Ⅰ带通常不受肽链侧基影响,振动频率取决于肽链构型,因此常用其来分析蛋白质的二级结构。
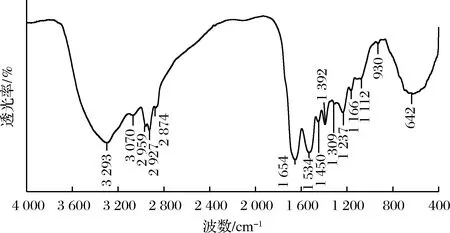
图5 鳖肉蛋白的傅里叶变换红外光谱Fig.5 Infrared spectra of Chinese soft-shelled turtle protein
已有文献[12]证明,红外光谱拟合曲线各子峰位置与二级结构有如下对应关系:(1 694±2)cm-1、(1 689±2)cm-1、(1 683±2)cm-1、(1 671±3)cm-1和(1 663±4)cm-1为β-转角;(1 653±4)cm-1为α-螺旋;(1 645±4)cm-1为不规则卷曲;(1 675±5)cm-1和(1 630±10)cm-1为β-折叠。依次对酰胺Ⅰ带进行傅里叶去卷积、二阶导数和Guassian拟合,得到鳖肉蛋白的酰胺Ⅰ带拟合结果如表3所示。鳖肉蛋白二级结构主要以α-螺旋为主,含量为59.39%,其次是β-折叠34.92%和β-转角5.69%。由于α-螺旋为紧密无腔的结构,结构稳定,不利于鳖肉蛋白发挥其功能特性,而β-结构(40.61%)的紧密程度和构象稳定性比α-螺旋差,使得鳖肉蛋白柔韧性得到改善[25]。

表4 中华鳖肉蛋白酰胺Ⅰ带拟合结果Table 4 Amide Ι band fitting results of Chinesesoft-shelled turtle protein
2.10 热特性分析
如图6所示,鳖肉蛋白的热变性是一个吸热的过程。在温度分别为49.45℃(Tmax1,峰Ⅰ)和83.56℃(Tmax2,峰Ⅱ)时可以观察到2个峰。峰Ⅰ反映了肌球蛋白的热变性,其变性焓为0.147 4 J/g;而峰Ⅱ则反映了肌动蛋白的热变性,其变性焓为0.089 J/g,肌动蛋白的稳定性比肌球蛋白的热稳定性好[26-27]。
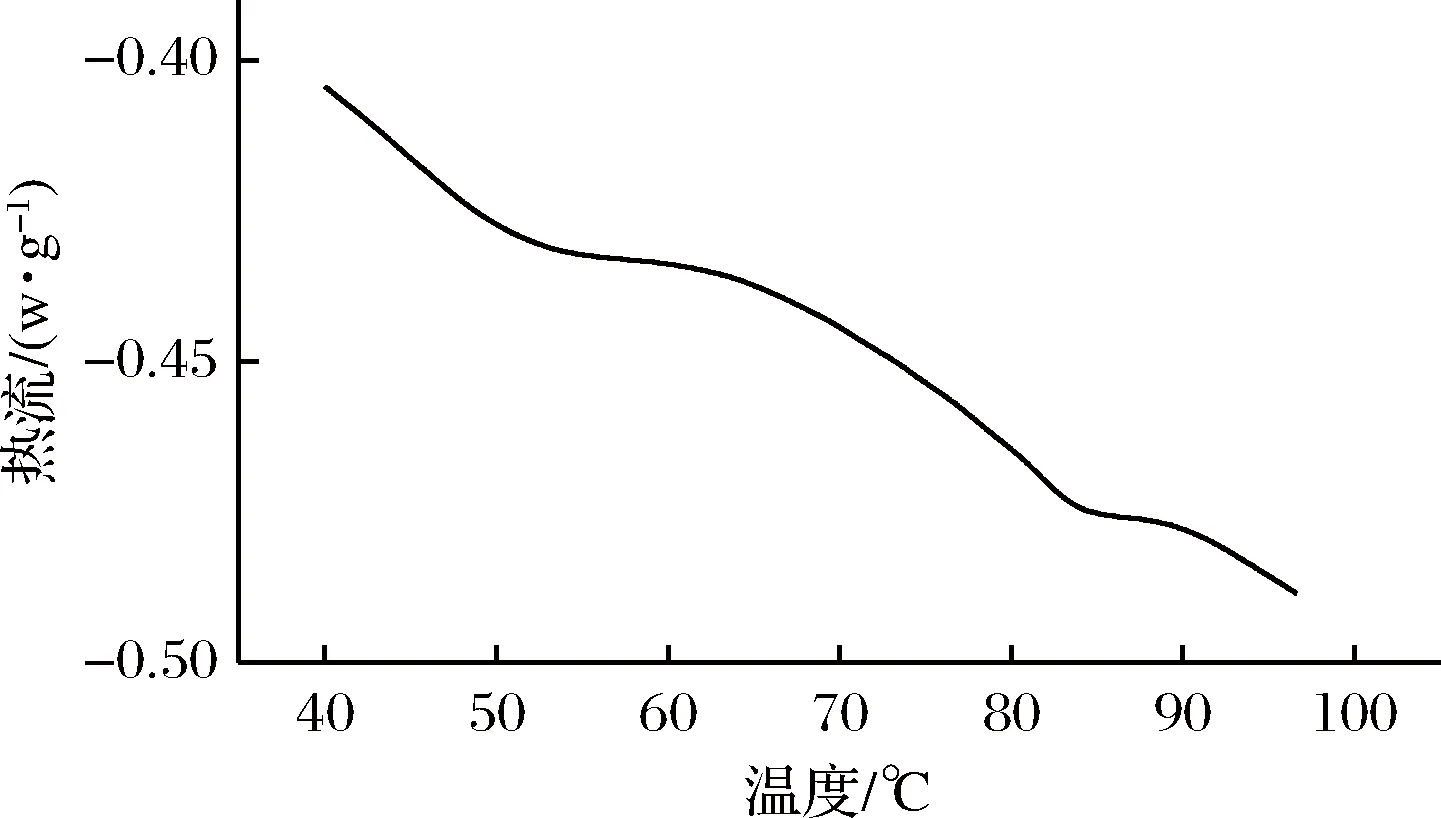
图6 鳖肉蛋白的DSC图谱Fig.6 DSC thermograms of Chinese soft-shelled turtle protein
2.11 功能特性
鳖肉蛋白和大豆分离蛋白的乳化性与起泡性如表5所示。蛋白质的乳化性主要表现为其固定脂肪的能力,而蛋白质的起泡性是指蛋白质降低气-液界面张力形成气泡的能力[28]。由表5可知,与大豆分离蛋白相比,鳖肉蛋白乳化活性和乳化稳定性均高于大豆分离蛋白,这可能与鳖肉中富含肌原纤维蛋白有关,由2.5和2.8可知,肌原纤维蛋白是鳖肉蛋白中含量最多的蛋白组分,其能够形成稳定的凝胶网状结构,紧密地包裹脂质颗粒[29],从而发挥其良好的乳化性。蛋白质的表面疏水性也是影响其乳化性的主要因素,蛋白表面的疏水性氨基酸含量越多,即其表面疏水性越大。由表5可知,鳖肉蛋白的表面疏水性>大豆分离蛋白,这可能是由于鳖肉蛋白表面的疏水基团更易与磷脂发挥作用,从而具有较好的乳化性[30]。鳖肉蛋白起泡能力远远低于大豆分离蛋白,这可能是由于蛋白的起泡性主要与其溶解性有关,鳖肉蛋白暴露出更多的疏水基团,使得蛋白质溶解度较小,导致起泡性也比较小。

表5 中华鳖肉蛋白的功能特性Table 5 Properties of Chinese soft-shelled turtle protein
3 结论
本研究测定鳖肉的蛋白质含量为(18.61±0.67)%,其氨基酸组成符合FAO/WHO的理想模式。鳖肉中肌红蛋白的含量为(2.22±0.04)mg/g,且大多以氧合肌红蛋白的形式存在(69.57%),小部分以脱氧肌红蛋白的形式存在(15.63%),高铁肌红蛋白含量很少(0.97%);组成中华鳖肉的蛋白组分含量分别为:肌原纤维蛋白(48.35%)、总基质蛋白(17.25%)、碱溶蛋白(11.84%)、碱不溶蛋白(10.84%)、肌浆蛋白(10.04%)和酸溶蛋白(1.54%)。通过分别在pH 11.0和pH 5.0利用碱溶酸沉法提取得到鳖肉蛋白,其蛋白含量为(77.58±1.43)%,提取率为(43.19%)。鳖肉蛋白的SDS-PAGE显示其分子质量主要集中在29.0~200 kDa,蛋白条带主要为肌球蛋白、肌动蛋白和原肌球蛋白。鳖肉蛋白的二级结构中α-螺旋、β-折叠和β-转角的相对含量分别为59.39%、34.92%和5.69%。鳖肉蛋白的DSC结果主要体现为肌球蛋白和肌动蛋白的热变性,其变性温度分别为49.45℃和83.56℃。通过与大豆分离蛋白相比,鳖肉蛋白的乳化性能优于大豆分离蛋白,而起泡性能则相反。综上,鳖肉蛋白是一种营养丰富且加工性能良好的蛋白质。
