饲料中苏氨酸含量对建鲤肉质及组织蛋白酶B、L的影响
2020-01-13白稚子刘明宇李树红林昊林灵李冉陈治光陈秀华
白稚子,刘明宇,李树红,林昊,林灵,李冉,陈治光,陈秀华
(四川农业大学 食品学院,四川 雅安,625014)
苏氨酸作为动物生长所需的必需氨基酸,已被广泛应用于畜禽饲料中,成为提高畜禽肉产率的关键营养素之一。大量研究也表明,适宜营养水平的苏氨酸对促进陆生动物生长性能[1-2]、机体免疫[3-4]、肠道发育[5]及抗氧化特性[6]等方面发挥了重要作用。然而作为鱼饲料中的限制性氨基酸,其对不同种经济鱼类的适宜水平目前研究尚不透彻,进行全面系统的探究十分有必要。
鲤鱼是我国最重要的淡水经济鱼种之一,年养殖产量约为280万t[7]。其中,建鲤(CyprinuscarpiovarJian)由于生长快、适应性强、抗病能力强且肉质鲜嫩,已成为我国鲤鱼养殖的主导品种[8]。团队前期针对饲料苏氨酸水平对幼建鲤生长性能、蛋白质合成、消化吸收能力、免疫功能的影响作用进行了较系统的研究。设计7.4、9.1、12.2、15.7、18.6、22.3、25.2 g/kg 7个饲料苏氨酸水平,发现相对于缺乏组和过量组,仅适宜水平(15.7 g/kg)苏氨酸组,建鲤存活率、免疫性能、生长性能显著增强,尤其是其蛋白质沉积率加快[9-11]。鉴于上述作用,推测饲料苏氨酸水平可能与建鲤鱼肉肉质特性也存在有一定的潜在联系,然而关于饲料苏氨酸水平对建鲤鱼肉品质的影响尚未见报道。
肉质是一个综合性状,肉质好坏不仅与肌肉的物理、化学特性密切相关,某种程度上更是直接取决于肌纤维特性或者状态[12]。原料鱼肉硬度是影响鱼肉片品质的重要因素。鱼肉本身质地柔软,并且大量研究表明鱼类死后,溶酶体半胱氨酸组织蛋白酶B、L参与了肌纤维自溶,这些具有高内肽酶活性的酶类破坏死后鱼肉肌肉肌球蛋白完整性,从而加速了宰后鱼肉片的软化[13],导致鱼肉硬度品质劣变。
对于陆生动物,组织蛋白酶B可能与肉质,如嫩度[14-15]、背膘厚度[16]之间存在某些潜在关联,被视为影响肉品品质的候选因子;值得注意的是,鱼类营养摄入情况的改变或饲料中某些营养素成分和含量的改变,可进一步导致该类酶活或表达量的改变。饲料中脂肪酸的种类与含量,可影响大西洋鲑鱼(Salmosalar)体内组织蛋白酶B的活性或其基因表达水平,同时使其鱼肉质构发生改变[17]。由此推测,组织蛋白酶B、L作为鱼肉品质的潜在影响因子,其可能受到营养水平的调节。
然而对饲料苏氨酸水平对鱼肉品质影响的研究尤其是与组织蛋白酶B、L的潜在关系未见报道,为此,本实验在前期工作基础上,以苏氨酸缺乏组(7.4 g/kg)为对照,通过测定、比较及分析建鲤鱼肉品质指标(肌纤维直径、密度、肌纤维耐折力、肌原纤维断裂指数、剪切力、肌肉pH值、失水率)及组织蛋白酶B、L活性和表达,初步探讨了饲料中适宜水平(15.7 g/kg)和过量水平(25.2 g/kg)苏氨酸对建鲤鱼肉品质的影响及对组织蛋白酶B、L的影响,为进一步研究鱼类苏氨酸营养水平与鱼肉品质关系及其可能的作用机制奠定实验前提,并以期达到通过合理调节饲料苏氨酸营养素水平进一步提高建鲤鱼肉品质的应用目标。
1 材料与方法
1.1 材料与试剂
1.1.1 动物性实验材料
选择450尾健康幼鱼((初始体重13.60±0.02)g),由四川农业大学动物营养所水生动物饲料与营养实验室饲养并提供。饲养实验设计苏氨酸缺乏组(7.4 g/kg)、适宜组(15.7 g/kg)、过量组(25.2 g/kg)3个处理组,每组3个重复,每个重复50尾鱼,每天饲喂6次,试验期90 d。期间定期检查水质,保证每天日光灯光照12 h,水温控制在(25±10)℃,pH值保持在7.10±0.3。
采样前进行24 h饥饿处理,分别从3个处理组中随机选择30尾鱼,称取体重。缺乏组平均体重为(61.22±3.86)g,适宜组平均体重为(100.10±10.37)g,过量组平均体重为(63.00±5.81)g。
1.1.2 建鲤组织蛋白酶B、L多克隆抗体及背肌石蜡组织切片
建鲤组织蛋白酶B、L多克隆抗体及其背肌石蜡组织切片,均由四川农业大学食品学院水产品加工与理论实验室制备保存,其制备过程参见陈秀华[18]的方法。其中组织蛋白酶B多克隆抗体效价为1∶256 000,组织蛋白酶L多克隆抗体效价为1∶512 000。
1.1.3 主要试剂
Z-Arg-Arg-AMC/Z-Phe-Arg-AMC/8-苯胺基-1-奈磺(ANS)/三磷酸腺苷酸(ATP):美国Sigma公司;蛋白定量试剂盒:南京建成生物工程研究所;Ultra-Sensitive TM SP免疫组化试剂盒:福州迈新生物技术开发有限公司;DAB辣根过氧化物酶显色试剂盒:上海碧云天生物技术有限公司。
1.2 仪器与设备
Varioskan全波长荧光酶标仪,赛默飞世尔科技公司;CX21光学显微镜,奥林巴斯;V-1100可见分光光度计,上海美谱达仪器有限公司;DY89-Ⅱ电动玻璃匀浆机,宁波新芝生物科技股份有限公司;Scientz-IID超声波细胞粉碎机,苏州江东精密仪器有限公司。
1.3 实验方法
1.3.1 建鲤肌纤维特性测定
1.3.1.1 肌纤维直径测定肌纤维直径频率分布图
各组随机取5尾建鲤,3%乌来糖麻醉并去皮,在脊椎骨上方、背鳍第一硬棘下方靠左位置取肉样,每个样品1cm3,入刀时使切面与肌纤维走向垂直,4%多聚甲醛固定4 h,58~60℃石蜡包埋,切片,脱蜡至水,HE染色[19]。
每张切片选取5个不重复视野,于(10×40)倍放大条件下完成图像采集,Image pro-Plus 6.0软件分析肌纤维直径。测定方式参照JOHNSTON等[19]的方法。并且将测得各组肌纤维直径按照0~20、20~30、30~40、40~50、50~60、60~70、70~80、80~90 μm归类,绘制肌纤维直径频率分布图[20]。
1.3.1.2 肌纤维密度测定
采集处理及切片同1.3.4,对切片中单位面积(mm2)内的肌纤维进行计数,从而计算肌纤维密度。
1.3.2 建鲤鱼肉品质指标测定
1.3.2.1 肌原纤维耐折力测定
参考郑小淼等[21]的试验方法。各组随机取10尾建鲤,剪取背鳍第一硬棘下方、脊椎骨上方部位2.0 g背肌,加100 mL A液(KCl 14.9 g、EDTA-2Na 3.44 g、硼酸4.78 g,定容至2 L,用四硼酸钠调解pH=7.0),22 000 r/min匀浆15 s,取样于(10×40)倍显微镜下测量肌原纤维长度,每个样品随机记录50个观测数据,10次重复。根据肌原纤维长度判断耐折力强弱,肌原纤维越长其耐折力越强,耐折力计算如公式(1)所示:
(1)
式中:Li表示每次测定肌原纤维长度,cm;A表示显微镜放大倍数为400;B表示为扩印倍数为3.7;n表示测定次数。
1.3.2.2 肌原纤维断裂指数测定
断裂指数测定参考HOPKINS等[22]的方法。各组随机取10尾建鲤,剪取背鳍第一硬棘下方、脊椎骨上方部位1 g肉,加30 mL缓冲液(100 mmol/L KCl,20 mmol/L K2HPO4,1 mmol/L EDTA,1 mmol/L MgCl2,1 mmol/L叠氮钠),均质机均质15 s后,用4层纱布过滤,10 mL缓冲液冲洗滤渣,收集滤液在2 ℃下离心(1 000×g,10 min),沉淀用10 mL缓冲液悬浮,再次离心,重复2次。最后将沉淀用10 mL缓冲液悬浮,稀释20倍后,测定A540吸光值。实验10次重复,取平均值后乘以200即为肌原纤维断裂指数(myofibril fragmentation index,MFI)。
1.3.2.3 剪切力测定
各组随机取10尾建鲤,顺背部肌肉肌纤维方向,在脊椎骨上方、背鳍第一硬棘下方用锋利的刀片等间隔剪取3个3 cm长厚度一致的肉样,去除肌间刺,取样时全程冰上操作。测定时,肉样摆放方向应使剪切方向与肌纤维方向垂直,剪切力值用公斤力值(kg·f)表示,每尾鱼3个肉样,每个肉样测定3次,取平均值。
1.3.2.4 pH值测定
取0.5 g建鲤背肌白肉,将肉样充分剪碎研磨,放入匀浆管,加入10 mL蒸馏水,匀浆,4 ℃ 3 000 ×g离心10 min,取上清,用酸度计测pH值,重复3次,取平均值作为样品pH值。
1.3.2.5 失水率测定
参考冷向军[23]试验方法。各组随机取10尾建鲤,在背鳍第一硬棘下方、脊椎骨上方部位取5 g左右背肌,记录数据为W0,置于沸水中煮沸2.5 min后,冷却,用滤纸吸干鱼肉表面水分,再次称重记录为Wt。10次重复,取失水率的平均值如公式(2)所示。
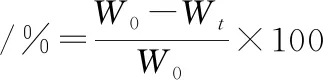
(2)
1.3.3 组织蛋白酶B、L活性测定
组织蛋白酶B、L活性的测定基本参照荧光合成肽底物法[24]。分别以荧光合成肽Z-Arg-Arg-AMC和Z-Phe-Arg-AMC为底物,用酶标仪于激发波长380 nm、发射波长460 nm下测定建鲤组织蛋白酶粗提液中CTS B、CTS L的活性。
一个酶活单位定义为在反应温度(40℃)及pH值下,能够在1 min内水解底物并释放出1nmol AMC产物的酶活性量(1nmol AMC/min)。
1.3.4 组织蛋白酶B、L的免疫组化定量
在背鳍第一硬棘下方、脊椎骨上方靠左取1 cm×1 cm×1 cm鱼背肌,58~60℃石蜡包埋,切片,脱蜡至水;选择切片用乙醇、PBS洗脱后,滴加免疫组化试剂盒A液,PBS洗脱,滴加试剂盒B液孵育10 min后滴加1抗,37℃反应1 h,PBS洗脱后加入牛血清,室温反应30 min,滴加试剂盒C液,室温反应10 min,PBS洗脱,滴加试剂盒D液,室温反应10 min后,PBS洗脱,除去PBS,滴加预先配制好的DAB显色液(含85%超纯水,5% DAB试剂盒A液,5% DAB试剂盒B液,5% DAB试剂盒C液),滴加过程中在显微镜下仔细观察,阳性物为棕色。用Image pro-Plus 6.0软件对所采集的图片上组织染色部位进行面积测定和光密度测定,并计算单位面积内的平均光密度。
1.3.5 数据统计分析
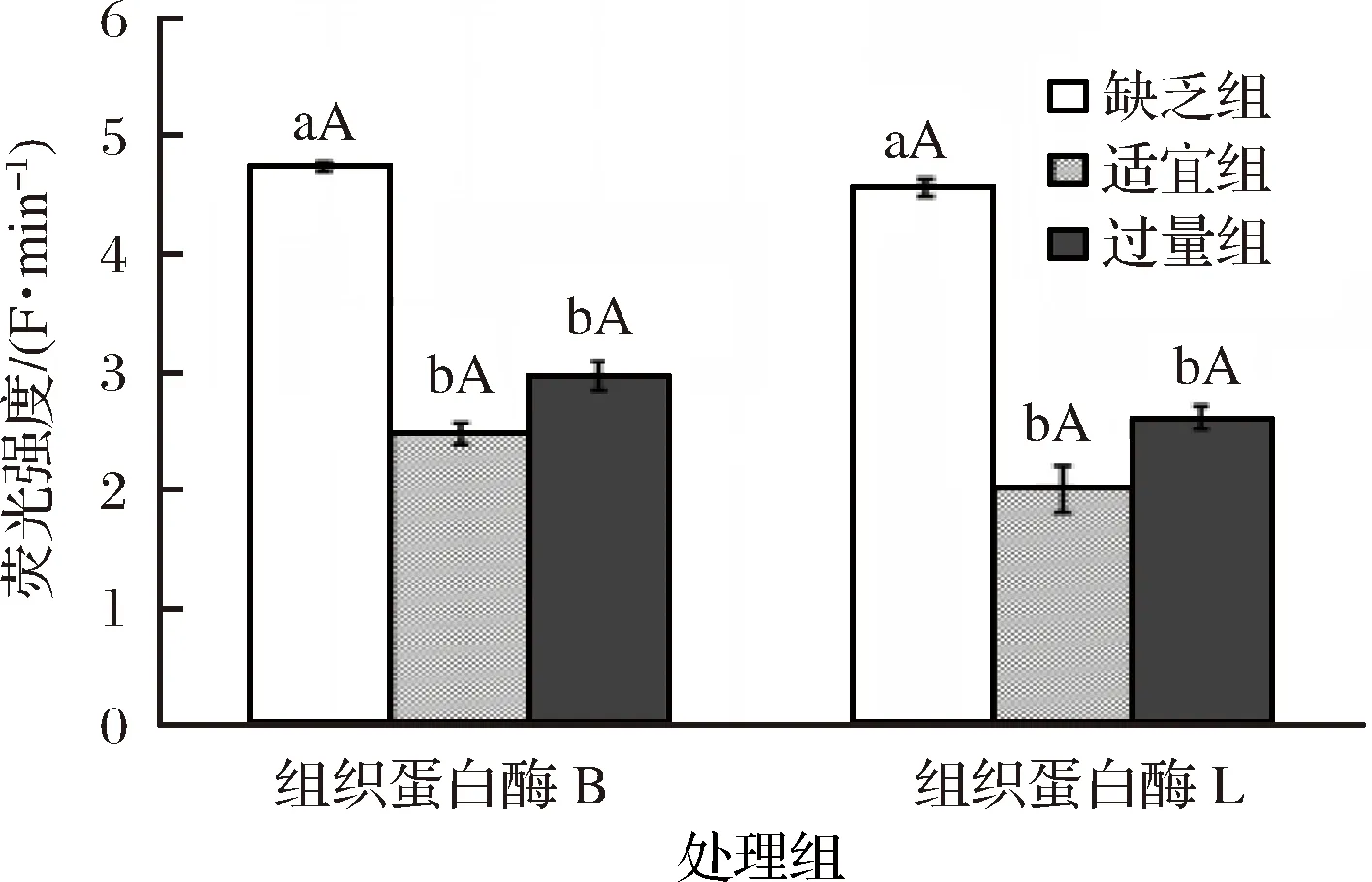
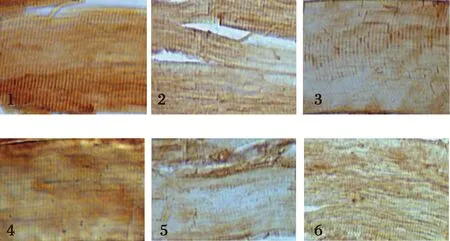
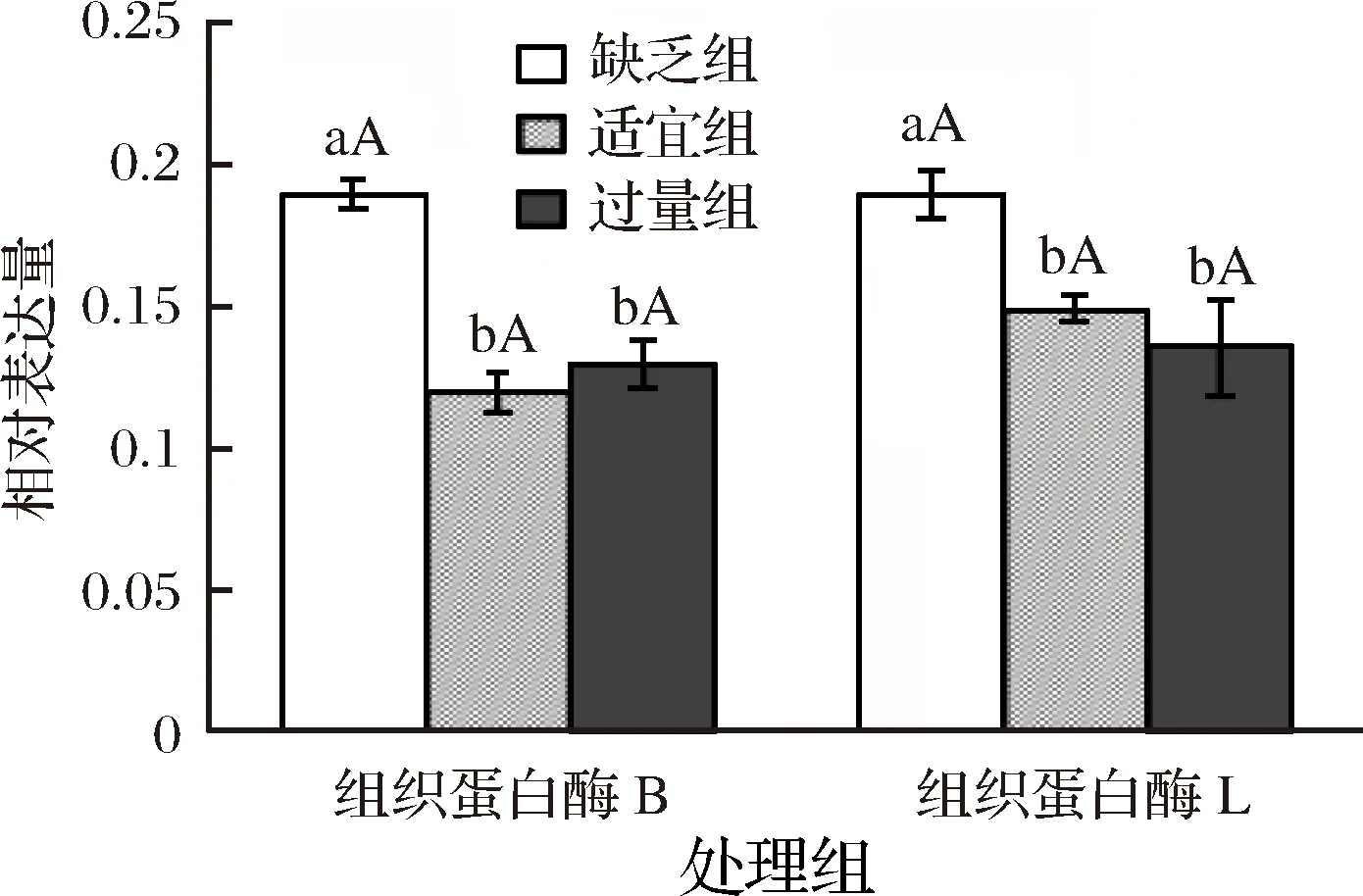
采用SPSS 19.0数学软件进行统计分析,计算各指标的平均值和标准差。采One-Way ANOVA法进行差异显著性分析。P>0.05表示差异不显著,0.01 用不同水平苏氨酸添加的饲料饲喂建鲤90 d后,各组背肌HE染色结果见图1。由图1经形态分析可知,不同直径的肌纤维组成一种马赛克镶嵌模式,大肌纤维中镶嵌着小肌纤维,这些小肌纤维是新募集的肌纤维形成的。马赛克增生使幼鱼在生长期间肌纤维数量大量增加,这对商业水产养殖物种非常重要[21]。 饲料中添加不同水平苏氨酸饲喂的建鲤肌纤维直径、密度,经统计计算后列于表1。肌纤维直径分布频率如图2所示。由表可知,适宜组建鲤平均肌纤维直径最小,肌纤维密度最大,并分别显著(0.01 ◆-大肌纤维;●-小肌纤维;A-缺乏组;B-适宜组;C-过两组图1 各处理组建鲤背肌的苏木精-伊红染色结果Fig.1 Hematoxylin-eosin staining results of the Jian carp dorsal muscles of each treatment group 表1 饲料中不同水平苏氨酸对建鲤肌纤维特性的影响Table 1 Effects of different levels of threonine in feed on the characteristics of Jian carp muscle fibers 注:数据表示为平均值±标准差,同列数据肩标为不同小写字母表示差异显著(P<0.05),肩标为不同大写字母表示差异极显著(P<0.01)。下同。 图2 肌纤维直径频率分布图Fig.2 Muscle fiber diameter frequency distribution 饲料中苏氨酸添加水平对建鲤鱼肉品质的影响见表2。由表2可知,3个处理组建鲤肌肉的肌原纤维耐折力无显著差异;适宜组建鲤肌肉肌原纤维断裂指数极显著(P<0.01)低于其他2组,剪切力值最高,并显著(0.01 表2 饲料中不同水平苏氨酸对建鲤鱼肉品质指标的影响Table 2 Effects of different levels of threonine in feed on quality index of jian carp meat 饲料中不同水平苏氨酸对建鲤肌肉中组织蛋白酶B(CTS B)、组织蛋白酶L(CTS L)的活性影响见图3。由图3可知,当饲料中苏氨酸水平为7.4 g/kg(缺乏组)时,建鲤肌肉中CTS B、CTS L活性均显著高于其他水平组(P<0.05),而适宜组与过量组之间CTS B、CTS L活性没有显著性差异(P>0.05),但适宜组稍低。 图3 各处理组建鲤肌肉中的组织蛋白酶B、L活性Fig.3 CTS B and CTS L activities in Jian carp muscles of each treatment group注:缺乏组、适宜组、过量组进行方差分析,各数据柱状图上小写和大写字母分别代表0.05和0.01水平上的差异显著性。 采用免疫组织化学方法,利用团队前期制备的建鲤CTS B、CTS L多克隆抗体,对各处理组建鲤肌肉中CTS B、CTS L进行定位及相对定量。由图4可知,经抗体标记、DAB显色后的各处理组建鲤肌肉均呈现不同程度阳性染色,棕色染色部位即为真核表达的CTS B、CTS L。 进一步测定各组染色组织切片光密度,对建鲤肌肉中CTS B、CTS L蛋白表达水平进行相对定量,定量结果见图5。由图5可知,与CTS B、CTS L在肌肉中的活性模式相似,即当苏氨酸水平7.4 g/kg (缺乏组)时,肌肉中CTS B、CTS L的蛋白表达量均显著高于其他水平组(P<0.05),适宜组与过量组之间CTS B、CTS L活性均没有显著性差异(P>0.05)。 1~3-缺乏组、适宜组、过量组CTS B免疫组化染色;4~6-缺乏组、适宜组、过量组CTS L免疫组化染色图4 各处理组建鲤背肌中组织蛋白酶B、L蛋白表达量的免疫组化测定Fig.4 Immunohistochemical determination of CTS B and CTS L protein expression in Jian carp dorsal muscle of each treatment group 图5 各处理组建鲤肌肉中的组织蛋白酶B、L蛋白表达量Fig.5 Expression of CTS B and CTS L protein in Jian carp muscles of each treatment group 鱼类肌肉生长方式与畜禽类不同,肌纤维募集(肌纤维数目增加)和肥大(肌纤维面积增大)是鱼类肌纤维两种主要的生长方式,可持续到鱼类性成熟后,且在不同发育阶段,募集与肥大的比重不同[25]。在幼鱼期的肌纤维募集促成了肌纤维数量的显著增加,这对于经济鱼种而言是十分重要的。也有研究表明,鱼类直径低于20 μm的肌纤维数可体现其肌纤维的募集能力,其比例越高说明其生长速度越快[26]。根据本研究得出的结果,与缺乏组、过量组相比,正常组建鲤肌肉不仅肌纤维平均直径最小、肌纤维密度最高,且直径小于20 μm的肌纤维数比例最高,说明在正常水平苏氨酸的调节下,建鲤肌肉肌纤维募集能力最强,暗示其生长速度较快,生长能力提升。陈拥军等[27]的研究表明,饲料中添加16.2 g/kg的苏氨酸能有效提高草鱼的生长能力,该最适苏氨酸水平及其得出的研究结果与本文相似。 此外,肌纤维直径分布和肌纤维密度还决定了肌纤维的多孔性,其与鱼肉硬度质构特性密切相关,肌纤维密度越高,直径越小,硬度越高[28]。在另一方面,肌纤维的物理特性(肌原纤维耐折力和肌原纤维断裂指数)也可以间接反映肌肉的硬度品质,而剪切力直接反映了肌肉的硬度值,剪切力越大,硬度越强。研究表明肌原纤维耐折力与肌肉组织的剪切力成正相关[29],肌原纤维断裂指数与剪切力成负相关[30],本研究中,经添加适宜水平苏氨酸的饲料饲喂后,建鲤肌肉肌原纤维耐折力略有提高,肌原纤维断裂指数则显著降低,剪切力则显著增加,说明肉质硬度提高。而适宜组的肌纤维密度、直径数据也符合建鲤肌肉剪切力增加,硬度提高的实验结果。综上所述,饲料中适宜水平的苏氨酸可改善建鲤鱼肉的硬度品质。 鱼肌肉中大量的水分与蛋白质的极性基团结合,在蛋白质的空间结构中形成水合离子,说明肌肉系水力与肌肉蛋白空间结构存在密切关系。研究表明,苏氨酸能有效提高草鱼蛋白质效率以及蛋白质沉积率,且当苏氨酸水平(16.2 g/kg)达到最高,之后随苏氨酸水平升高而降低[27]。本研究中,当适宜组(苏氨酸水平为15.7 g/kg)建鲤肌肉失水率最低,系水力最高。因此,推测苏氨酸可能通过改善建鲤肌纤维生长、提高蛋白质沉积效率使肌肉系水力提高,对改善鱼肉多汁性品质有一定的促进作用。 苏氨酸缺乏将引起动物厌食,BAHUAUDA等[31]发现,大西洋鲑鱼在宰杀前先饥饿4 d,导致其组织蛋白酶B、L基因表达量升高。长期处于饥饿状态时,鱼类通过提高蛋白水解酶表达量以水解蛋白维持其生理需求。研究表明苏氨酸缺乏时,蛋白沉积率下降,蛋白合成速度下降[27],团队前期研究也发现,苏氨酸缺乏将导致建鲤蛋白沉积率下降[9-10]。本研究中,当建鲤处于苏氨酸缺乏状态时,可导致组织蛋白酶B、L活性及表达量均显著升高,可能与此机制相关。研究表明组织蛋白酶B、L可水解肌原纤维蛋白[32],因此内源组织蛋白酶B、L也是引起其鱼糜凝胶软化的主要蛋白酶[33]。组织蛋白酶B、L活性更高的鱼类,不仅死后鱼肉蛋白的降解速度加快,高酶活亦影响鱼肉片的硬度品质,同时还可能进一步影响加工制品如鱼糜制品的质构品质。本研究中,相对于缺乏组、过量组,饲喂正常水平苏氨酸的建鲤肌肉中组织蛋白酶B、L活性及蛋白表达量均降低,推测苏氨酸可能通过某种途径调控了组织蛋白酶B、L的活性及蛋白表达。这也进一步说明了正常水平的苏氨酸对维持机体正常组织蛋白酶活性和表达水平起到促进作用,对保持鱼肉质品质也具有积极的意义。由此可见,通过在饲料中添加营养物,对鱼肌肉组织中组织蛋白酶的活性和表达量进行调节,从而调控鱼肉肉质,对从饲养环节控制鱼肉及加工制品品质,具有深远的研究意义。 饲料中过量添加苏氨酸对幼鱼期建鲤肌纤维募集和鱼肉品质的影响无显著促进作用,而添加适宜水平苏氨酸则能够改善鱼肉肌纤维特性及硬度品质,可能与其促进建鲤幼鱼期肌纤维募集并降低内源组织蛋白酶B、L活性、蛋白表达量,具有潜在关联性。2 结果与分析
2.1 饲料中苏氨酸水平对建鲤肌纤维特性的影响



2.2 饲料中苏氨酸水平对建鲤鱼肉品质的影响

2.3 饲料中添加不同水平苏氨酸对建鲤肌肉中CTS B/L活性的影响
2.4 饲料中添加不同水平苏氨酸对建鲤肌肉中CTS B/L蛋白表达量的影响
3 讨论
4 结论
