酶转化三七茎叶总皂苷制备稀有人参皂苷C-K
2020-01-13王彩艳刘春莹肖永坤左康泽陈双徐龙权宋建国鱼红闪
王彩艳,刘春莹,肖永坤,左康泽,陈双,徐龙权,宋建国,鱼红闪*
1(大连工业大学 生物工程学院,辽宁 大连,116034)2(大连大学,辽宁 大连,116622) 3(葵花药业集团(天津)药物研究院,天津,300457)
三七为常用的贵重中药,但其入药部位大多为其根部,其茎叶部分还没有得到充分利用。在三七茎叶中总皂苷含量为5%(质量分数)以上,其中主要为Rb3、C-Mx1、Fa、Rc、Fc、Rd、Rb1、Gyp17等人参二醇类皂苷,它们含有相同的人参二醇苷元非糖基部分,但是带有不同的3-O-和20-O-糖基[1-3],故导致其功效有所差异。三七茎叶总皂苷中含量高的Rb1、Rc等分子,由于带多个糖基,故生理活性很低,但口服后能在肠道内转化为低糖基的皂苷C-K等,但是这种转化非常微弱,而且大部分很难被利用[4-5]。与三七茎叶总皂苷含有相同苷元的人参稀有皂苷C-K、Rg3、Rh2等,具有很好的抗癌、抗血栓、抗炎、抗皮肤老化以及治疗神经系统疾病等功效,对医药、保健食品、化妆品的生产意义很大[6-10]。
为了从低活性的三七茎叶总皂苷中生物转化得到高活性人参稀有皂苷,柴瑞华等用酶法将三七茎叶总皂苷转化制备人参稀有皂苷C-K,但是其转化得率很低[11-12]。本实验室相继报道了4种人参皂苷糖苷酶:即转化原人参二醇类皂苷Rb1、Rb2、Rc和Rd的第3(碳)-O-和20(碳)-O-多种糖基的人参皂苷糖苷酶I型[13-15];转化原人参二醇类皂苷的20-O-多种糖基的人参皂苷酶Ⅱ型[16];克隆在E.coliC41(DE3)菌种中表达的人参皂苷酶Ⅲ型,能转化原人参二醇类皂苷的3-O-多种糖基[17],能转化原人参三醇类皂苷的6-O-多种糖基的人参皂苷糖苷酶Ⅳ型[18]。本实验室也报道了不同菌来源的人参皂苷糖苷酶I型[13-15],虽然都能转化原人参二醇类皂苷第3(碳)-O-和20(碳)-O-多种糖基,但是在个别性质上有所差异。如来源于A.nigersp.G4菌的酶(分子质量80kDa),能转化人参二醇类皂苷变成F2、C-K和少量的Rh2[13];来源于A.nigersp.G8菌的酶(分子质量75 kDa),经2个途径转化人参二醇类皂苷Rb1和Rb3的3-O-和20-O-糖基,即Rb1→Rd→F2→C-K和Rb1→Gyp17→Gyp75→C-K途径;Rb3→C-Mx1→C-Mx→C-K和Rb3→Rd→F2→C-K途径[14];也报道过利用来源于A.nigersp.G8菌的人参皂苷糖苷酶I型,生物转化三七茎叶总皂苷制备高生理活性的稀有皂苷C-K、C-Mx[19-20];但是,上述研究的C-K转化得率低,并且反应后残留中间产物C-Mc。
本文为了提高三七茎叶总皂苷的C-K转化得率,尝试了3种菌来源的人参皂苷酶、混合酶转化三七茎叶总皂苷,并对其酶反应条件进行优化,为充分利用三七茎叶总皂苷提供新的研究方向。
1 材料与方法
1.1 材料与试剂
三七茎叶总皂苷,辽宁桓仁阳光保健品公司;人参皂苷对照品Rb3、C-Mx1、Rc、Rb1、Rd等,天津天宿光华健康科技公司;人参皂苷对照品C-K、C-Mx、C-Mc、R7、Fc等,由本实验室提供(全部经国家电化学和光谱研究中心以核磁共振核对结构)[19-20]。Aspergillusnigersp.G4菌[13]、Aspergillusnigersp.G8菌[14]、Aspergillusoryzaesp.G9菌[18],从大曲中筛选;AB-8大孔吸附树脂、D-280离子交换树脂,天津兴南允能高分子技术有限公司;薄层层析板Silica gel 60-F254,德国默克公司。
1.2 仪器与设备
Waters2695高效液相色谱分析仪(带Waters2996光电二极管阵列(PDA)检测器及Empower色谱工作站),Waters公司。
1.3 实验方法
1.3.1 酶液制备
配制150 mL 50 g/L麦芽汁中加入0.5 g/L的三七茎叶总皂苷的溶液,共制备30瓶,经高压蒸汽灭菌,冷却至室温。经严格无菌操作,A.nigersp.G4菌、A.nigersp.G8菌和A.oryzaesp.G9菌各接种10瓶;在30 ℃恒温振荡培养箱中培养5~7 d,将发酵培养好的150 mL发酵液,用高速冷冻离心机在8 000 r/min下离心15 min,去除菌体,收集上清液;在磁力搅拌条件下,缓慢加入已研磨好的硫酸铵粉末至80%饱和度,于4 ℃下静置4 h。再用高速冷冻离心机在13 000 r/min下离心20 min,弃上清,收集蛋白质沉淀。沉淀用10 mL、20 mmol/L、pH 5.0 醋酸-醋酸钠缓冲液溶解,然后装入透析袋,用相同缓冲液透析24 h,约每2 h更换一次缓冲液。透析结束后,用高速冷冻离心机在13 000 r/min下离心10 min,除去不溶性杂蛋白,所得上清液即为粗酶液。
1.3.2 酶反应方法
取0.1 mL酶液与0.1 mL 50 g/L的三七茎叶总皂苷底物溶液,加入1.5 mL离心管中,混合均匀,在45 ℃下反应24 h,反应结束后,加入0.2 mL水饱和正丁醇,混合均匀后离心,取正丁醇层溶液采用1.3.4中的TLC方法进行定性分析,取正丁醇层溶液浓缩蒸干后采用1.3.5中HPLC法进行定量分析。
C-K产率的计算方法如公式(1)所示:
(1)
式中:PC-K-酶反应产物进行HPLC分析,根据对照品C-K的回归方程计算出产物中C-K的含量;S-酶反应中底物(三七茎叶总皂苷)的含量。
1.3.3 C-K等稀有皂苷的制备
称取50.0 g三七茎叶总皂苷,溶于1 000 mL 20 mmol/L pH 5.0 醋酸-醋酸钠缓冲液中,然后加入1 000 mL酶液混合,置于反应釜中,在45℃下反应24 h时。反应结束后,加入6 000 mL 950 g/L乙醇沉淀酶,并在13 000 r/min下离心20 min,取上清液浓缩,去除溶液中的乙醇,得到粗产品浓缩液。上述粗产品的浓缩液经预先处理好的1 000 mL AB-8大孔吸附树脂柱反复吸附后(重复吸附3~4次,使皂苷充分吸附),用6倍柱体积的去离子水洗脱去除糖等杂质,再用5倍柱体积的840 g/L乙醇溶液洗脱皂苷,其洗脱液再经D-280树脂柱脱色,减压浓缩、干燥,得到三七茎叶总皂苷酶转化产物混合皂苷[19-20]。
1.3.4 薄层层析法[21](thin layer chrmatographic,TLC)
薄层层析板采用Silica gel 60-F254,展开剂比例为V(氯仿)∶V(甲醇)∶V(水) = 7∶2.5∶0.5,显色剂为10% H2SO4溶液。
1.3.5 高效液相色谱(HPLC)
色谱条件[21]:采用Waters 2695高效液相色谱分析仪,Waters 2996光电二极管阵列(PDA)检测器及Empower色谱工作站;色谱柱:Hypersil C18柱(5 μm,φ 4.6 mm×250 mm);流动相:乙腈(A)-水(B):0~20 min,20%A等度;20~31 min,20%A~32%A线性梯度,31~40 min,32%A~43%A线性梯度;40~70 min,43%A~100%A线性梯度;进样量:10 μL;柱温:35℃;体积比流速:0.6 mL/min;检测波长:203 nm。
待测样品的溶液配制:称取三七茎叶总皂苷4 mg,加1 mL色谱级甲醇充分溶解,待用;取4 mg酶转化产物,充分溶解于1 mL色谱级甲醇溶液中,待用;分别精密称取对照品人参皂苷Rb1、R7、Fc、Rc、Rb3、Rd、C-Mx1、C-K、C-Mc和C-Mx,分别配制成1 g/L色谱级甲醇溶液,待用;上述配置待用的样品溶液,经过0.22 μm滤膜过滤后,进行HPLC分析。
1.3.6 C-K标准曲线及回归方程
取上述配制好的对照品C-K溶液适量,加入适量的色谱级甲醇等倍稀释成5个浓度的对照液,分别取10 μL按1.3.5色谱条件进样分析,以对照品质量浓度为X坐标,面积值为Y坐标,绘制标准曲线并进行回归计算,回归方程为Y=3.72×106X-1.44×104,相关系数为0.999 2。
2 结果与分析
2.1 三七茎叶总皂苷的组成成分分析
市销的三七茎叶总皂苷的组成,因厂家、生产批次的不同,而有所差别。对本溪阳光保健品公司的三七茎叶总皂苷产品和人参皂苷产品进行高效液相色谱分析,其结果如图1、图2、表1所示。
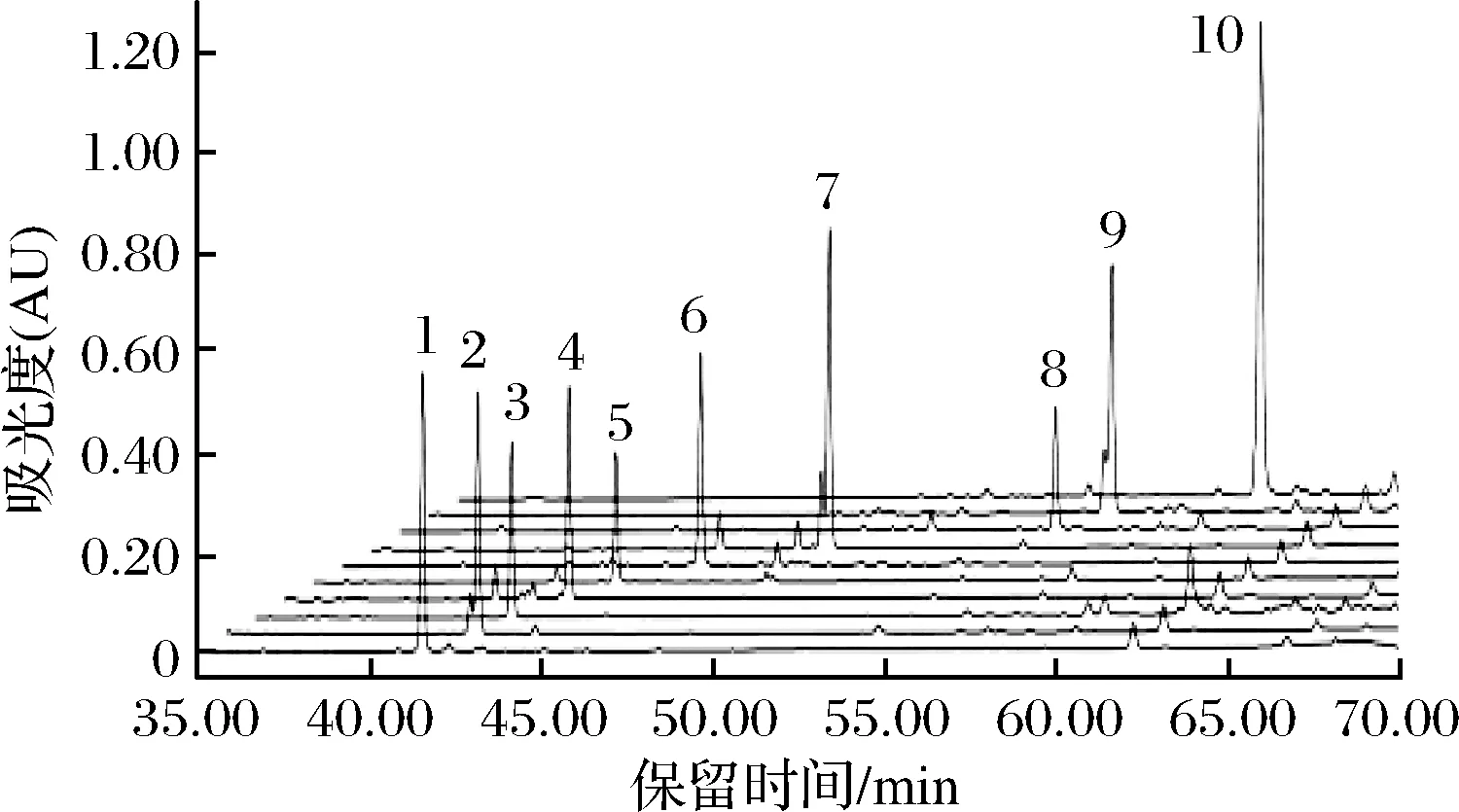
1-人参皂苷Rb1;2-人参皂苷Fc;3-人参皂苷Rc;4-人参皂苷Rb3;5-人参皂苷R7;6-人参皂苷Rd;7-人参皂苷C-Mx1;8-人参皂苷C-Mc;9-人参皂苷C-Mx;10-人参皂苷C-K图1 人参皂苷对照品的HPLC图谱Fig.1 The HPLC of ginsenoside standards
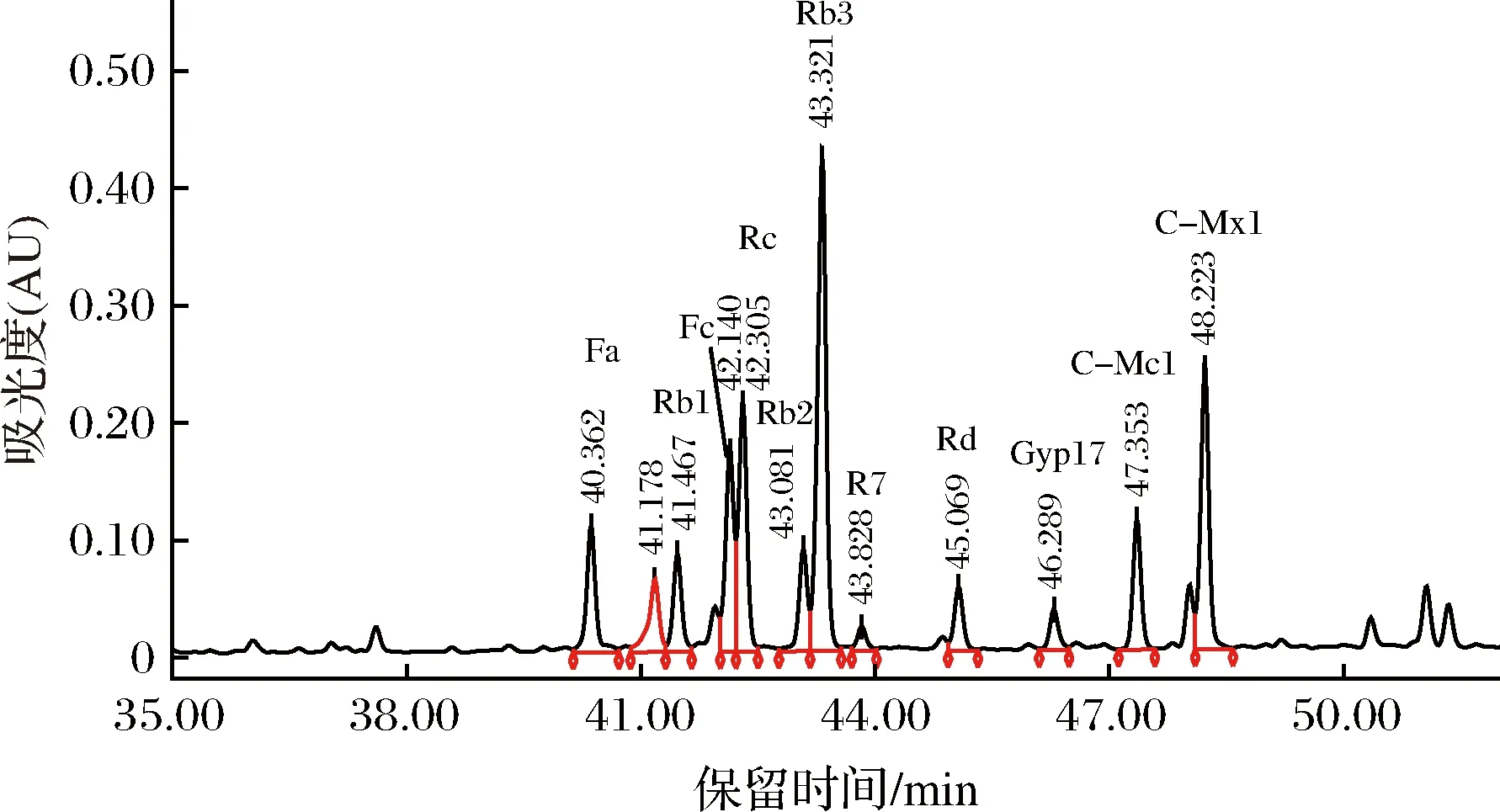
图2 市销三七茎叶总皂苷的HPLC图谱Fig.2 The HPLC of notoginseng stem-leaf ginsenosides
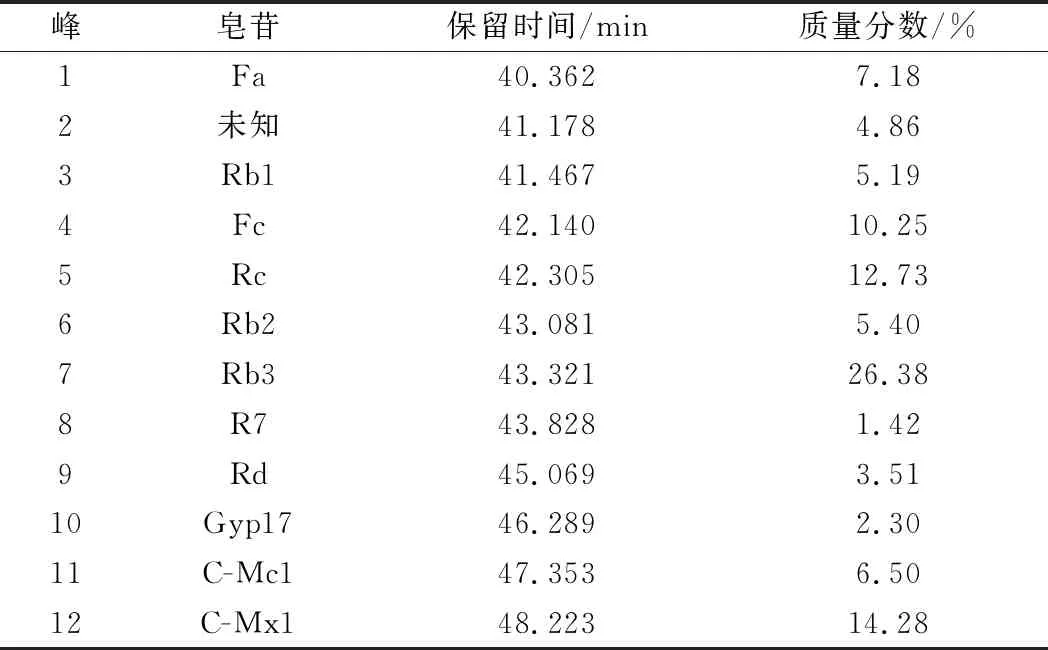
表1 三七茎叶总皂苷中各组分的含量Table 1 Contents of each component in total saponins of Panax notoginseng
由图2和图1比对可知,市销的三七茎叶总皂苷中含有皂苷:Fa、Rb1、Fc、Rc、Rb2、Rb3、R7、Rd、Gyp17、C-Mc1和C-Mx1共11种。把HPLC图中各皂苷的峰面积比近似认为各皂苷的含量比[20],则各皂苷的质量分数为Fa 7.18%、Rb1 5.19%、Fc 10.25%、Rc 12.73%、Rb3 26.38%、R7 1.42%、Rd 3.51%、Gyp 17 2.30%、C-Mc1 6.50%、C-Mx1 14.28%,即在三七茎叶总皂苷中含量最高的是Rb3,其次是C-Mx1。
2.2 三七茎叶总皂苷的酶转化反应
取A.nigersp.G4菌、A.nigersp.G8菌和A.oryzaesp.G9菌所产酶以及它们两者的等体积混合液各0.1 mL,分别与0.1 mL 50 g/L三七茎叶总皂苷溶液混合,在pH 5.0、45℃下反应24 h;加0.2 mL水饱和正丁醇,混合均匀后离心,上清液采用TLC法进行定性分析,结果如图3所示。
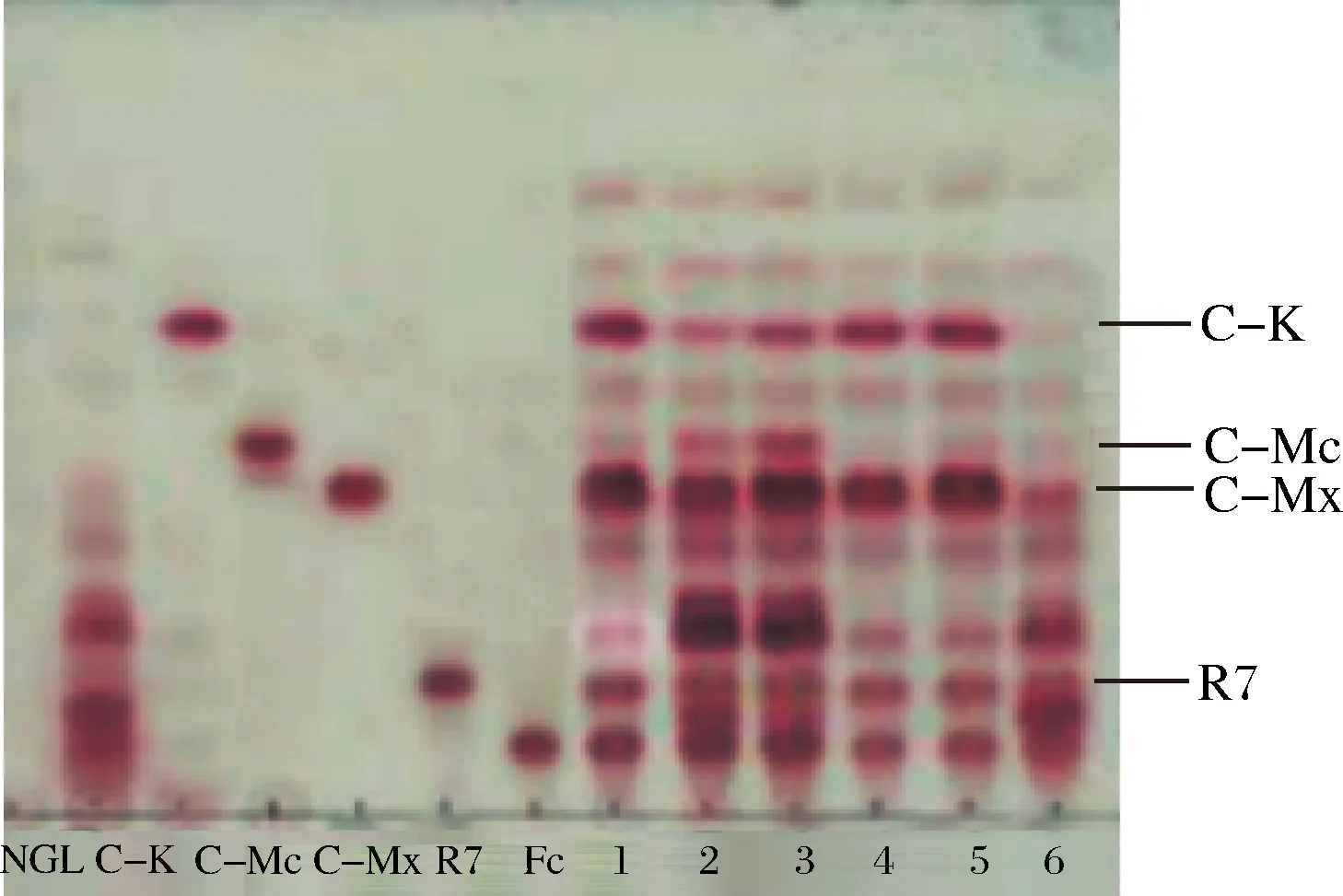
NGL-三七茎叶总皂苷;C-K、C-Mc、C-Mx、R7、Fc-人参皂苷对照品;1-A. niger sp.G4菌所产酶和A. niger sp.G8菌所产酶的等体积混合酶液;2-A. niger sp.G4菌所产酶和A. oryzae sp.G9菌所产酶的等体积混合酶液;3-A. niger sp.G8菌所产酶和A. oryzae sp.G9菌所产酶的等体积混合酶液;4-A. niger sp.G4菌所产酶;5-A. niger sp.G8菌所产酶;6-A. oryzae sp.G9菌所产酶图3 酶转化三七茎叶总皂苷的TLC图Fig.3 Enzyme on notoginseng stem-leaf in TLC
由图3可知,A.nigersp.G8菌所产酶和A.nigersp.G4菌所产酶的等体积混合酶液转化三七茎叶总皂苷生成C-K的效果最好,其次为A.nigersp.G8菌所产酶;而A.nigersp.G8菌所产酶和A.oryzaesp.G9菌所产酶的等体积混合酶、A.nigersp.G4菌所产酶和A.oryzaesp.G9菌所产酶的等体积混合酶、A.oryzaesp.G9菌所产酶、A.nigersp.G4菌所产酶对三七茎叶总皂苷的转化效果差。因此本文采用了A.nigersp.G8菌所产酶和A.nigersp.G4菌所产酶的等体积混合酶(以下简称G8-G4混合酶),以及A.nigersp.G8菌所产酶转化三七茎叶总皂苷制备稀有皂苷C-K。
2.3A. niger sp.G8菌所产酶和G8-G4混合酶的最佳酶反应条件
2.3.1 反应时间的优化
G8-G4混合酶与三七茎叶总皂苷溶液等体积混合,在底物质量浓度25 g/L,pH 5.0,45 ℃下反应3、6、9、12、24、36、48 h,反应结束后,分别取样0.2 mL,与0.2 mL水饱和正丁醇混合,混合均匀后离心,取正丁醇层用TLC法进行定性检测,并采用HPLC法进行定量分析,TLC结果如图4所示。
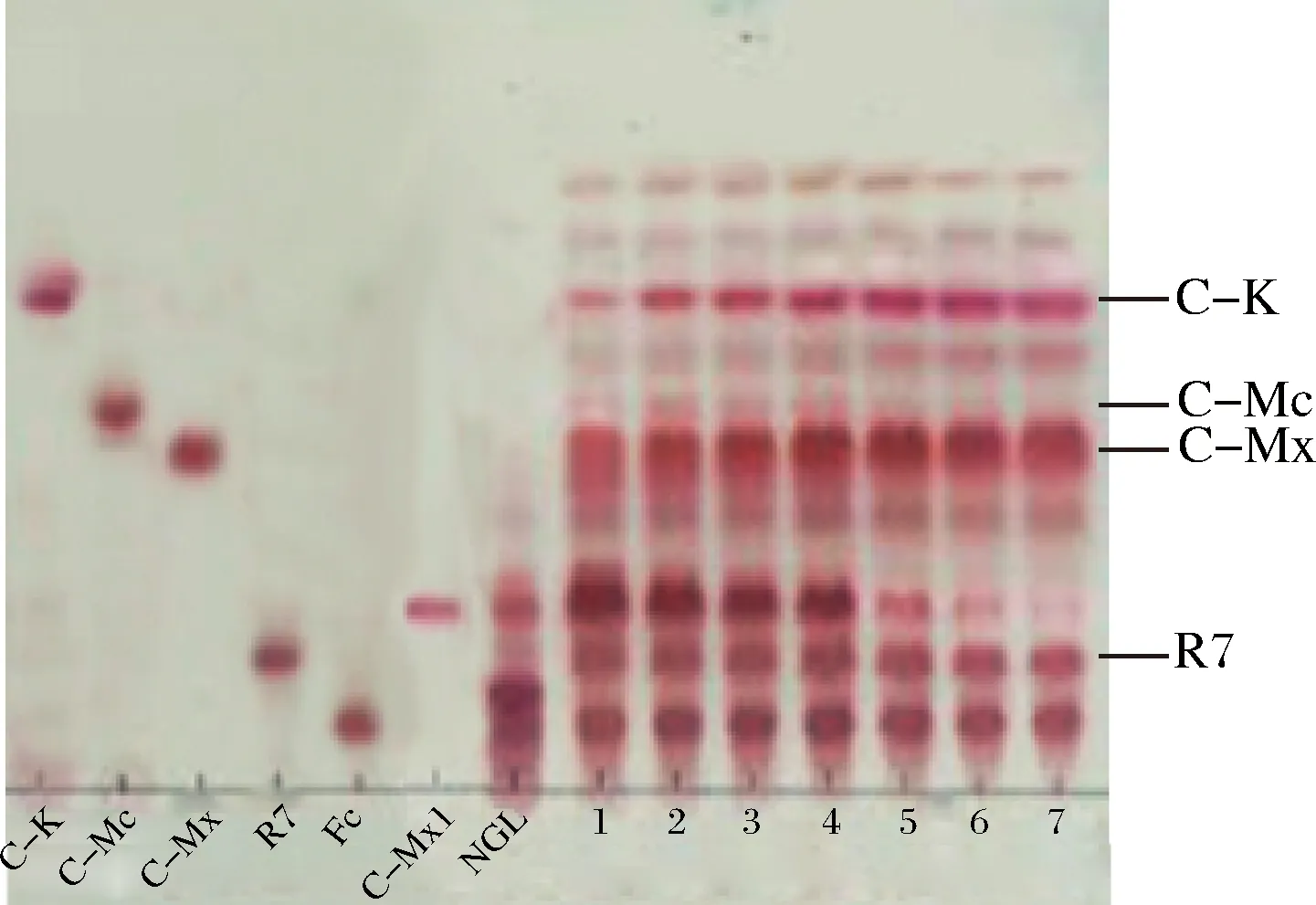
NGL-三七茎叶总皂苷;C-K、C-Mc、C-Mx、R7、Fc、C-Mx1-人参皂苷对照品;1、2、3、4、5、6、7-3、6、9、12、24、36、48 h图4 不同时间对G8-G4混合酶转化三七茎叶总皂苷的影响Fig.4 Reaction time effect on the hydrolysis of notoginseng stem-leaf ginsenosides by enzyme mixture of A. niger sp.G8 and A. niger sp.G4 strains
由图4可知,G8-G4混合酶与三七茎叶总皂苷的反应,随时间的延长C-K产率越来越高,当反应进行到24 h,C-K产率达到28.6%(质量分数)。同理,A.nigersp.G8菌所产酶的反应时间优化表明,反应24 h,C-K产率最高,为22.4%(质量分数)。
2.3.2 酶反应温度和pH的优化
G8-G4混合酶液与三七茎叶总皂苷溶液等体积混合,反应温度分别设在35、40、45、50、55、60 ℃,底物质量浓度25 g/L,pH 5.0,反应24 h。结果如图5所示。G8-G4混合酶与三七茎叶总皂苷溶液等体积混合,反应pH值设为3.0、4.0、5.0、6.0、7.0,底物质量浓度为25 g/L,45 ℃反应24 h。结果如图6所示。
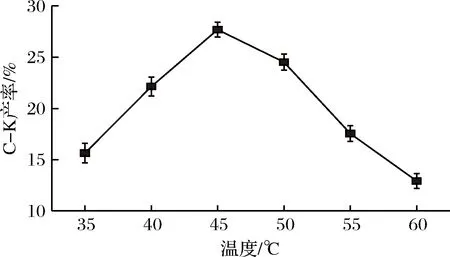
图5 温度对酶反应生成C-K的影响Fig.5 The effects of temperature on enzyme reaction to C-K

图6 pH对酶反应生成C-K的影响Fig.6 the effects of pH on enzyme reaction to C-K
由图5可知,G8-G4混合酶与三七茎叶总皂苷在45℃条件下反应后,C-K的产率最高,达27.68%(质量分数),由图6可知,在pH 5.0条件下,G8-G4混合酶转化三七茎叶总皂苷的C-K产率最高,为21.56%(质量分数)。故G8-G4混合酶转化三七茎叶总皂苷的最佳反应条件为pH 5.0,45℃,底物质量浓度25 g/L,反应24 h。
A.nigersp.G8菌所产酶与三七茎叶总皂苷溶液等体积混合,反应温度分别设在:35、40、45、50、55、60℃,底物质量浓度25 g/L,pH 5.0,反应24 h。结果如图7所示。A.nigersp.G8菌所产酶与三七茎叶总皂苷溶液等体积混合,反应pH设为3.0、4.0、5.0、6.0、7.0,45℃,底物质量浓度25 g/L,反应24 h。结果如图8所示。
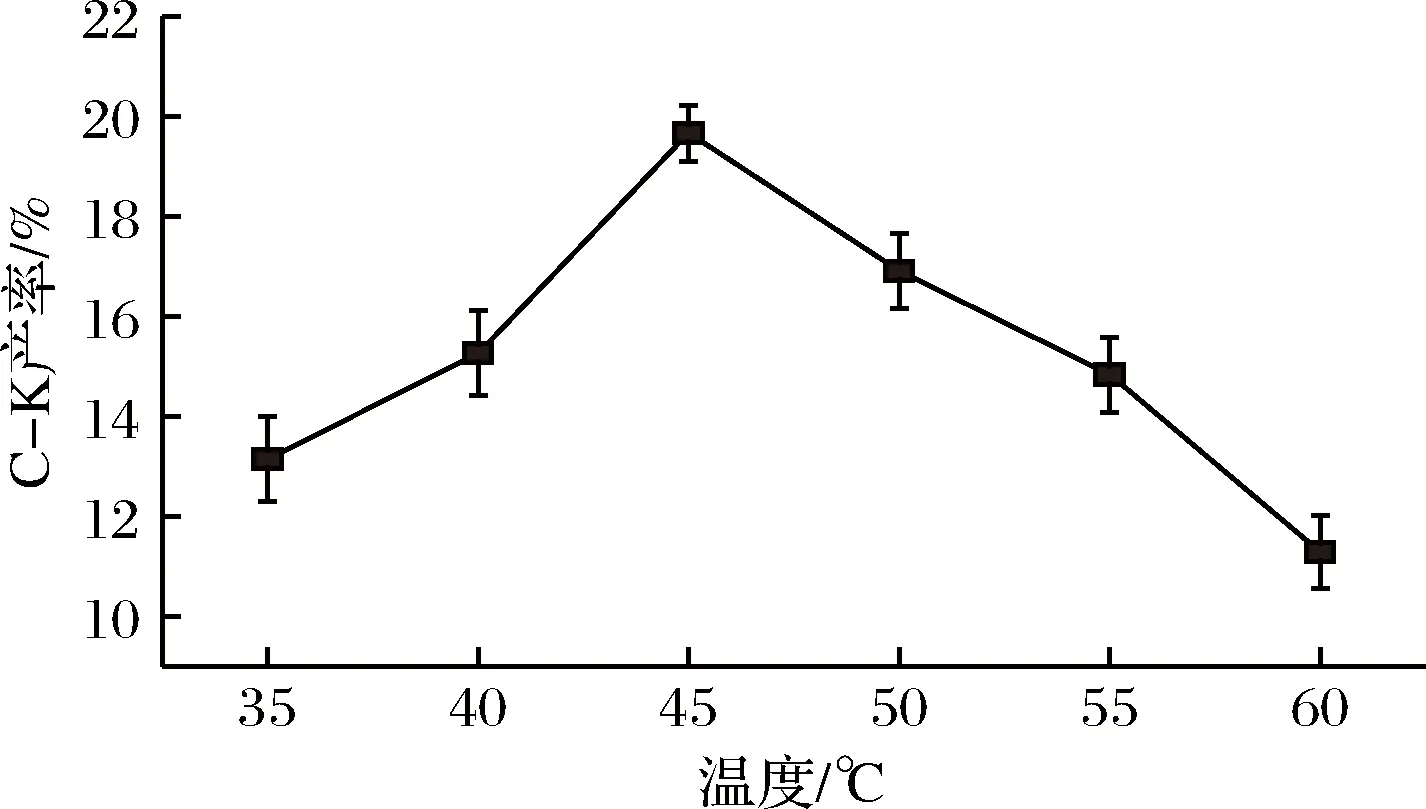
图7 温度对酶反应生成C-K的影响Fig.7 The effects of temperature on enzyme reaction to C-K
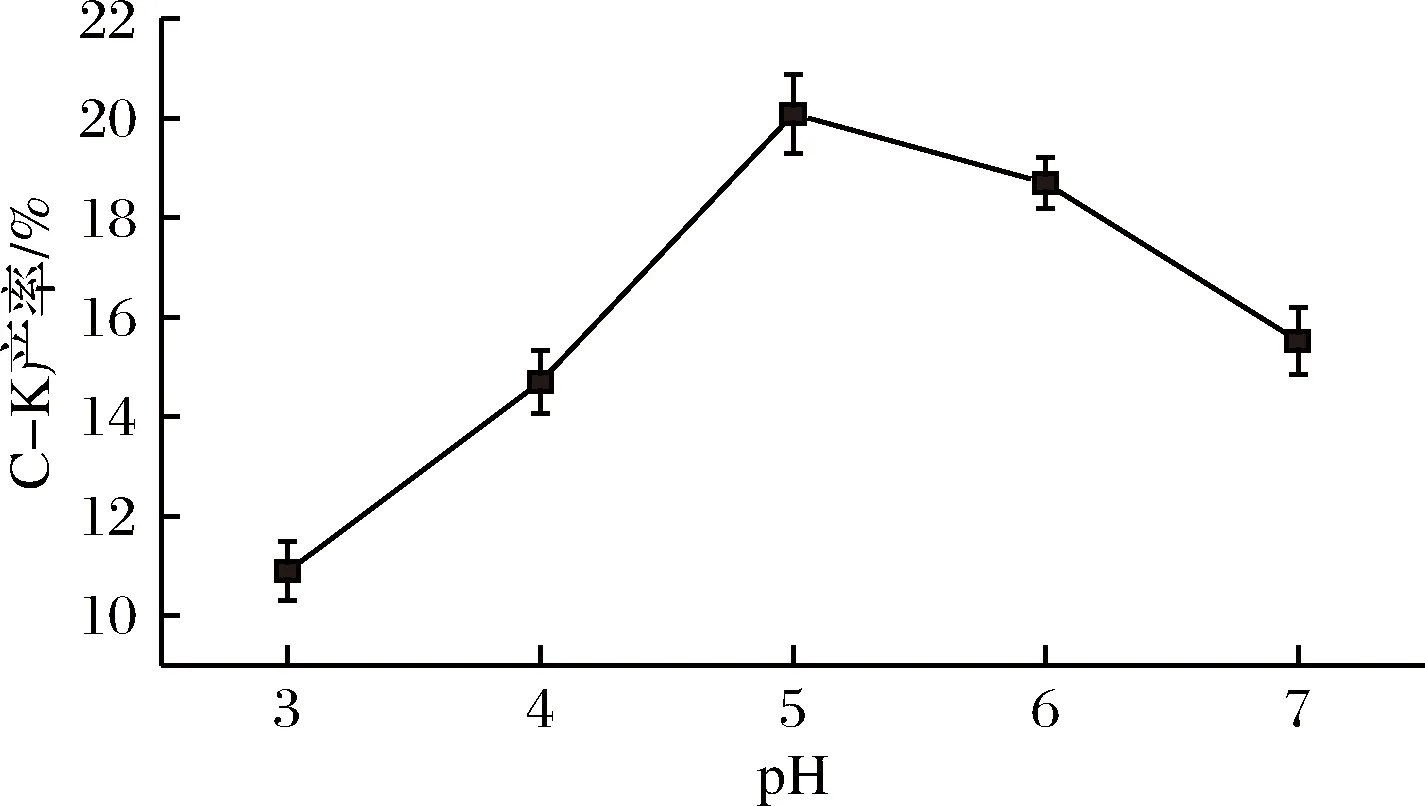
图8 pH对酶反应生成C-K的影响Fig.8 the effects of pH on enzyme reaction to C-K
由图7可知,A.nigersp.G8菌所产酶与三七茎叶总皂苷在45℃反应后,C-K的产率最高,达19.67%;由图8可知,A.nigersp.G8菌所产酶转化三七茎叶总皂苷的pH为5.0时,C-K产率最高,为20.08%。故A.nigersp.G8菌所产酶转化三七茎叶总皂苷的最佳反应条件为pH 5.0,45℃,底物质量浓度25 g/L,反应24 h。
2.3.3 酶转化产物的HPLC检测
用HPLC法检测三七茎叶总皂苷经G8-G4混合酶和A.nigersp.G8菌所产酶转化后的产物,如图9及表2所示。
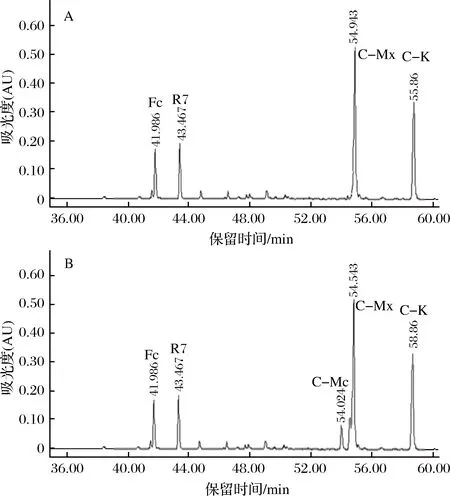
A-G8-G4混合酶转化三七茎叶总皂苷的产物;B-A. niger sp.G8菌所产酶转化三七茎叶总皂苷的产物图9 G8-G4混合酶和A. niger sp.G8菌所产酶转化三七茎叶总皂苷的HPLC图Fig.9 Enzyme from G8-G4 enzyme mixture and G8 strains hydrolysis on notoginseng stem-leaf ginsenoside in HPLC注:反应时间为24 h。
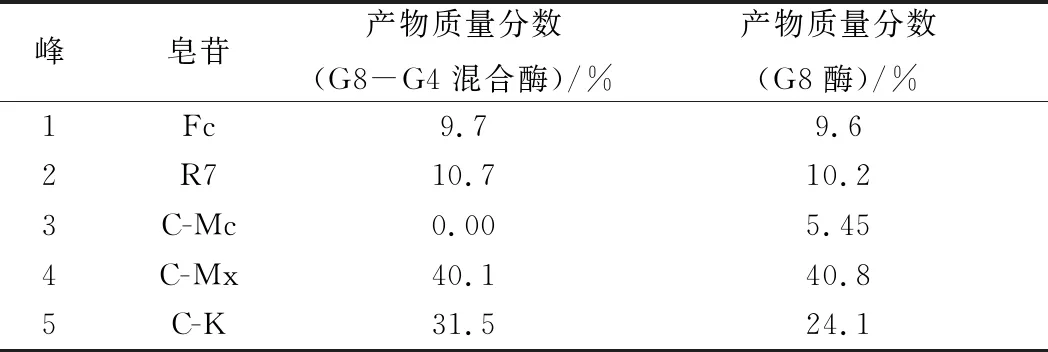
表2 G8-G4混合酶、A. niger sp.G8菌所产酶转化三七茎叶总皂苷的产物皂苷比较Table 2 Products from notoginseng stem-leaf ginsenosides by the G8-G4 enzyme mixture, A. niger sp.G8 enzyme
由图9和表2可知,A.nigersp.G8菌所产酶转化三七茎叶总皂苷的产物有5种:C-K、C-Mx、Fc、R7、C-Mc;而G8-G4混合酶转化三七茎叶总皂苷的产物有4种:C-K、C-Mx、Fc、R7。
分析得知,三七茎叶总皂苷中的部分皂苷经酶催化降解3-O-或20-O-糖基主要生成C-K、C-Mx、R7、C-Mc,其结构如图10中所示。初步推断酶催化降解底物皂苷生成产物的对应情况如下:
Rb1、Rd、Gyp17→降解3-O-和20-O-葡萄糖基→生成C-K;Rc和C-Mc1→降解3-O-葡萄糖基→生成C-Mc和C-K;Rb3和C-Mx1→降解3-O-葡萄糖基→生成C-Mx;Fa→降解20-O-葡萄糖基→生成R7。
G8-G4混合酶液转化三七茎叶总皂苷的C-K转化得率,相比A.nigersp.G8菌所产酶有所提高,这可能是C-Mc的20-O-阿拉伯糖基继续被酶降解转化生成C-K的缘故,图9-A中没有检测到C-Mc,也能说明此结果。而G8-G4混合酶液和A.nigersp.G8菌所产酶,均不能水解C-Mx的20-O-末端木糖基,也不能水解R7和Fc的3-O-末端木糖基,因此上述2种酶液的催化反应产物中均有Fc的残留。
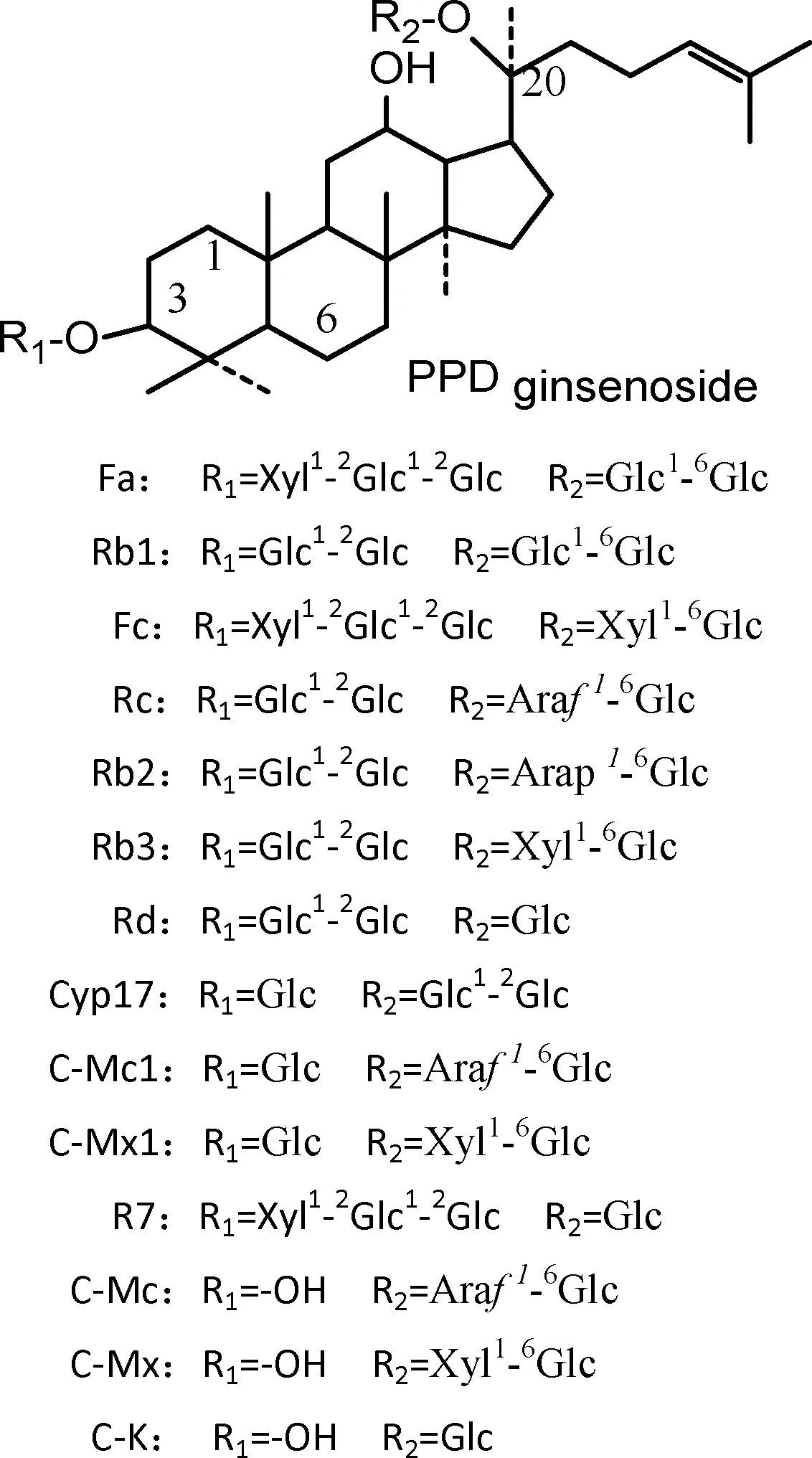
图10 图2 HPLC中三七茎叶总皂苷的结构式Fig.10 Structure of notoginseng leaf ginsenosides of figure 2 HPLC
2.4 三七茎叶总皂苷酶转化产物C-K等的制备
综上结果可知G8-G4混合酶液转化三七茎叶总皂苷的C-K得率相比A.nigersp.G8菌所产酶有所提高。其结果由如下制备生产来验证。
将50.0 g三七茎叶总皂苷溶于1 000 mL的20 mmol/L pH 5.0 醋酸-醋酸钠缓冲液中,分别与等体积G8-G4混合酶或等体积A.nigersp.G8菌所产酶液混合,置于生化反应器中,在45℃下搅拌反应24 h。反应结束后,分别加入3倍体积的95%(体积分数)乙醇沉淀酶,其上清浓缩后,经AB-8脱糖、D-280脱色、浓缩干燥,得到酶反应产物混合皂苷。50.0 g三七茎叶总皂苷经G8-G4混合酶反应后,得到产物33.1 g,得率为66.2%,其中C-K为32.7%;50 g三七茎叶总皂苷经A.nigersp.G8菌所产酶反应后,得到产物34.9 g,得率为69.8%,其中C-K为24.6%。
3 结论
市销的三七茎叶总皂苷中,主要为人参二醇类皂苷,其组成成分和含量(质量分数)如下:Rb3 26.38%,C-Mx1 14.28%,Rc 12.73%,Fc 10.25%,还含有Rb1、Rb2、Rd、Gyp17、R7、C-Mc1等皂苷。
G8-G4混合酶和A.nigersp.G8菌所产酶转化三七茎叶总皂苷的最佳反应条件为45 ℃,pH 5.0,底物质量浓度25 g/L、反应24 h。
A.nigersp.G8菌所产酶转化三七茎叶总皂苷的产物有5种:C-K、C-Mx、Fc、R7、C-Mc;而G8-G4混合酶液转化三七茎叶总皂苷的产物有4种:C-K、C-Mx、Fc、R7;且G8-G4混合酶液转化三七茎叶总皂苷的C-K产率比A.nigersp.G8菌所产酶高,推断是C-Mc被继续降解转化生成C-K所致。
三七茎叶总皂苷和酶转化产物的分析结果表明,三七茎叶总皂苷中Rb1、Rd、Gyp17、Rc、 Rb3、C-Mc1、 C-Mx1和Fa的3-O-和20-O-葡萄糖基或阿拉伯糖基被酶水解,产物中约含24%~30%(质量分数)的C-K。而Fc的3-O-和20-O-末端木糖基无法被酶降解,在酶转化产物中有所残留。今后,还需进一步开发能够降解C-Mx、Rb3、R7、Fa、Fc的3-O-和20-O-末端木糖基的酶,以提高酶转化产物中C-K的含量。
