菊科倍半萜二聚体的研究进展
2020-01-09薛贵民薛金凤
薛贵民,薛金凤,杜 锟
1河南中医药大学药学院;2呼吸疾病诊疗与新药研发河南省协同创新中心,郑州 450046
菊科(Compositae)为双子叶植物纲,菊亚纲的第一大科,约有1 100属,20 000~25 000种。该科植物在世界各地均有分布,但是在热带地区种类较少。我国约有200余属,2 000多种,产于全国各地。其中该科植物中含有大量的药用、观赏和经济植物。菊科药用植物大约有300种包括艾、蒲公英、佩兰、天名精、青蒿、白术、苍术、牛蒡、红花等[1]。
研究表明菊科植物中含有多种化学成分,而倍半萜二聚体是菊科植物中一类重要的化学成分,它们是由两个倍半萜连接而成的具有30个碳原子的聚合物。其相对于倍半萜单体而言,在植物体内的分布不够广泛,且含量相对较低,因此对该类成分进行研究具有一定的难度[2]。但是,研究发现该类成分可由不同的种类倍半萜单体通过不同的连接方式形成了结构复杂新颖的天然产物。并且,该类成分大多数具有抗炎、抗肿瘤、抗菌等药理活性[3]。因此,对该类成分研究具有重要的意义。
自从1980第一个倍半萜内酯二聚体苦艾素(absinthin)被鉴定以来,现已从该科植物中分离得到大量倍半萜内酯二聚体。但是,除去2011年的一篇关于自然界中存在的倍半萜二聚体的综述外,至今缺少对该科二聚体成分的系统综合的介绍[2]。因此,我们希望通过对该科2011年来分离鉴定的143个二聚体归纳总结,为该类成分的研究和开发提供参考。
1 倍半萜二聚体的分类
倍半萜二聚体(sesquiterpenoid dimer,SD)是由相同或不同种类的倍半萜单体通过不同的连接方式形成的聚合物。2011年发表的关于SD的综述是按照组成SD的倍半萜种类进行分组,由于倍半萜的种类繁多导致分组较多。查阅文献可知,SD在由两个倍半萜形成的过程主要有几种常见的方式。因此,采用倍半萜的连接方式进行分类,使分组数目减少,主要包括环化([4+2],[2+2],[3+2] Diels- Alder等方式),碳- 碳单键,酯键等形式连接形成的SD结构。
1.1 环化连接方式形成的倍半萜二聚体
环化连接方式形成的倍半萜二聚体主要是指通过环化反应形成四元环,五元环或者六元环等连接方式形成的倍半萜二聚体,主要包括以下五类:
1.1.1 [4+2] Diels- Alder加成形成的倍半萜二聚体
该类的SD成分一般是由一个含有共轭双键的供电子二烯体与另一个亲电的双键片段通过[4+2] Diels- Alder加成的方式组成。供电子的二烯体一般是指具有C5/C7/C5环系的愈创木烷内酯结构,而缺电子的双键一般为含有相关α- 亚甲基-γ- 内酯片段的倍半萜提供。
2009~2010年间,张卫东教授课题组从旋复花属植物旋复花(Inulajaponica)中分离得到了12个倍半萜内酯二聚体japonicones A- L[4,5],在2011年之后的研究中又相继分离得到了类似的二聚体结构japonicones M- V(1~10)[6- 8]。从结构上可以看出,主要可以分成分两类,分别为非裂环桉叶烷和1,10- 裂环桉叶烷内酯与愈创木倍半萜内脂的加成形成的SD。另外,其还从该植物中得到一种结构新颖的二聚体inulanolide E(11)[9],在该结构中桉叶烷内酯发生了裂解开环和氧化,形成了一个含有苯环结构片段的产物,在该类型结构中并不多见。近些年,通过对旋复花同属植物欧亚旋复花(Inulabritannica)研究,从中得到了结构新颖的倍半萜二聚体dibritannilactones B- E(12~15)[10],其分子结构上的不同是由于C- 13位的α- 亚甲基被还原为甲基。化合物及结构见图1和表1。
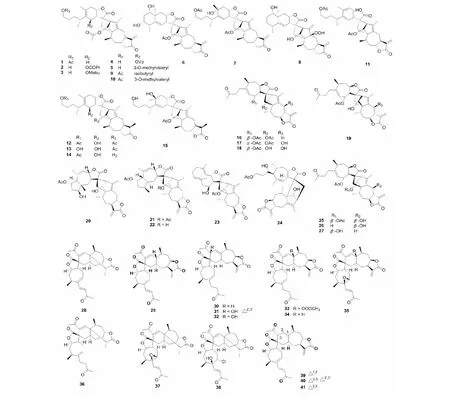
图1 倍半萜二聚体1~41的结构Fig.1 Structures of SD 1- 41
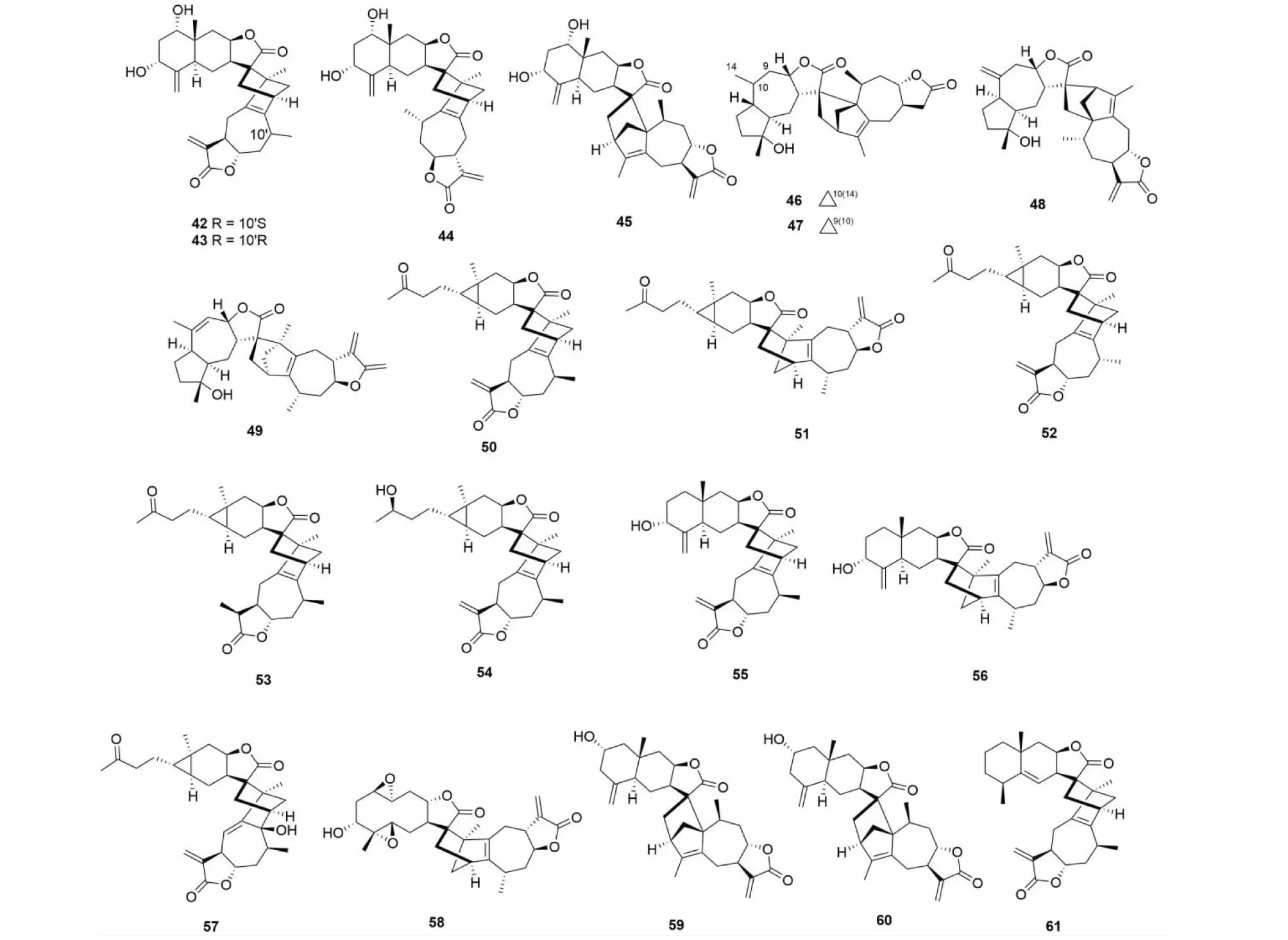
图2 倍半萜二聚体42~61的结构Fig.2 Structures of SD 42- 61
2012年从旋覆花属植物金沸草(Inulalineariifolia)中得到了四个少见的由苍耳烷内酯与愈创木烷内酯加成产物lineariifolianoids A- D(16~19)[11],后来又从同植物中分离得到lineariifolianoids E- L(20~27)[12,13],这些化合物结构中包括由愈创木烷内酯与吉玛烷内酯参与加成形成的SD。
苍耳(Xanthiummogolium)是菊科苍耳属植物,苍耳内酯倍半萜二聚体是此属植物中的特征化学成分。从1990年第一个SD从该属被分离,至2011年间只有为数不多的几个该类型的化合物被分离鉴定。但近些年有大量的二聚体(pungiolides D- O,28~38)从该植物分离得到[14],其中,化合物38是一个含有氯原子的SD[15]。另外,从其同属植物蒙古苍耳(XanthiummogoliumKitag)中得到了类似的二聚体成分mogolides B- E(39~41),且有学者以倍半萜苍耳亭为前体对mogolide B进行了合成[16,17]。化合物及结构见图1和表1。
天名精属是菊科植物研究的热点,2011~2018年间大量具有新颖骨架的倍半萜二聚体从该属中被分离鉴定。张卫东教授课题组从贵州天名精(Carpesiumfaberi)中分离得到了四个由桉叶烷内酯与愈创木烷内酯形成的新骨架结构carpedilactones A- D(42~45)[18],愈创木烷内酯聚合物guaianodilactones A- D(46~49)[19],以及faberidilactones A- H(50~57)[20,21]。大花金挖耳(Carpesiummacrocephalum)同为天名精属植物,通过对其分离得到了与从贵州天名精中被分离鉴定类似的二聚体(carpedilactones E- G,59~61)[22]。化合物及结构见图2和表1。
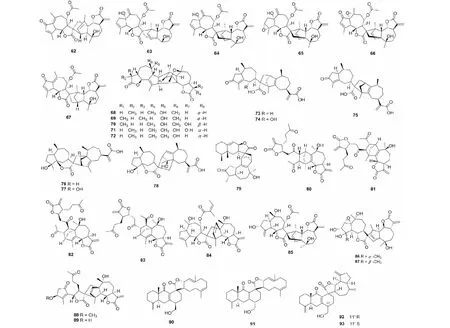
图3 倍半萜二聚体62~93的结构Fig.3 Structures of SD 62- 93
蒿属植物中含有丰富的SD,自从第一个SD从该属被分离,现已有大量的二聚体被鉴定。总结2011年后发表的SD,可以发现这些成分多是由两个愈创木烷内酯通过加成的产物。如从奇蒿(Artemisiaanomala)分离得到6个新结构二聚体artanomadimers A- F(62~67)[23],从苦艾(Artemisiaabsinthium)中得到的absinthins A- E(68~72)[24]。屠鹏飞教授课题组从新疆一支蒿(Artemisiarupestris)中分离得到了二聚体artepestrins D- I(73~78)[25]。绿栉齿叶蒿(Artemisiafreyniana)中还发现了一个由艾里莫芬内酯倍半萜与愈创木烷内酯性形成的二聚体artefreynisin A(79)[26]。另外,我们通过对从道地药材产地蕲春产的艾叶(Artemisiaargyi)进行提取分离,最后鉴定了两对1,10- 4,5裂环愈创木烷倍半萜参与的头尾加成方式和加成位置均不同的倍半萜二聚体artemisians A- D(80~83)[27]。化合物及结构见图3和表1。
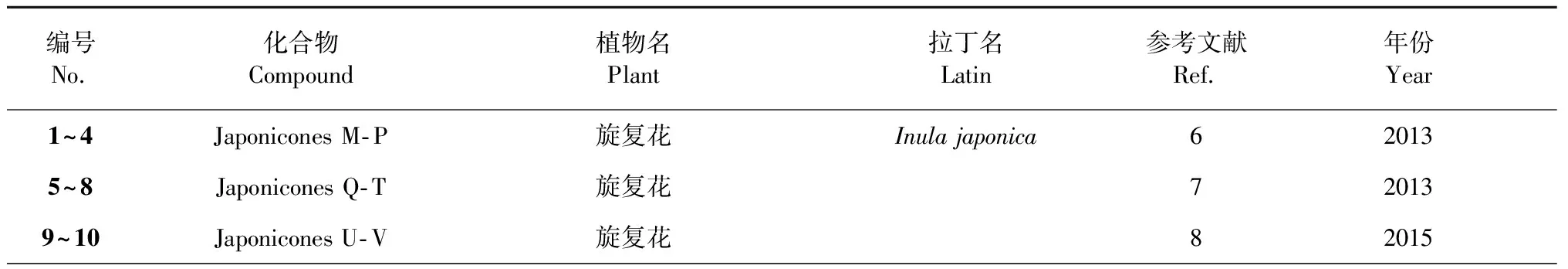
表1 [4+2] Diels- Alder加成形成的倍半萜二聚体
续表1(Continued Tab.1)
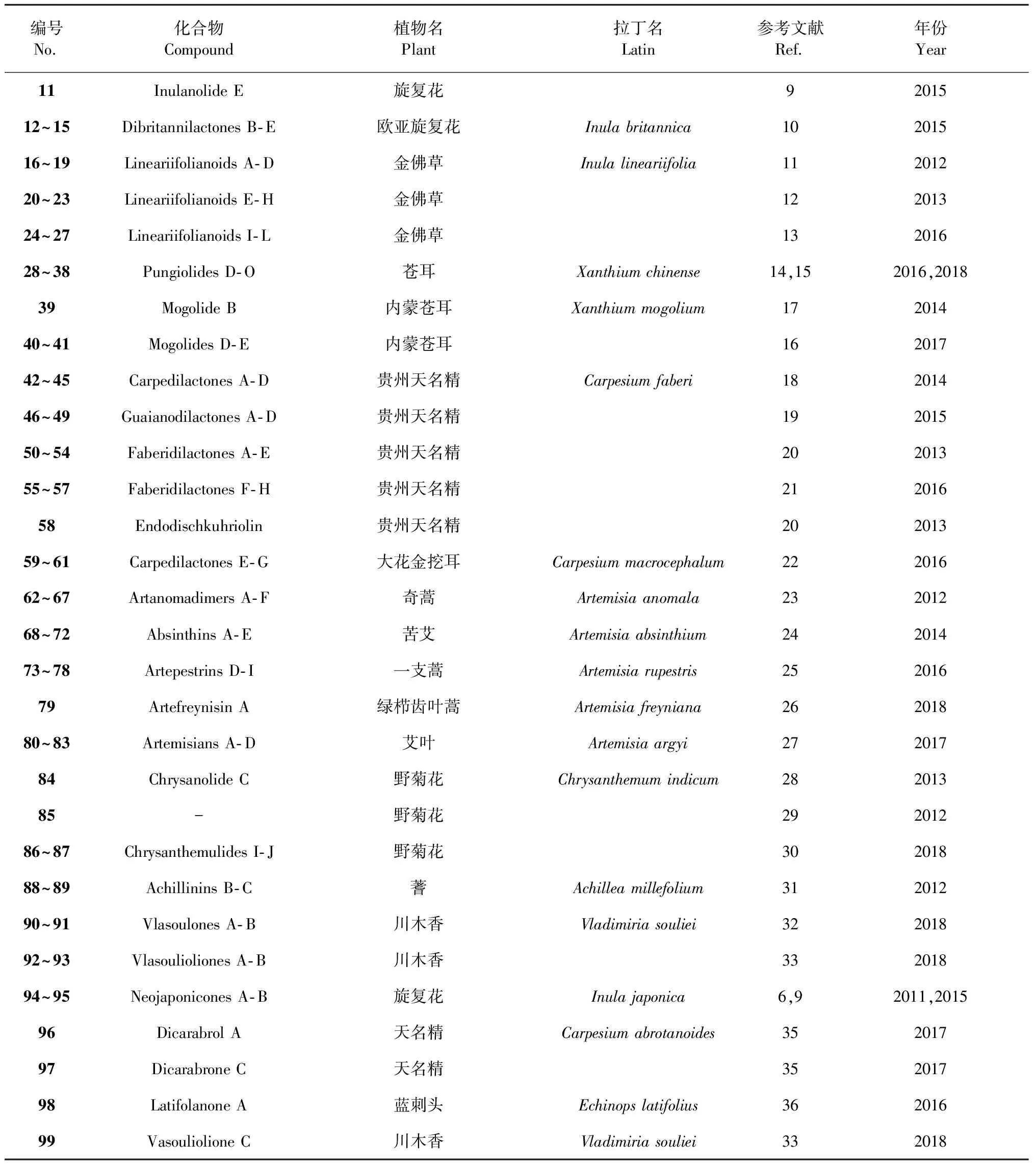
编号No.化合物Compound植物名Plant拉丁名Latin参考文献Ref.年份Year11Inulanolide E旋复花9201512~15Dibritannilactones B-E欧亚旋复花Inula britannica10201516~19Lineariifolianoids A-D金佛草Inula lineariifolia11201220~23Lineariifolianoids E-H金佛草12201324~27Lineariifolianoids I-L金佛草13201628~38Pungiolides D-O苍耳Xanthium chinense14,152016,201839Mogolide B内蒙苍耳Xanthium mogolium17201440~41Mogolides D-E内蒙苍耳16201742~45Carpedilactones A-D贵州天名精Carpesium faberi18201446~49Guaianodilactones A-D贵州天名精19201550~54Faberidilactones A-E 贵州天名精20201355~57Faberidilactones F-H贵州天名精21201658Endodischkuhriolin 贵州天名精20201359~61Carpedilactones E-G 大花金挖耳Carpesium macrocephalum22201662~67Artanomadimers A-F奇蒿Artemisia anomala23201268~72Absinthins A-E苦艾Artemisia absinthium24201473~78Artepestrins D-I一支蒿Artemisia rupestris25201679Artefreynisin A绿栉齿叶蒿Artemisia freyniana26201880~83Artemisians A-D艾叶Artemisia argyi27201784Chrysanolide C野菊花Chrysanthemum indicum 28201385-野菊花29201286~87Chrysanthemulides I-J野菊花30201888~89Achillinins B-C蓍Achillea millefolium31201290~91Vlasoulones A-B川木香Vladimiria souliei32201892~93Vlasoulioliones A-B川木香33201894~95Neojaponicones A-B旋复花Inula japonica6,92011,201596Dicarabrol A天名精Carpesium abrotanoides 35201797Dicarabrone C天名精35201798Latifolanone A 蓝刺头Echinops latifolius36201699Vasouliolione C川木香Vladimiria souliei332018
野菊(Dendranthemaindicum)中的化学成分野菊花内酯是一类SD类成分,在之前的研究中,从该植物中分离得到了具有类似结构的倍半萜二聚以及三聚体,并完成了相关化合物的合成工作。近几年,对野菊的研究较多,有少量的聚合成分被分离鉴定,这些化合物在结构上类似于之前从蒿属分离得到的SD皆为两个愈创木烷内酯聚合产物,如二聚体chrysanolide C(84)[28],野菊花内酯的类似物85[29],以及高度氧化的倍半萜内酯chrysanthemulides I- J(86~87)[30]。另外,2012年,从蓍(Achilleamillefolium)的花朵中首次分离得到了两个1,10- 裂环愈创木烷内酯参与的倍半萜二聚体achillinins B- C(88~89)[31]。化合物及结构见图3和表1。
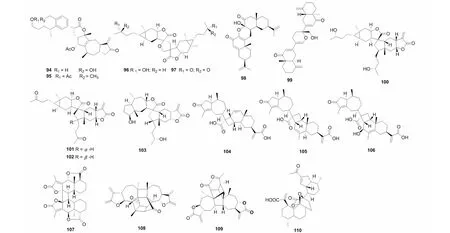
图4 倍半萜二聚体94~99的结构Fig.4 Structures of SD 94- 99

表2 其他Diels- Alder加成方式形成的倍半萜二聚体
川木香属中的SD类化学成分是近些年研究的热点,主要有张卫东教授课题组研究,vlasoulones A- B(90~91)是从川木香(Vladimiriasouliei)中分离得到的吉玛烷与桉叶烷型倍半萜通过[4+2] Diels- Alder加成方式连接形成的结构骨架新颖的SD[32]。Vlasoulioliones A- B(92~93),也是从川木香中分离得到的与之相似的结构,其差异表现在C- 11′的立体中心位置[33]。与vlasoulones A- B相比,除桉烷型倍半萜之外,其结构中的另一倍半萜为愈创木烷内酯。
1.1.2 杂氧[4+2] Diels- Alder加成形成的倍半萜二聚体
氧杂原子参与的[4+2] Diels- Alder反应主要是由具有α,β不饱和酮供电子体与缺电子片段α- 亚甲基-γ- 内酯片段连接而成[34]。如从植物旋复花中得到的1,10- 裂环的桉叶烷与愈创木烷内酯通过该方式连接的neojaponicones A- B(94~95)[6,9],这类结构不同于从其他旋复花中分离鉴定的倍半萜二聚体,其不仅有氧杂原子参与了反应,且原有的桉叶烷内酯片段在反应中水解氧化,形成了骨架新颖的结构。从植物天名精(Carpesiumabrotanoides)中分离得到的化合物dicarabrol A(96)和dicarabrone C(97)[35]是自然界中少见的由两个天名精内酯通过[4+2] Diels- Alder加成得到的SD。另外,从植物蓝刺头(Echinopslatifolius)中分离得到了由两个桉叶烷倍半萜通过氧杂[4+2] Diels- Alder加成的产物latifolanone A(98)[36]。Vasouliolione C(99)是从川木香(Vladimiriasouliei)中分离鉴定的一个由两个桉烷倍半萜聚合形成的SD[33]。化合物及结构见图4和表1。
1.1.3 [3+2] Diels- Alder加成形成的倍半萜二聚体
该类型的倍半萜二聚体只有在天名精属植物中被分离得到,主要由天名精内酯酮结构中的三元环与α- 亚甲基发生加成反应生成。其中dicarabrol(100)是从天名精(Carpesiumabrotanoides)中得到的第一个天名精内酯酮二聚体[37]。另外还从该种中分离得到了由于加成方式不同形成的二聚体dicarabrones A和B(101~102)[38]。Dipulchellin A(103)是从天名精(Carpesiumabrotanoides)中获得的一个由天名精内酯和愈创木烷内酯通过[3+2] Diels- Alder加成的产物[35]。化合物及结构见图4和表2。
1.1.4 [2+2] Diels- Alder加成形成的倍半萜二聚体
[2+2] Diels- Alder反应的SD在该科植物中并不多见,屠鹏飞教授课题组从新疆一支蒿(Artemisiarupestris)中分离得到了三个这种方式加成形成的二聚体artepestrins A- C(104~106),它们是由桉叶烷与内酯环开环的愈创木烷酸通过[2+2] Diels- Alder加成形成[25]。化合物107(biliguhodgsonolide)是从植物囊吾(LigulariahodgsoniiHook)中分离得到,其是由两个相同的艾里莫芬内酯聚合而成[39]。化合物及结构见图4和表2。
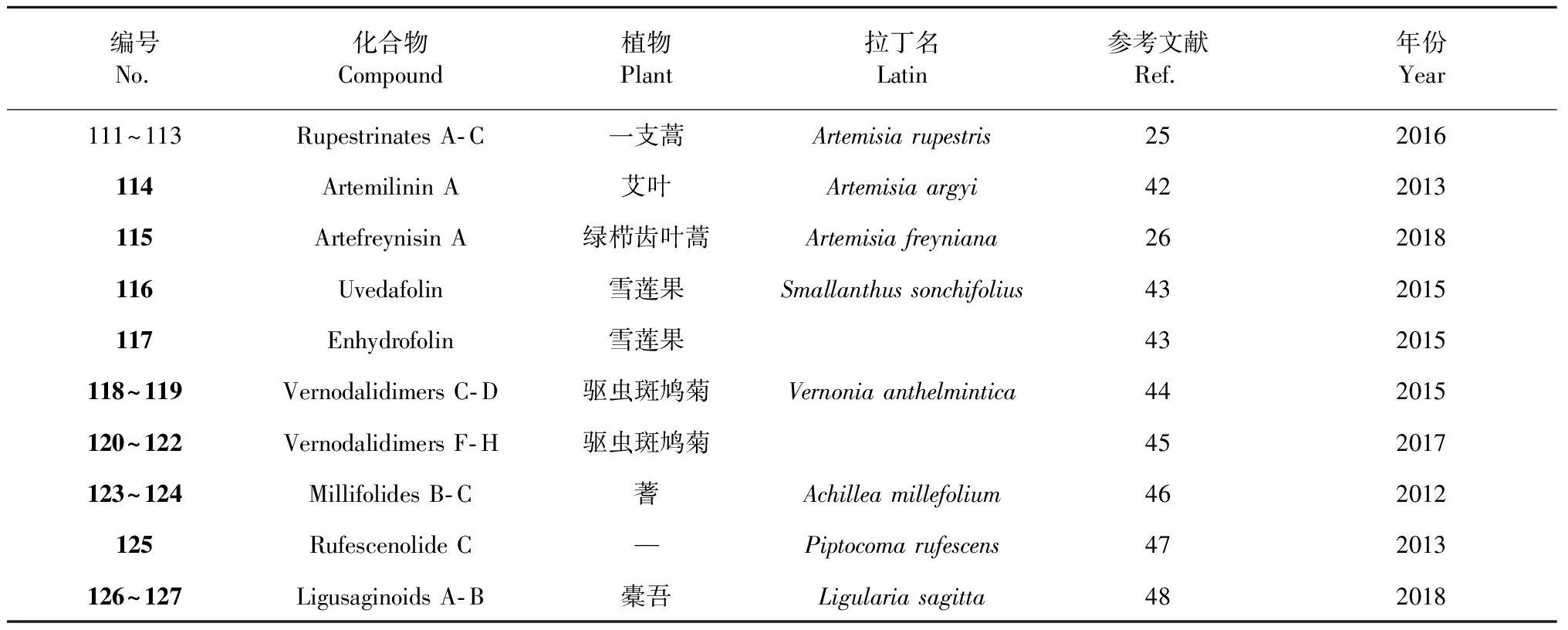
表3 通过酯键连接的倍半萜二聚体
1.1.5 Diels- Alder加成及其他反应方式形成的倍半萜二聚体
通过连续多次的加成反应,可以形成结构更为复杂的立体网状结构。Artesin A(108)是从大籽蒿(Artemisiasieversiana)中分离得到的SD,该结构是由两个愈创木烷内酯通过两次[2+2] Diels- Alder加成得到[40]。另外,还从植物蒙古苍耳(Xanthiummogolium)中得到了一个通过[4+2]/[2+2]两次Diels- Alder加成形成的二聚体mogolide A(109),且完成了以苍耳亭为前体的对mogolide A的仿生合成[17]。Arteannoide A(110)是从黄花蒿(Artemisiaannua)中分离得到一个SD,其结构首先是一个杜松烷倍半萜与一个重排杜松烷倍半萜通过氧杂[4+2] Diels- Alder反应,然后进一步通过分子内酯化反应得到[41]。化合物及结构见图4和表2。
1.2 酯键连接的倍半萜二聚体
屠鹏飞教授课题组从新疆一支蒿(Artemisiarupestris)中分离得到的二聚体rupestrinates A- C(111~113),其结构是由桉叶烷倍半萜酸与内酯开环的愈创木烷倍半萜通过酯键连接而成[31]。从艾叶(Artemisiaargyi)中分离得到了一个桉叶烷与愈创木烷内酯连接的倍半萜二聚体artemilinin A(114)[42]。从同属植物绿栉齿叶蒿(Artemisiafreyniana)中得到了一个由艾里莫芬与愈创木烷内酯通过酯键连接而成的二聚体artefreynisin A(115)[26]。另外,还从雪莲果(Smallanthussonchifolius)中发现了通过脂肪酸链连接两个吉玛烷形成的二聚体uvedafolin(116)和enhydrofolin(117)[43]。2015- 2017年间从驱虫斑鸠菊(Vernoniaanthelmintica)中获得了vernodalidimers C- D(118~119)和F- H(120~122)[44,45]。另外,还从蓍草(Achilleamillefolium)的花朵中分离得到了两个1,10- 裂环愈创木烷内酯倍半萜二聚体millifolides B- C(123~124),也是通过酯键连接[46]。Piptocoma是菊科一个小属,在植物Piptocomarufescens的叶子中得到的rufescenolide C(125)是首个由呋喃大根香叶内酯聚合形成的该类型的化合物[47]。Ligusaginoids A- B(126~127)是从橐吾(Ligulariasagitta)中分离得到,其首先由两个艾里莫酚内酯分别与一个四烯碳酸通过[4+2] Diels- Alder加成形成C19的结构片段,该片段再通过酯键连接形成了126~127[48]。化合物及结构见图5和表3。
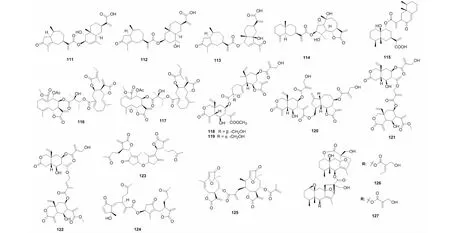
图5 倍半萜二聚体111~127的结构Fig.5 Structures of SD 111- 127
1.3 碳- 碳单键连接的倍半萜二聚体
该类型SD的生物合成路径经推测主要通过自由基反应生成。化合物pungiolide F(128)是从苍耳(Xanthiumchinense)中得到的通过碳- 碳单键连接的该类型化合物[14]。有报道从植物侧茎橐吾(Ligulariapleurocaulis)中分离得到了一个艾里莫芬内酯的聚合物biligupleurolide(129)[49]。从驱虫斑鸠菊(Vernoniaanthelmintica)中得到的vernodalidimer E(130)也是通过自由基单键连接[44](前体为斑鸠菊大苦素)。化合物131是从贯叶佩兰(Eupatoriumperfoliatum)中分离得到的一个通过C- 14/C- 4位连接的二聚体[50]。张卫东教授课题组植物川木香(Vladimiriasouliei)中分离得到的vlasouliolides A- D(132~135),是首次报道的两个不同碳原子个数(由15与17个碳)倍半萜通过单键连接而成[51],推测C17倍半萜结构单元主要是由于乙酰辅酶A的催化[52],在分子结构片段α- 亚甲基-γ- 内酯的C- 11位连接了乙酰基。随后,又从同植物中分离得到了vlasouliolides E- K(136~142),均具有相似的C15/C17结构单元[52,53]。化合物及结构见图6和表4。
1.4 其他方式连接的倍半萜二聚体
Vlasoulamine A(143)是一个特殊结构的SD,其两个愈创木内酯倍半萜之间通过一个pyrrolo [2,1,5- cd]中氮茚骨架结构连接,在自然非常少见[46]。化合物及结构见图6和表4。
2 倍半萜二聚体的活性研究
菊科植物SD的药理活性评价,主要针对抗炎,细胞毒,神经保护,抗病毒和抗真菌等活性。一些化合物在活性筛选的过程中也显示出了良好的活性。
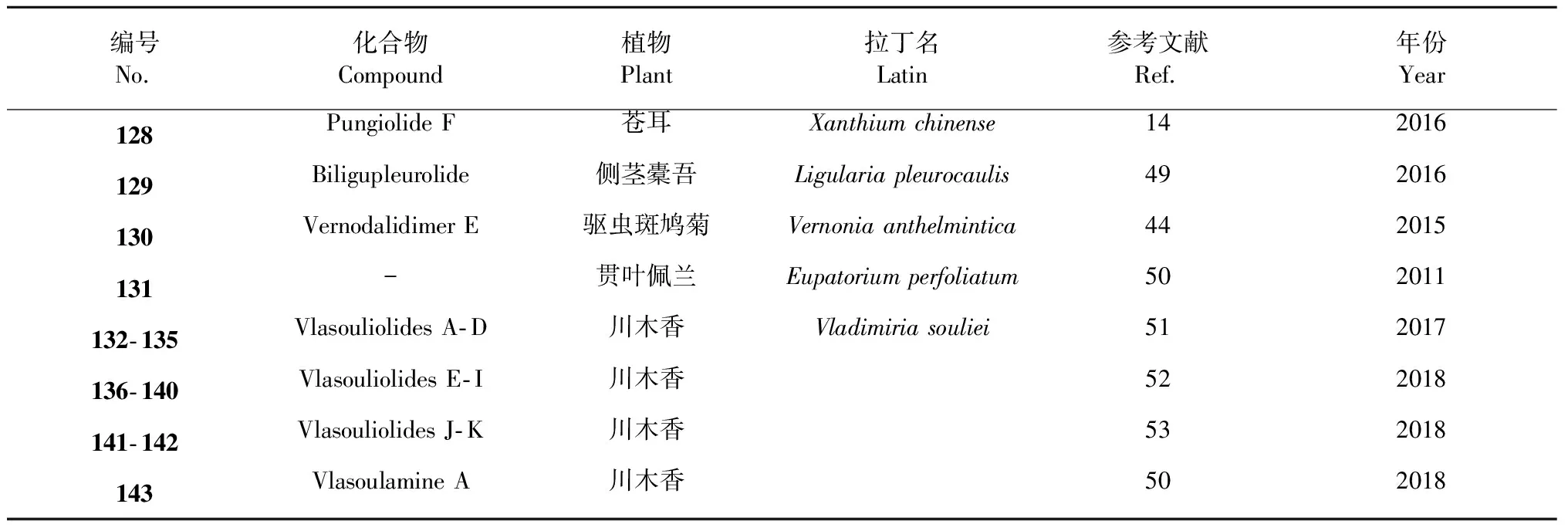
表4 通过碳- 碳单键和其他方式连接的倍半萜二聚体
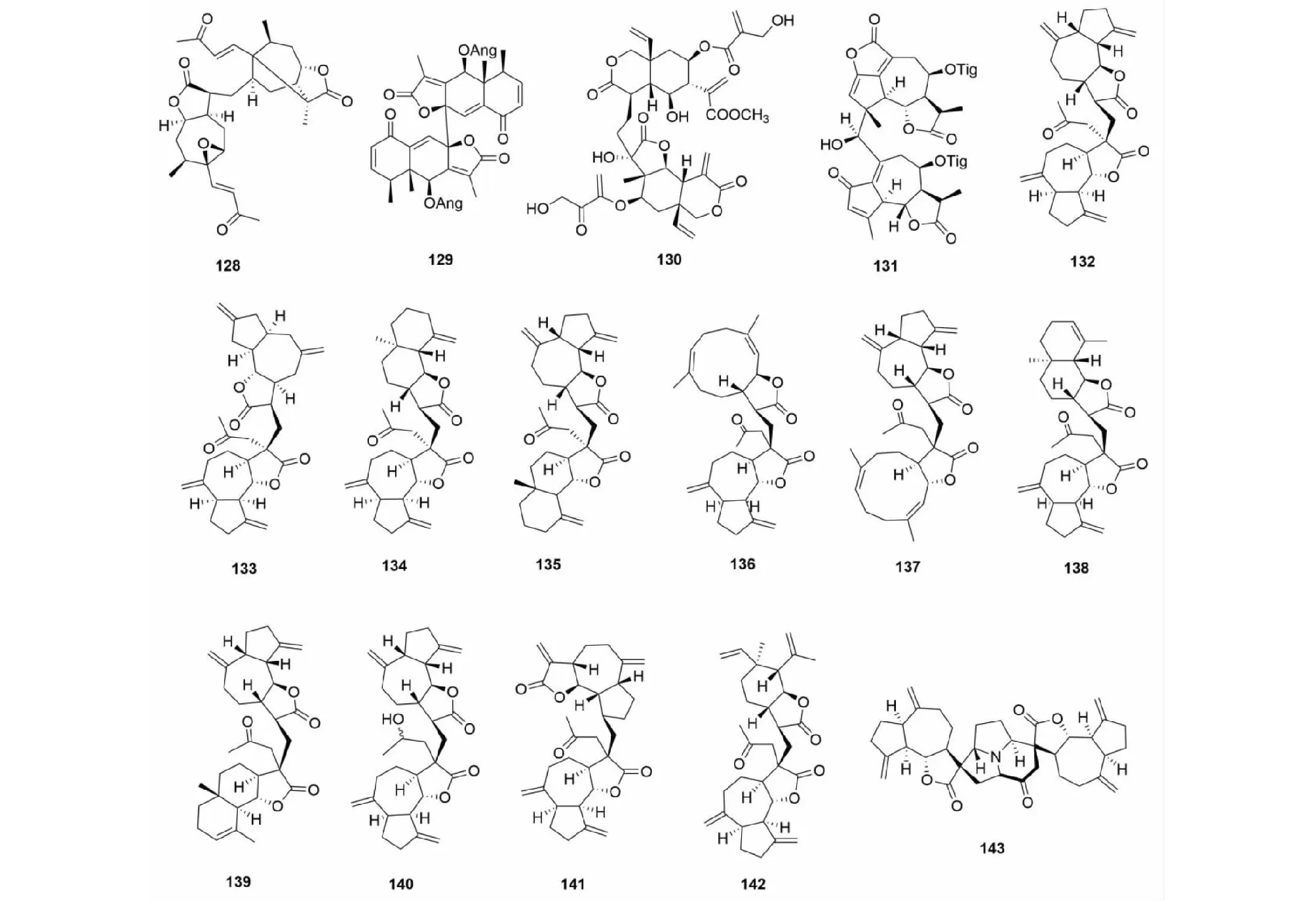
图6 倍半萜二聚体128~143的结构Fig.6 Structures of SD 128- 143
2.1 抗炎活性
炎症抑制是倍半萜二聚体特征活性,多数化合物在RAW264.7上显示较好的NO抑制活性,如japonicones M- P(1~4)筛选结果显示其中化合物1的IC50值为12.0 μg/mL[6]。同植物中分离得到的相似成分japonicones Q- T(5~8)NO抑制活性显示IC50分别8.5、8.9、4.3、4.3 μmol/L[7]。Dibritannilactones B- E(12~15)显示中等LPS诱导的NO产生抑制活性IC50:25.08~49.44 μmol/L[10]。化合物24-25活性较好IC50分别为1.02和1.79 μmol/L,26和27显示中等活性IC50分别为10.02和10.16 μmol/L[13]。Artefreynisin A(79)具有中等NO抑制活性,在RAW264.7细胞株上IC50为38.3 μmol/L,另外细胞毒活性筛选显示IC50均大于50 μmol/L[26]。Chrysanthemulides I和J(86和87)在LPS诱导NO的RAW264.7细胞株上,二聚体相对单体活性较差IC50大于50 μmol/L[30]。
另外,除了在RAW264.7细胞株上的抗炎活性筛选外,抗炎活性的评价还在神经炎症BV- 2细胞株上进行。如absinthins A- E(68~72),在BV- 2细胞株上,absinthin C相对于阳性药槲皮素(IC5010.01 μmol/L)具有更好的NO抑制活性(IC501.5 μmol/L)[24]。对从新疆一支蒿的是12个倍半萜二聚体artepestrins A- I(104~106,73~78)和rupestrinates A- C(111~113),在LPS诱导的BV- 2细胞株上NO抑制活性筛选显示具有中等抑制活性IC50值为17.0~71.8 μmol/L,其中化合物74,76和104活性较好(IC5023.0±1.5、17.0±0.6和27.3±0.7 μmol/L),初步构效关系研究表明化合物的活性可能与化合物的构型及羟基的取代有关,这些化合物的抗炎活性说明新疆一支蒿(A.rupestris)在治疗炎症疾病方面的传统功效[25]。
Vlasouliolides A- D(132~135)在LPS- 诱导的293T细胞株上显示显著的NO抑制活性IC50值分别为1.14、2.53、1.57和3.19 μmol/L。另外,化合物132和133还可抑制NF-κB和IκBα的磷酸化[51]。Lasouliolides E- I(136~140)在LPS诱导的RAW 264.7细胞株上显示出显著的炎症抑制活性,其中vlasouliolides E- F,vlasouliolides H- I的IC50值分别为1.88、4.89、7.24和2.46 μmol/L,并且化合物136~137在10 μmol/L可显著降低NF-κB的磷酸化水平[52]。
2.2 抗肿瘤活性
分离得到的大部分SD都进行了细胞毒活性的评价,并且多数二聚体对不同类型肿瘤细胞具有优越的细胞毒活性并且显示出了一定的构效关系。首先在乳腺癌细胞株上,对化合物japonicones U- V(9~10)细胞毒活性的评价,其中japonicone V(10)在乳腺癌MCF- 7,MDA- MB- 231细胞株上活性较好IC50值分别为0.20±0.04和6.22±1.30 μmol/L[8]。另外lineariifolianoids E- H (20~23)在相同两珠乳腺癌细胞株上也具有细胞毒活性,且在正常乳腺细胞上毒性较弱,尤其是20IC50为1.56~2.75 μmol/L,显示出了一定的选择性[13]。化合物mogolides D和E(40和41)同样具有抑制乳腺癌MDA- MB- 231的活性IC50分别为8.46和19.20 μmol/L,并且化合物40和41在5.0 μmol/L时,对JAK- STAT3信号通路具有一定的抑制活性[16]。Artemisians A- D(80~83)均具有抑制乳腺癌细胞增殖活性,其中化合物80IC50为3.21 μmol/L,可通过抑制细胞G2/M阻滞诱导乳腺癌MDA- MB- 468细胞的凋亡[27]。
白血病一直是一种难于治愈的疾病,因此发现具有该疾病抑制活性的先导化合物具有重要意义。Inulanolide E(11)在人白血病细胞株6T- CEM和Jurkat,相对与paclitaxel,都显示出显著的细胞毒活性IC50为2.2~5.9 μmol/L[9]。另外骨架新颖的carpedilactones A- D(42~45)在人白血病CCRF- CEM细胞株上具有较好的细胞毒活性IC50值分别为0.14、0.32、0.35、0.16 μmol/L,且相对其倍半萜单体granilin细胞毒活性更强[18]。其类似结构guaianodilactones A- D(46~49)在CCRF- CEM细胞株具有类似的细胞毒活性IC50为2.03~13.72 μmol/L[19]。Faberidilactones A- E(50~54)在CCRF- CEM,K562,HL- 60和HCT116具有较强的细胞毒性IC501.11~8.50 μmol/L。Faberidilactones F- H(55~57)在CCRF- CEM上,具有较好的细胞毒性IC50值分别为5.62和3.74 μmol/L,并且相对单体carabrone(IC5043.66 μmol/L),二聚体活性更好[20]。
构效关系研究表明一些具有exo- 加成类似物的SD具有好的活性。如lineariifolianoids A- D(16~19),TNF-α介导的细胞毒活性筛选显示外向型exo- 加成类似物lineariifolianoid D(19)在2.5~10.0 μmol/L显示出剂量依赖活性,endo- 加成类似物16~18没有细胞毒活性[12]。另外,exo- 二聚体50,52和54(65.98、53.27和71.45%)相对于endo- 二聚体51(38.59%)对NF-κB具有更好的抑制活性,并且50,52和54在bEnd.3细胞株上可依赖性抑制TNF-α诱导的NF-κB亚基磷酸化和IκBα降解。另外,二聚体50,52和54相对与53具有α- 亚甲基-γ- 内酯活性显著,并且相对与单体carabrone,4R- carabrol活性也较好[20]。但是artemilinin A(114)虽然具有α- 亚甲基-γ内酯活性官能团,但是对HL- 60、BGC- 823、Bel- 7402,KB等肿瘤细胞上均无活性[42]。
如上描述一些二聚体相对于单体显示出了较好的活性。Dicarabrones A和B(101和102)在A549和HL- 60具有中等活性的细胞毒活性,但其前体carabrone对两种细胞株均无细胞毒活性[38]。Uvedafolin(116)和enhydrofolin(117)在Hela,HL- 60,B16- F10肿瘤细胞株上具有较好的活性IC500.2~1.9 μmol/L,相对于一起被分离得到的单体uvedalin,sonchifolin,enhydrin,聚合物活性更好,并且C- 9被乙酰基取代可显著增加细胞毒活性[43]。Carpedilactones E- G(59~61)具有较好的细胞毒活性,其中59在A549、BEL 7404、HCT116和MDA- MB- 231细胞株上IC50分别为2.04、2.27、5.17和3.77 μmol/L,且相对前体单体ivalin与alantolactone具有更好的活性[41]。
最后,对于分离到的SD,大部分化合物在不同的肿瘤细胞株上进行细胞毒活性的筛选,且有些化合物对某些细胞株显示出了选择抑制活性。Pungiolides D和E(28和29)在人肝癌细胞株SNU387上显示中等活性IC50为14.6和11.7 μmol/L,但是对A- 549肝癌细胞(IC50> 40 μmol/L)无活性[14,15]。Dicarabrol A(96)与dicarabrone C(97)及dipulchellin A(103)在A549,HL- 60细胞株上进行活性筛选,显示对HL- 60细胞株的选择抑制活性,但对A549无细胞毒活性(IC50> 10 μmol/L)[35]。Vernodalidimers C- D(118~119)及vernodalidimer E(130)在A- 549、HCT- 15、PC- 3,T47D细胞株上进行细胞毒活性筛选,vernodalidimers C- E对T47D细胞株显示出选择抑制活性IC505.58、0.95和12.75 μmol/L,阿霉素为阳性药25.50 μmol/L[44]。Pungiolides F- N(30~38)相对于阳性药紫杉醇(IC500.001 18~0.067 5 μmol/L)在HCT- 116、HepG2、BGC- 823等细胞株上显示出了中等的细胞毒活性(IC500.90~6.84 μmol/L)[14]。Artanomadimers A- F(62~67)在胃腺癌细胞BGC- 823上显示出了较强的细胞毒活性。对vernodalidimers F- H(120~122)在HCT- 15、PC- 3、A549和Hela细胞株上进行活性评价,化合物120和122显示中等程度的细胞毒活性IC5012.2~28.6 μmol/L[45]。Rufescenolide C(125)在HT- 29结肠癌细胞具有显著的细胞毒活性IC500.150 μmol/L[47]。Biligupleurolide(129)在MCF- 7、HepG2和A549显示中等抑制活性IC50为5.2、5.6和8.4 μmol/L[49]。
2.3 神经保护活性
用CCK- 8法对化合物90、91和143在谷氨酸诱导的大鼠嗜铬细胞瘤PC12细胞珠上进行神经保护作用活性评价,研究结果显示,vlasoulamine A(143)在15.0 μmol/L时显示对PC12谷氨酸诱导的细胞毒具有保护作用[32]。Hoechst 33258染色表明,谷氨酸盐处理可明显引起细胞核碎片增多,但是在经143(浓度5、10、15 μmol/L)处理后,细胞的凋亡率由59.14%±1.9%下降到53.17%±2.6%,35.1%±2.4%和22.2%±1.6%。另外,谷氨酸盐处理后的PC12细胞活性氧(ROS)增多,但是143可降低活性氧的水平,发挥神经保护活性。Vlasoulioliones A- C(92、93、99)在如上相同细胞模型上进行活性筛选,该类化学成分也显示出了一定的神经保护活性[33]。另外,化合物141可显著降低谷氨酸诱导的PC- 12神经细胞毒活性EC50值为2.11±0.35 μmol/L,在10.0 μmol/L浓度时,141可显著降低谷氨酸诱导的PC- 12的细胞内乳酸脱氢酶(LDH)的释放发挥神经保护作用[53]。
2.4 抗病毒与抗菌活性
对chrysanolide C(84)抗乙型肝炎病毒筛选结果显示,其具有潜在的乙肝表面抗原(HBsAg,IC5033.91 μmol/L)和乙型肝炎E抗原(HBeAg,IC5030.09 μmol/L)抑制活性[28]。对dicarabrol(100)抗病毒活性筛选,发现其具有较好的H1N1和H3N2,IC50值分别15.9和30.0 μmol/L,另外其也具有较好抗真菌活性IC503.7 μmol/L。Ligusaginoids A和B(126和127)抗菌活性筛选结果显示在E.coli,B.subtilis,C.perfringens,S.typhimurium和K.pneumoniae菌株上,均显示出较弱的抗菌活性,MIC值在80 μg/mL左右[48]。
2.5 其他活性
在B16黑色素瘤细胞珠上,对vernodalidimers F- H(120~122)活性筛选,其中120可增加B16细胞内黑色素的含量,且相同浓度下比阳性药8- methoxypsoralen细胞内黑色素的量高出43.6%[45]。通过抗疟原虫P.falciparum,L.donovani,T.brhodesiense和T.cruzi活性筛选,化合物131对疟原虫P.falciparum显示显著的活性(IC502.0 μmol/L),并且该化合物在L6大鼠骨骼肌成肌细胞珠上细胞毒活性较弱(IC5016.2 μmol/L,选择指数为8)[50]。
3 结语
SD是菊科植物特征性的化学成分之一,对比2011年之前关于SD的综述,发现从该科植物分离得到的SD主要是两个愈创木烷内酯之间通过加成形成的聚合物。通过总结2011年以来该成分的研究状况可以发现,不同种类倍半萜通过不同的连接方式形成了结构更为多样,骨架更为新颖的二聚体,这些化合物在抗炎、抗肿瘤、抗菌抗病毒及神经保护等方面显示出了较好的药理作用。通过本论文总结可以发现二聚体分布且研究比较集中的属为旋复花属、天名精属、苍耳属以及之前就开始研究的蒿、菊等属。虽然在菊科其他的种属也有分布,但是分离得到的化合物数量较少。对比倍半萜的综述可以看到倍半萜单体相对于二聚体应具有更广泛的分布[54,55],但SD一般是由倍半萜单体通过加成反应,自由基反应以及酯化反应等方式形成。这些结构丰富的倍半萜单体,为形成结构复杂的聚合物提供更大的可能性。另外,可以发现这倍半萜通过不同的立体加成反应方式形成了数量更为丰富的立体产物。因此,对于倍半萜含量丰富的植物来说,推测其可能含有SD成分。另一方面也可以推测SD在植物内应具有更广泛的数量和分布,但是相对单体倍半萜成分由于含量较低,不容易被发现,在研究上仍具有一定的难度。但是随着分离分析技术的提高,也将会有更多的二聚体从菊科植物中发现。
另外,SD具有较多的立体中心,尤其是其加成后的产物往往具有立体网状的结构,在对其结构进行鉴定时具有一定的难度,通过其前体倍半萜推测其可能生物路径进行,有助于结构的确证。与此同时,近些年来,通过这些单体,推测其在生物体内的生物转化路径,实现二聚体的仿合成也是非常有效的手段。但是,鉴于二聚体复杂的结构,至今也只有少量的SD被转化合成[56- 58]。因此,通过选择合适的仿生合成手段,实现二聚体的转化合成,无论从结构鉴定,还是合成化学都会是一个非常具有潜力与价值的研究方向。
