姜黄素调控Nrf2信号通路改善运动性肾损伤大鼠肾脏细胞外基质沉积的机制研究
2020-01-09牛衍龙曹建民周海涛魏江山邵芙蓉
牛衍龙,曹建民,王 祯,周海涛,胡 戈,郭 娴,魏江山,邵芙蓉
1赣南医学院,赣州 341000;2北京体育大学运动人体科学学院,北京 100084;3北京联合大学生物化学工程学院,北京 100023;4北京联合大学 生物活性物质与功能食品北京市重点实验室,北京 100191;5长治医学院 长治 046000
肾脏细胞外基质(extracellular matrix,ECM)主要由不同类型的胶原蛋白、糖蛋白、蛋白多糖、弹性蛋白等成分组成,是细胞生理活动的外环境,在细胞间起机械支撑作用和连接作用,是细胞间信号转导的桥梁。在肾脏发育及生理、病理过程中,ECM(成分表达量、组成成分、排列结构)常发生显著改变,直接参与组织形态重构,还可通过信号转导机制,影响肾脏病理/生理活动进程。研究表明,病理(糖尿病等)/生理应激(大强度运动等)可引发肾脏炎症因子过度表达并促进肾脏固有细胞增殖,黏附因子表达增加,ECM生成过多,进而破坏肾脏ECM代谢的动态平衡,对肾脏结构和功能造成损伤[1,2]。核转录因子NF-κB是炎症级联反应的重要调控因素。而Nrf2通路与NF-κB通路可以相互作用,Soares等[3]验证了受Nrf2调控的HO- 1是Nrf2信号通路与NF-κB信号通路之间相互作用的枢纽,激活Nrf2通路可以上调HO- 1的表达,进而抑制NF-κB的活化与核异位,从而减轻机体的炎症反应。姜黄素是天然中草药(姜科、天南星植物根茎)提取的酚类黄色素,具有抗氧化、抑炎及免疫调节等作用[4]。团队前期研究表明[5,6],姜黄素不仅可以通过调控Nrf2信号通路,有效缓解过度训练引发的氧化应激,抑制大鼠肾脏细胞凋亡,还能抑制NF-κB活化,降低TNF-α等炎症因子的分泌,进而保护肾脏组织结构和功能的正常。本研究采用团队前期研究成熟的过度训练致大鼠肾脏损伤模型,选用姜黄素为干预物,探究其发挥级联效应通过调控Nrf2信号通路,抑制NF-κB的活化与核异位,缓解炎症因子的过度表达,进而抑制和改善运动性肾损伤大鼠肾脏ECM过度沉积的作用机制。
1 材料与仪器
1.1 实验动物
实验选用雄性SPF级大鼠44只(7 周龄),体重213.50±10.13 g,由北京大学医学部实验动物科学部提供,合格证编号:SCXK(京)2016- 0010。标准实验动物饲养环境下喂养:温度20~24 ℃,相对湿度50%~70%,昼夜明暗交替各12 h,以中华人民解放军军事医学科学院实验动物中心提供的基础饲料和动物饮用蒸馏水常规饲养(不限制饮食量)。实验周期46天,递增负荷训练42天。
1.2 试验用药及主要试剂
姜黄素(纯度>99%,陕西源泰生物科技公司购得,产品批号:17012571),用0.5%羟甲基纤维素钠配成悬浊液,置于4 ℃冰箱备用。
Jaffe苦味酸法测定血清肌酐(SCr,生产批号:20180514);二乙酰- 肟法测定血清尿素氮(BUN,生产批号:20180515);放射免疫法测定血清睾酮、皮质酮(T、Cor,生产批号分别是:20180518、20180519);免疫组化法检测Nrf2、血红素氧合酶(HO- 1)的表达和分布情况(抗体批号:ab137550、ab13248);Western- blot法测定NF-κB蛋白表达量(抗体批号:SAB4502610),内参选用GAPDH鼠单克隆抗体(抗体批号:D16H11);Elisa法测定血清和肾脏内TGF-β1含量(试剂盒批号:ab119558)。以上试剂盒和抗体依次由北京华英生物技术研究所、武汉谷歌生物科技有限公司、abcam公司提供。
1.3 主要仪器
动物跑台(杭州段式),Tecnai Spirit电子显微镜(美国680FEI公司),Nikon 50i光学显微镜(日本Nikon公司),酶标仪(美国BIO- RAD公司),r- 911全自动放免计数仪(中国科技大学实业总公司),Pannoramic MIDI 全自动数字切片扫描系统(匈牙利3D HISTECH 公司),CM- 2000B生物医学图像分析系统(北京航空航天大学),凝胶成像系统(美国BIO- RAD公司)。
2 实验方法
2.1 动物分组
44只大鼠经4 天适应性饲养后,以数字随机分组法分为3组:对照组(C组,12只),过度训练组(OL组,16只)和姜黄素+过度训练组(COL组,16只)。
2.2 实验方案
2.2.1 训练及干预方案[6,7]
C组常规饲养,不进行运动与灌胃干预。OL和COL组进行为期6周的递增负荷跑台训练,跑台坡度为10°,每周训练6天,具体方案如下图所示。训练期间COL组于每天训练前1 h灌胃200 mg/kg/d、5 mL/kg姜黄素1次,其他组灌胃等体积0.5%羧甲基纤维素纳。

图1 大鼠跑台训练方案Fig.1 Treadmill training program of rat注:从第2周开始,每次训练初始速度为10 m/min,每5 min增加5 m/min,直至本周目标强度。最后一周训练,大鼠若无法维持目标强度,则运动至力竭。Note:10 m/min as initial velocity.Training starts from 10 m/min and increases by 5 m/min every 5 min until the target speed of this week starting from the second week.During the last week of training,if the rats could not maintain the target speed,they would exercise to exhaustion.
2.2.2 实验样品采集
训练期间受训练强度、训练时间、恢复时间等因素影响,进行运动干预的大鼠出现意外死亡,OL组剩余13只,COL组剩余15只。
6 周末训练结束后24 h,各组大鼠采用戊巴比妥钠(浓度为2%)腹腔注射麻醉,腹主动脉取血,并4 ℃、3 000 rpm离心10 min分离制备血清后放入- 20 ℃冰箱中保存待测。分离左侧肾脏剔除筋膜后切取约1 mm×1 mm×1 mm肾皮质,迅速放于2.5%戊二醛固定液常温固定4 h后4 ℃保存,剩余左侧肾脏浸入组织固定液(4%多聚甲醛),固定24 h。分离右侧肾脏剔除筋膜后置于预冷的生理盐水中洗净血污,分成4块用锡纸包裹后后迅速投入液氮暂存,随后保存于- 80 ℃冰箱冻存待测。
STM32有USART_CR1~3三个串口控制寄存器,USART_CR1是最常用的,其中RXNEIE为接受缓冲区非空中断使能.系统采用串口中断法进行串口通信.首先在程序中启用USART中断功能,当数据接收完之后,USART_CR1寄存器中的RXNEIE置为‘1’,然后产生中断,可以在中断函数中将数据读出,然后清除中断标志.串口中断法的优点在于摆脱了对CPU的实时依赖,当数据接收完毕之后,自动进入中断函数,然后CPU去执行数据处理,通过中断法,大大提高了CPU的执行速率.同时串口中断法大大降低了CPU的占用率,各个串口按照中断优先级协调工作,数据有条不紊地进行接收处理显示.
2.2.3 肾脏病理学和超微结构观察
取出固定在多聚甲醛中的肾脏组织,分别进行冲洗、脱水、透明、渗透、包埋、切片、HE染色。光镜下低倍镜随机选取肾小球位置,然后切换至400倍镜下进行拍照,观察视野中所包含肾小球的内部组织结构。
取出固定在戊二醛中的肾脏组织块,依次进行冲洗、锇酸固定、铀染、脱水、渗透、高温聚合、修块等操作,最终切片机制成1 μm切片并捞至铜网中。透射电镜(TEM)观察肾脏超微结构。
2.2.4 肾组织PAS染色切片图像分析
肾脏石蜡切片脱蜡脱水,依次进行固定液固定,1%过碘酸水溶液染色,Schiff试剂染色,滴加0.5%亚硫酸氢钠,苏木精复染细胞核,水洗,脱水,透明,封片。最终结果为,PAS阳性表达,呈红色颗粒状或弥散状。红色的深度与所含糖原的量呈正相关。肾脏组织的染色分布为:肾小球的基底膜、囊壁层以及细胞外基质将会被染成红色,而细胞核经苏木精复染后将呈现蓝黑色。
400倍光镜下,使用北航图像采集模块软件,采集视野要求:视野中的肾小球必须同时包含尿极和血管极;采用北航医学病理图象分析软件,描绘出肾小球毛细血管袢轮廓,将胞外基质和细胞成分区分开来,测量单一肾小球及其基质的面积。
2.2.5 免疫组化分析抗氧化通路因子
免疫组化法检测Nrf2和HO- 1蛋白的表达情况。肾脏石蜡切片进行脱蜡脱水、抗原修复、阻断内源性过氧化物酶、一抗和二抗孵育、DAB显色、复染细胞核、封片。显微镜400倍镜下观察:细胞核呈蓝色,而DAB显出的阳性表达则为棕黄色,随机选取视野,拍照后采集图像,分析并计算组织化学评分(H- SCORE),H- SCORE = ∑(PI × i)=(percentage of cells of weak intensity × 1)+(percentage of cells of moderate intensity × 2)+(percentage of cells of strong intensity × 3),其中PI表示阳性细胞数与所有细胞数的百分比;i代表着色强度[8]。
2.2.6 蛋白印迹法分析炎症调控因子
取出- 80 ℃冰箱中肾脏组织块,研磨制备定量蛋白溶液,并依次进行上样、电泳、转膜、封闭、一抗和二抗孵育、曝光等,凝胶成像后用Image- Lab软件进行分析。
2.3 数据统计与分析
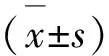
3 结果
3.1 大鼠肾脏组织形态学及超微结构变化
光镜下观察大鼠肾皮质肾单位的组织学形态,具体变化如下图。
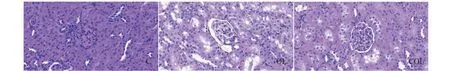
图2 大鼠肾组织形态学变化(HE × 400)Fig.2 Pathological changes in renal tissue of rats (HE × 400)
C组肾小球内结构紧凑有致,未出现淤血,血管球与囊腔壁界限明显,血管内红细胞分布规律;OL组肾小球出现明显肿胀、淤血,内部间隙变窄,部分血管球与囊腔壁界限不清,系膜区增大,毛细血管管腔扩张,血红细胞有不规则堆积现象;COL组肾小球略显肿胀,界限不清等情况减轻,系膜区、毛细血管等形态学异常仍然存在。
透射电镜下观察大鼠肾小球内部超微结构,每张铜网切片视野下包含基底膜、足细胞及间质细胞,具体变化如下图。
C组:肾小球滤过屏障内皮层结构清晰,基底膜厚度均匀,足细胞结构完整,足突分布均匀,间质细胞完整清晰;OL组:肾小球内血管结构扩张,基底膜厚度不均,足细胞体结构残缺,部分足突融合,间质细胞分散且杂乱;COL组:肾小球内皮层部分异常,少量足突融合,间质细胞收缩。
3.2 大鼠肾组织PAS染色结果
光镜(400 倍)下采集视野,视野中肾小球必须包含尿极和血管极,如下图。采用北航医学病理图像分析软件,描出肾小球毛细血管袢轮廓,将胞外基质和细胞成分区分开来,测量单一肾小球及其基质的面积。
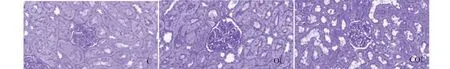
图4 大鼠肾ECM沉积情况Fig.4 ECM deposition in glomeruli of rats (PAS × 400)
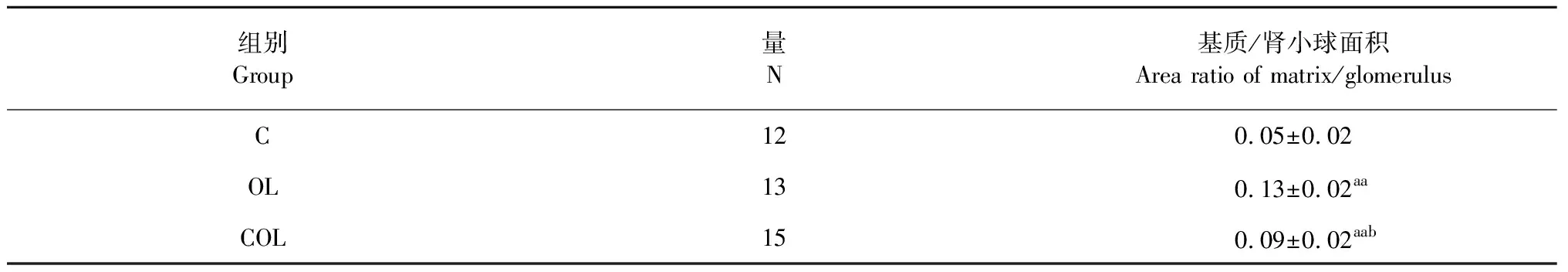
表1 各组大鼠肾组织ECM沉积情况
注:与C组比,aaP<0.05;与OL组比,bP<0.05。
Note:aaP<0.01vsgroup C;bP<0.05vsgroup OL.
图4、表1结果可知,对比各组大鼠肾单位基质与肾小球面积的比值:OL和COL组均显著高于C组(P<0.01);而COL组显著低于OL组(P<0.05)。
3.3 大鼠模型确定指标检测结果
血液生化指标是用来确定动物模型建立的,主要分为两类:过度训练的检测指标:睾酮(T)和皮质酮(Cor);肾脏损伤的检测指标:血肌酐(SCr)和尿素氮(BUN)。
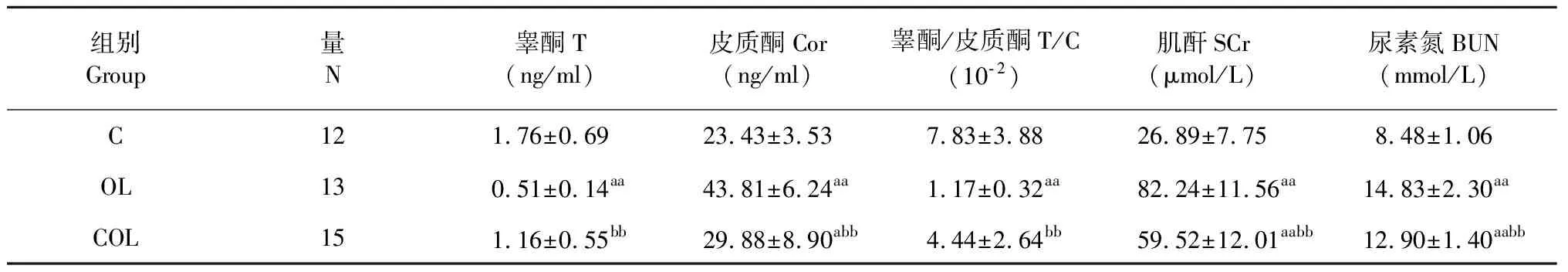
表2 各组大鼠血液模型指标
注:与C组比,aP<0.05,aaP<0.01;与OL组比,bbP<0.01。
Note:aP<0.05vsgroup C;aaP<0.01vsgroup C;bbP<0.01vsgroup OL.
表2结果可知,过度训练的检测指标:血清睾酮,OL组显著低于C组(P<0.01),COL组显著高于OL组(P<0.01),而C组和COL组无显著性差异(P>0.05);血清皮质酮,OL组、COL组均显著高于C组(P<0.01,P<0.05),而COL组显著低于OL组(P<0.01);且睾酮与皮质酮比值的变化趋势与睾酮变化一致。肾脏损伤的检测指标:血清肌酐与尿素氮变化趋势一致,OL组、COL组均显著高于C组(P<0.01),而COL组显著低于OL组(P<0.01)。
3.4 大鼠肾组织炎症因子的含量变化
分别检测肾脏组织内TGF-β1、TNF-α、IL- 1β的含量,具体数值如下表。

表3 各组大鼠肾组织内炎症因子含量
注:与C组比,aP<0.05,aaP<0.01;与OL组比,bbP<0.01。
Note:aP<0.05vsgroup C;aaP<0.01vsgroup C;bbP<0.01vsgroup OL.
表3结果可知,肾脏组织TGF-β1含量,OL组、COL组均显著高于C组(P<0.01),而COL组显著低于OL组(P<0.01);TNF-α:OL组、COL组均显著高于C组(P<0.01,P<0.05),而COL组显著低于OL组(P<0.01);IL- 1β:OL组、COL组均显著高于C组(P<0.01),而COL组与OL组无显著性差异(P>0.05)。
3.5 大鼠肾脏组织通路蛋白表达结果
光镜(400倍)下观察肾组织切片,如下图,并计算组织化学评分(H- SCORE)。
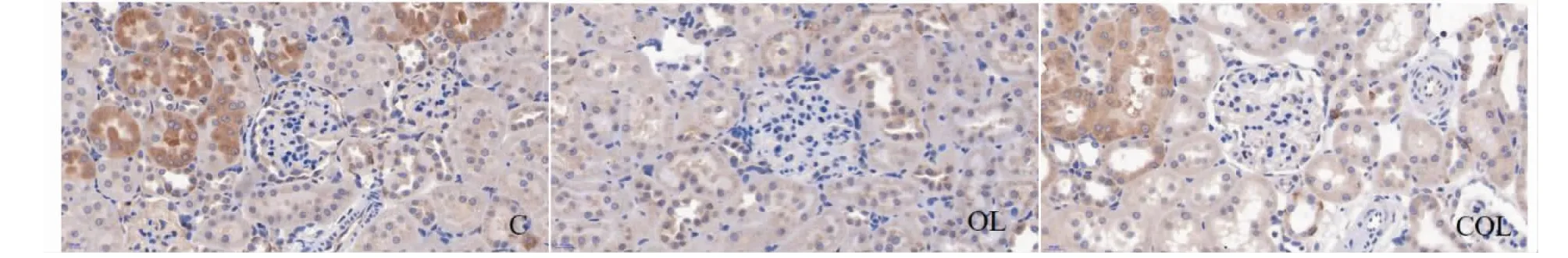
图5 大鼠肾组织Nrf2的表达Fig.5 The expressions of Nrf2 in renal tissue of rats
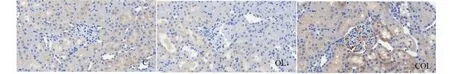
图6 大鼠肾组织HO- 1的表达Fig.6 The expressions of HO- 1 in renal tissue of rats
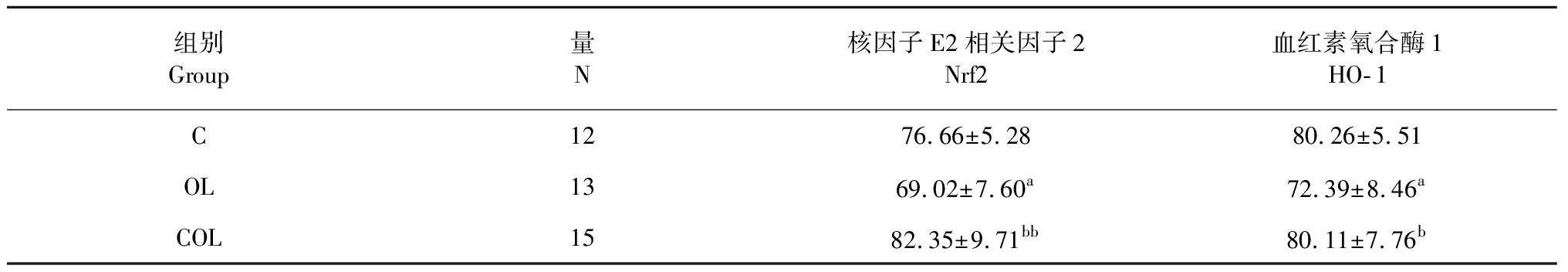
表4 各组大鼠肾脏Nrf2、HO- 1的表达
注:与C组比,aP<0.05;与OL组比,bP<0.01,bbP<0.01。
Note:aP<0.05vsgroup C;bP<0.05vsgroup OL;bbP<0.01vsgroup OL.
图5、图6及表4结果可知,肾脏组织Nrf2和HO- 1蛋白主要分布肾小管,而肾小球内表达相对较少,而且这两种蛋白的表达量变化趋势一致,OL组显著低于C组(P<0.05),COL组显著高于OL组(P<0.01,P<0.05),而COL组与C组无显著差异(P>0.05)。
选用- 80 ℃冻存的肾脏组织研磨后,进行蛋白定量后的Western- blot检测NF-κB的蛋白表达量,具体结果如下图。

图7 大鼠肾组织NF- κB的表达Fig.7 The expressions of NF- κB in renal tissue of rats注:与C组比,aP<0.05,aaP<0.01;与OL组比,bP<0.01。Note:aP<0.05 vs group C;aaP<0.01 vs group C;bP<0.05 vs group OL.
由图7可知,肾脏组织NF-κB的蛋白表达量,OL组和COL组均显著高于C组(P<0.01,P<0.05),而COL组显著低于OL组(P<0.05)。
4 讨论
肾脏ECM作为肾小球及肾小管基底膜的重要组分,主要承担机械支撑和连接作用,其对保证肾小球滤过屏障的完整性和保护肾小管上皮细胞的结构与功能具有重要作用。前期研究表明[10,11],大强度运动所致过度训练可引发大鼠肾脏TGF-β1、TNF-α等炎症因子的过度表达,促使肾脏固有细胞的增殖,刺激其表达粘附分子并生成过量ECM,进而打破肾脏ECM合成与分解代谢间的动态平衡。ECM合成与降解之间的动态平衡遭到破坏后,大量ECM沉积于肾小球、肾间质内,造成肾脏各级血管堵塞,分隔混乱,肾脏组织形态学和超微结构改变,肾损伤加重,肾单位丧失且功能衰竭,严重者出现不可逆转的肾小球硬化。炎症因子的TGF-β1是肾脏内调控ECM合成与分解平衡最主要的上游细胞因子,ECM沉积情况与TGF-β1的表达呈正相关[12]。TGF-β1通过以下三种途径调控ECM沉积[13,14]:①促进ECM主要组分如胶原(Col- I、Col- III、Col- IV)、纤维连接蛋白(FN)的表达;②促进纤溶酶原激活物抑制因子(PAI)和金属蛋白酶组织抑制因子(TIMP)等抑制ECM降解的酶类合成;③促进整合素表达进而影响ECM沉积。NF-κB是调控炎症级联反应的重要核转录调控子,抑制NF-κB蛋白表达,可以下调TGF-β1、TNF-α等炎症因子的表达[15,16]。Nrf2是机体重要的抗氧化应激反应调节通路,激活后的Nrf2向核易位,与抗氧化反应元件(ARE)作用,进而上调HO- 1、SOD等抗氧化酶表达水平及活性,发挥抗氧化作用[17]。NF-κB通路与Nrf2通路相互作用。受Nrf2调控的HO- 1是Nrf2信号通路与NF-κB信号通路之间相互作用的枢纽,激活Nrf2通路可以上调HO- 1的表达,可以抑制IκB活化,进而降低NF-κB/IκB复合体解离程度,阻碍NF-κB的活化与向核异位,从而减轻机体的炎症反应[18]。也有研究证实[19],高表达的HO- 1通过抑制LPS刺激导致的Toll样受体4(TLR4)/NF-κB活化,减轻组织内的炎症反应。
睾酮与皮质酮是反应机体内合成与分解代谢的重要指标,两者的比值降低超过基础水平的30%时可诊断出现过度训练[20]。血肌酐与血尿素氮是常用的肾功能诊断指标,两者水平升高意味着肾功能的损害[21]。本研究结果表明,过度训练组大鼠T/Cor比值下降幅度约85%,远超对照组均值水平7.83的30%;而过度训练组大鼠血肌酐与血尿素氮指标显著上升。这说明6 周的递增负荷训练引发大鼠出现过度训练,同时也造成其肾脏损伤。姜黄素作为天然多酚类色素,具有极强的抗氧化及抑炎活性[4]。前期研究证实[5,6,22],姜黄素可通过以下两种途径改善大鼠运动性肾损伤:①激活Nrf2通路,增强肾脏抗氧化能力,防止肾脏出现过度的细胞凋亡;②抑制NF-κB通路活性,阻碍炎症级联反应,下调炎症因子的表达,降低肾素- 血管紧张素系统活性。本实验结果显示,过度训练组大鼠肾组织内Nrf2和HO- 1表达水平显著降低,氧化应激水平升高,而NF-κB的蛋白表达量显著高于对照组,肾组织内炎症因子TGF-β1、TNF-α、IL- 1β含量均表现出高水平状态,肾ECM沉积现象严重,组织形态学与超微结构异常;而姜黄素+过度训练组大鼠Nrf2和HO- 1表达水平较过度训练组明显升高,恢复至接近安静水平,而NF-κB的蛋白表达量出现明显下调,但仍高于对照组,肾组织TGF-β1、TNF-α、IL- 1β含量的变化趋势与NF-κB的变化趋势一致,肾ECM沉积得到明显改善。以上结果表明,训练期间补充姜黄素,有效地激活Nrf2通路,上调Nrf2/HO- 1的蛋白表达,进而抑制NF-κB的蛋白表达,降低其通路活性,炎症级联反应随之受阻,TGF-β1、TNF-α、IL- 1β等炎症因子减少,肾脏ECM合成与降解之间的平衡得到修复,减轻ECM沉积,稳定肾脏正常的组织形态学与超微结构。由此可见,姜黄素可以发挥级联效应通过调控Nrf2信号通路,抑制NF-κB的活化与核异位,缓解炎症因子的过度表达,进而抑制和缓解运动性肾损伤大鼠肾脏ECM的过度沉积,保护肾脏结构和功能的正常。
5 结论
姜黄素能够发挥级联效应,通过显著提高运动性肾损伤大鼠肾脏组织内Nrf2蛋白表达,增强Nrf2通路活性,上调HO- 1蛋白表达,抑制NF-κB炎症通路的过度激活,下调炎症因子TGF-β1、TNF-α、IL- 1β的表达,缓解肾小球ECM的过度沉积,维护肾脏基本结构与功能,预防和延缓过度运动应激导致的运动性损伤,对肾脏具有保护作用。
