艾叶挥发油化学成分和药理作用研究进展
2020-01-09赵秀玲党亚丽
赵秀玲,党亚丽
1黄山学院生命与环境科学学院, 黄山 245021;2宁波大学海洋学院, 宁波 315211
艾叶为菊科植物艾(ArtemisiaargyiLevi.et Vant)的干燥叶,性温,味苦、辛,归肝、脾、肾经,具有散寒止痛、温经止血、镇咳平喘、杀虫止痒及安胎的作用[1]。艾叶富含多种生物活性成分,其中挥发油是艾叶的主要有效成分群[2],艾叶挥发油含量为1.23%,并且艾叶挥发油已成为当阶段的研究热点[3]。艾叶挥发油具有抗菌、抗炎、消毒驱虫、美白、止血、平嗜、抗过敏、镇嚏、止痒等功效[4- 9],是食品、香料及化学工业的重要原料。现对近几年艾叶挥发油的提取方法、化学成分、药理作用、临床应用及安全性做一概述,为艾叶挥发油的进一步开发利用提供借鉴。
1 艾叶挥发油的提取
有效的提取方法和工艺是挥发油质量和临床疗效的保证,艾叶挥发油的研究主要从提取工艺的比较及其成分鉴别方面展开,对于艾叶资源的开发利用也具有重要意义。艾叶挥发油的提取方法可分为水蒸汽蒸馏法、微波辅助法、超临界流体萃取法、超声波辅助法、溶剂法、压榨法、半仿生法、活性离子水法、酶法、荷电法等[10- 12]。
其中以水蒸汽蒸馏法提取应用较多,提取所得挥发油中化学成分种类较少,能特征性的反映艾叶的种属特性,但挥发油得率低。在水蒸汽蒸馏的基础上添加了超声、微波协同水蒸气蒸馏纯化的装置,使用水作为溶剂。酶法提取则在温和的条件下使有效成分充分溶解、混悬于溶剂中从而达到提高提取率。Bao[13]采用微波辅助水蒸汽蒸馏法提取艾叶挥发油,具有绿色、环保、操作便捷和节省时间等优点[14,15],还提高了艾叶挥发油的商业价值。Xie等[16]利用半仿生法提取艾叶挥发油,与水蒸气蒸馏法相比尽管提取率提高了43.84%,但还需改进提取工艺条件以提高提取率和避免活性组分进一步转化。Wang[17]优选CO2超临界萃取法提取艾叶挥发油的工艺(比水蒸气蒸馏法[18]提取的得率提高了97.67%),此法对有效成分进行选择性提取及分离纯化,但所得挥发油并不纯净,导致处理过程挥发油易损失。Liang等[19]、Zhang等[20]建立了HS- SPME- GC- MS法测定艾叶挥发性成分,此法简单、快捷、所需样品量小,能全面快速获得样品中挥发性物质的组成信息等。
2 艾叶挥发油的化学成分
艾叶具有浓烈香气,挥发性成分较复杂,由于环境、气候条件的差异,不同产地、不同品种、不同提取方法的艾叶挥发油化学成分的类型与种类及其相对百分含量都有较大差异。工业化生产时应充分考虑这个因素。现将不同条件下艾叶挥发油的成分特点综述如下。
2.1 不同提取方法所得艾叶挥发油成分
不同提取方法艾叶挥发油成分特点如下表。
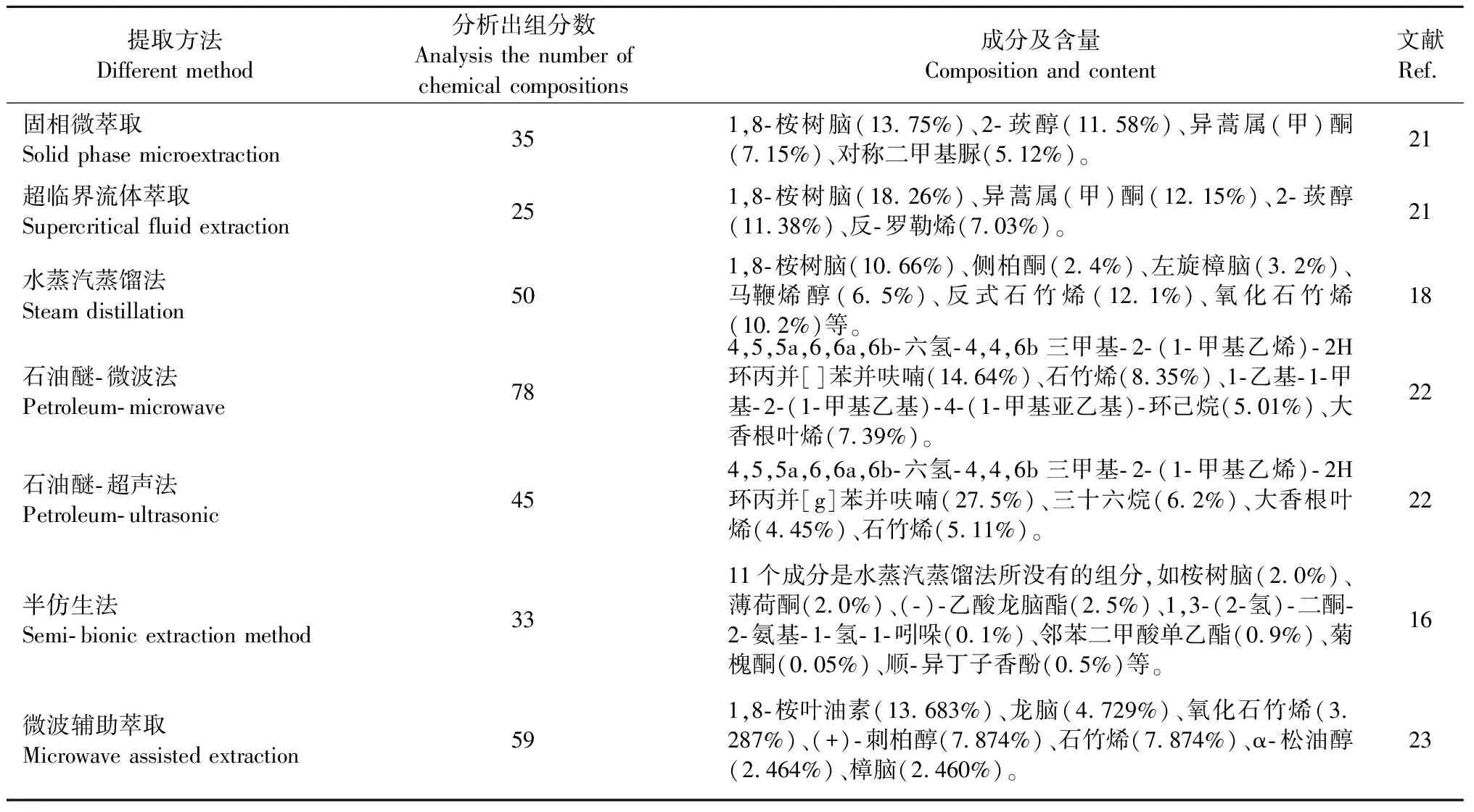
表1 不同提取方法艾叶挥发油中的化学成分
超临界CO2萃取法所得成分较少,且以酮类和醇类居多,而水蒸气蒸馏法得到的成分以醇类和烯类居多。石油醚对植物的细胞壁渗透性较差,超声法虽然能够破损一部分细胞,但是还是不能很好的提取化合物,而用微波法却能比较好的对植物的细胞壁破损从而提取得到比较全的化合物。半仿生法实验时间较早,且选择考察的指标成分和设备陈旧,其实验结果对艾叶挥发油制备工艺工业化生产有一定的局限性。
2.2 不同产地艾叶挥发油的化学成分
通过对产自湖北、湖南、广东、甘肃、河北、山西等12个不同产地的品种及移栽品种的艾叶挥发油的GC- MS分析得知:各产地艾叶挥发油主要共有成分为樟脑、桉油精、松油醇、龙脑、侧柏酮、石竹烯等;樟脑、侧柏酮等毒性成分较低的为安徽六安、甘肃兰州及山西五城的五月艾的艾叶挥发油;蕲春移栽至山西的艾叶挥发油含量(1.25%)、化学成分种类(37个)及毒性成分(樟脑和侧柏酮比均较低)在含量均优于Jin[24]。Zhao[25]试验结果表明艾叶挥发油中主要含有醇类、烯类、醛酮类、酯类等化合物,与文献报道中用GC- MS方法分析中的艾叶挥发油所的成分相一致。设定相关系数阈值0.950 0以区分河南产地与其它产地艾叶药材。因此,植物生长环境如海拔高度、温度、湿度、日照等,都直接影响挥发油的化学成分,不同产地的艾叶挥发油成分也存在明显差异[26],在其使用上需要注意产地因素。此后应进一步开展该药材的规范化种植、化学成分与质量标准研究,以指导艾叶在不同领域的合理应用。
2.3 不同采摘时间艾叶挥发油的化学成分
由于植物处于不同的生长期,生物合成与代谢的累积受各种生物酶、光照、温度、水分、不同土壤肥力以及植物个体差异、大田等因素影响,使得成分种类和含量不断发生变化。采集艾叶样本时间的变化规律同挥发性组分主成分含量累积表现呈现正向的相关性[27]。不同采集时间构成艾叶挥发性主要的特征性成分(R)- 4- 甲基- 1- (1- 异丙基)- 3- 环己烯- 1- 醇、莰烯、1- 甲基- 3- (1- 异丙基- 苯)、C- 松油烯、龙脑、桉油精等成份含量较高,其中前14种成分具有明显的上升趋势,最后两种则呈现相对波动下降的趋势。可见艾叶最佳采摘时间为端午节前后1~2周[27]。此结论与Hong[28]的研究结果大致一致。
2.4 陈化或炮制前后艾叶挥发油的化学成分
研究发现艾叶陈化前后其挥发油成分的种类及含量会发生比较明显的变化,还有新的成分出现[29]。如陈化后β- 蒎烯、乙酸菊烯酯、4,4′- 二甲基联苯、澳白檀醇等成分的色谱峰增加;桉油精、1- 甲基萘、2,5,8- 三甲基萘酚等色谱峰降低;顺- 松油醇、沉香醇、侧柏醇等为新鲜艾叶没有的色谱峰,而陈化后艾叶出现了这些色谱峰[29]。Song[30]将生艾叶炮制成醋艾炭后,发现挥发油含量由0.35%(生艾叶)降为0.015%(醋艾炭),艾叶挥发油莰烯、邻异丙基甲苯等成分消失,α- 蒎烯绝对含量降低了8倍,合成右旋龙脑含量由7.95%降至0.38%,桉树脑由18.22%降至0.82%,这可能与艾叶炮制后刺激性、毒性降低有关。
2.5 存储条件对艾叶挥发油的化学成分的影响
Miao[31]对储存条件对艾叶挥发油成分影响的研究,结果表明影响艾叶储存效果的因素主次排序为:储存温度>储存湿度>储存时间,艾叶在最佳储存条件下(储存温度40 ℃,储存湿度40%,储存时间为8个月)艾叶挥发油的香气特征丰富、明显,主要成分为桉叶油醇(31.54%)、右旋龙脑(8.94%)、左旋樟脑(6.12%)和石竹烯(6.09%),可见由于受不同生长环境及储藏条件等因素影响,其有效成分含量及功效均存在一定差异。
3 艾叶挥发油的药理作用
3.1 抗病毒和抑菌作用
Feng等[32]研究结果表明艾叶挥发油及纳米结构脂质载体(Naostructured lipid carrier,NLC)均对鸭肝组织中乙肝病毒有抑制作用,高剂量抑制作用更明显,且艾叶挥发油做成NLC制剂后抑制作用比原料药更加显著。原因可能是艾叶挥发油NLC纳米粒粒子较小,比表面积较大,增加了艾叶挥发油的溶解,利于吸收;艾叶挥发油NLC延长在体内的滞留时间,可增强与体内粘膜组织的黏附性,进而发挥更强的药性[33]。
艾叶的抑菌实验表明,艾叶挥发油对金黄色葡萄球菌、沙门氏菌、大肠杆菌的抑菌效果都很好[18],作用机理可能是由于破坏了细胞膜的通透性从而阻碍了细菌的呼吸作用[34]。Yang等[35]采用三聚氰胺甲醛包裹艾叶挥发油,运用傅里叶变换红外光谱和热重分析鉴定,评估了微胶囊的抗菌活性,结果表明包裹物性能良好,为开发新的具壳结构找到一种新方法。Shi等[36]研究艾叶挥发油诱导白念珠菌凋亡的活性,结果显示艾叶挥发油对白念珠菌SC5314的MIC为0.5 mL/L,大于0.5 mL/L的艾叶挥发油干预后,白念珠菌SC5314细胞内活性氧水平显著升高、线粒体膜电位显著降低、凋亡比例显著增加、metacaspase活性显著升高、细胞核固缩,为艾叶挥发油治疗皮肤常见真菌感染的作用机制研究提供了重要的实验基础。
3.2 平喘作用
Wang等[37]研究艾叶油的平喘作用,艾叶油具有舒张支气管平滑肌的作用,所以能明显舒缓氯化钡引起的离体豚鼠气管平滑肌的痉挛;通过雾化给药能明显延长豚鼠的引喘潜伏期,对乙酰胆碱和组胺诱发的豚鼠哮喘具有抑制作用。Wei等[38]研究艾叶油的平喘活性,结果艾叶油高剂量组对卵蛋白引起的小鼠哮喘,能明显减少BAL下中白细胞总数(P<0.05)和嗜酸性粒细胞计数(P<0.01),得出艾叶油具有平喘作用的结论。艾叶挥发油中含有α- 萜品烯醇,此成分能够作用于中枢,通过调节气管达到祛痰、平喘、镇咳的作用,从而治疗药物性哮喘,使组胺和乙酰胆碱引起哮喘的潜伏期延长,从而减少抽搐。
3.3 抗炎作用
Zhao等[39]探讨艾叶油对小鼠耳肿胀急性炎症的抗炎作用,结果表明,艾叶挥发油高剂量、低剂量组对二甲苯致炎的小鼠肿胀均有显著的抑制作用,当艾叶挥发油10 mL/kg剂量时,对小鼠耳肿胀急性炎症发挥较强的抗炎活性;二甲苯的最佳作用时间为40 min左右。Tian[40]研究艾叶提取组分艾叶轻油(挥发油类成分占60%)的抗炎作用。在体内实验中,观察到在荧光显微镜下斑马鱼炎症模型中经荧光标记的巨噬细胞和中性粒细胞都有一定数量减少,证明了其具有一定的抗炎作用。Real- time PCR 方法检测发现提取组分能有效降低RAW 264.7细胞在LPS刺激后IL- 6、JL- lβ和TNF- α炎症因子的表达和分泌。Griess方法检测发现艾叶提取物能显著减少在LPS刺激下巨噬细胞NO的释放量,并呈浓度依赖性降低。因此,艾叶提取物可以作为有效治疗炎症疾病的有效药物。
3.4 镇痛镇静作用
Fu等[41]探讨了艾叶温经仪(结构中间是艾叶挥发油层,用以保存艾叶挥发油)在治疗痛经中的疗效,结果艾叶温经仪具有行气消瘀,散寒止痛的功效,对治疗痛经有良好的效果。Sun等[42]的研究结果表明艾叶挥发油发挥镇痛作用主要与降低血中PGE2含量,调节体内SOD、MDA、NO水平有关,而且艾叶挥发油功效的发挥与挥发油剂量、用药时间密切相关,呈现一定的剂量依赖关系。有研究发现将艾叶油从低到高一系列浓度对家兔腹腔注射,观察艾叶油对小鼠戊巴比妥钠睡眠时间的影响,研究发现艾叶油可以延长小鼠的睡眠时间;同时家兔表现出从镇静到呼吸减慢最后死亡的不同阶段反应,表明艾叶油具有镇静作用。
3.5 对药物透皮吸收的促渗作用
采用天然产物中的有效成分作为渗透促进剂是目前透皮领域研究的热点之一。Pan[43]研究艾叶挥发油对双氯芬酸钠透皮吸收的促进作用。结果在完整皮肤中,艾叶油对双氯芬酸钠有促透作用,渗透作用比氯酮的强(P<0.05);在去角质层皮肤中,氯酮对双氯芬酸钠12 h促透作用显著,与艾叶油差异无统计学意义(P>0.05)。这是因为艾叶中含有较多烯萜类化合物能够改变角质层细胞内的角蛋白构象、性质、松弛角蛋白之间的结合力,形成微孔通道,增加药物通过细胞内途径的渗透性[44]。Gao[45]的研究结果表明0.8%的艾叶挥发油的β- 环糊精包合物对盐酸环丙沙星有显著的透皮吸收促进作用。
3.6 其他作用
He等[46]的研究结果表明艾叶挥发油能够刺激红细胞的生成,具有抗自由基损伤的作用,可以提高血液中吞噬细胞的活性的作用,从而提高机体抗感染作用,促进机体免疫保护功能。用艾叶油给卵蛋白致敏的鼠灌胃后,对再次因卵蛋白引起的过敏性休克有显著的保护作用,能有效抑制组胺及慢反应物质的释放[47]。
4 临床应用
临床上,艾叶挥发油主要用于治疗疮疡、鼻炎、肩背腰部软组织疼痛,可用于有效抑制室内空气中的细菌生长,还可用于治疗慢性支气管炎和哮喘等症疾。目前,临床使用的艾叶挥发油的剂型包括乳膏剂、油剂、胶囊、气雾、注射剂等。艾叶资源丰富,价值低廉,是菊科多年生草本植物艾的干燥叶,挥发油的提取制作方便,值得大范围推广应用。
5 艾叶挥发油的安全性
研究者对艾叶挥发油毒性认识和研究结论不一致,在临床应用时要引起重视。Huang等[48]研究艾叶水提组分和挥发油对小鼠肝毒性“量- 时- 毒”关系,结果二者均可造成明显的肝毒性损伤,并且肝毒性作用程度挥发油>水提组分。Wang等[49]研究艾叶油雾化吸入对大鼠的长期毒性研究表明艾叶油连续给药3个月后和6个月及停药1个月后,提示艾叶油长期雾化吸入给药无明显毒性,是安全的。Liu等[22]分析不同提取方法得到的挥发油的急性肝毒性并进行比较,结果表明:水蒸汽蒸馏法(小分子萜类、部分苯类物质为主)的急性肝毒性最大,超临界CO2提取法的(以长链酯类化合物为主)为轻,石油醚法(以芳香族化合物为主)的未显示明显毒性。艾叶挥发性组分是其功效和毒性大小的重要物质组成,可以将毒性成分如侧柏酮、樟脑、丁子香酚含量的降低作为艾叶采摘的主要依据[27]。现代实验方法中艾叶是生艾叶没经过任何预处理,而且用量是临床应用的十几倍甚至几百倍。而临床应用艾叶挥发油应该将艾叶配伍、炮制(甚至蒸煮煎炸),严把用药剂量,正确针对适应症,控制煎煮时间。应用艾叶挥发油时还应注意挥发油的提取方法,肝毒性是其物质基础,避免采用水蒸汽蒸馏法提取,宜采用有机溶剂法提取(如石油醚),这样就避开了有急毒性或亚毒性的物质被萃取出来。
6 结论
艾叶挥发油的药理作用广泛,其作用机制的研究已深入到分子和细胞水平,是当今的研究热点,并在其提取工艺、化学成分、药理作用、临床应用及其安全性方面进行了较为系统的研究,证实了艾叶挥发油具有抗菌谱广、抗菌活性强、临床疗效好、不良反应少而轻微的一种的天然抗菌药物,但进一步开拓市场还需解决一系列问题。首先,艾叶挥发油易挥发,且易受外界影响而改变成分,在一般制剂中性质不稳定、不易溶于水、配制成水溶液浓度低,降低了药效。因此,后续研究中,需要运用新技术(如包合技术)研究出新剂型并注重其构效关系,提高血药浓度,充分发挥其药效及易于给药的途径。其次,需加强对艾叶挥发油化学成分质量控制的研究,针对艾叶挥发油中有活性的化学成分开发出新的剂型与高效低毒的新药,以充分发挥艾叶挥发油的市场潜力与应用潜力,将会产生重大的社会意义与经济效益。
