槲皮素减轻紫杉醇致神经病理性大鼠疼痛的作用与机制
2020-01-09严进红韩克跃胡涵帅
严进红,韩克跃,夏 杰,胡涵帅
贵州医科大学第二附属医院,凯里 556000
紫杉醇是一种临床应用较为广泛的抗癌药物,被应用于多种类型的实体瘤的治疗。其中,紫杉醇极易导致痛觉过敏和痛觉超敏的毒副反应,称作化疗导致的神经病理性疼痛(NP)。这种疼痛属于剂量依赖性的难治性疼痛,临床较难治愈,往往影响化疗进程,严重者可迁延数月甚至数年,严重影响患者的生存质量及后续治疗[1,2]。目前,对于NP的治疗尚未建立有效的预防策略,西医多采用镇痛镇静药、抗抑郁药、抗癫痫药、抗氧化剂、激素类等进行治疗,疗效不佳。槲皮素(Que)是多酚类黄酮中的一种,现代药理研究表明,其具有显著的细胞保护作用、抗血小板、抗氧化、抗血栓形成和抗癌等生物活性[4]。有动物实验研究表明,槲皮素可显著减轻慢性神经病理性疼痛,然而有关其是否对紫杉醇诱导的神经痛具有缓解效应,目前尚不明确。本研究中成功复制紫杉醇诱导的神经病理学疼痛模型,并采用槲皮素进行治疗,旨在明确槲皮素对紫杉醇致神经病理学疼痛大鼠的改善作用并探索相关的机制。
1 材料和方法
1.1 实验动物
雄性SD大鼠50 只,8~12 周龄,体重200~250 g,购自上海斯莱克实验动物有限责任公司,许可证号:SCXK(沪)2016- 0007。所有大鼠饲养于SPF环境的动物实验中心,温度为22~24 °C,12 h昼/12 h夜日常节律,自由饮食、饮水,所有大鼠均适应性喂养1周后进入本实验。
1.2 试验试剂
槲皮素(纯度98.5%,北京索莱宝科技有效公司)。紫杉醇(规格:30 mg/支;厂家:海口市制药厂有限公司;批号:161103)。2390 型Electronic Von Frey 触觉测痛仪,II T336 型甩尾足底测试仪 (厂家:美国II TC公司);鼠 抗 Wnt3α、β- catenin 、β- actin 鼠抗单克隆抗体、HRP羊抗鼠二抗(厂家:英国Abcam公司);TNF-α,IL- 1βELISA 试剂盒(厂家:武汉博士德生物有限公司);BCA 蛋白浓度测定试剂盒(厂家:南通碧云天生物有限公司)。
1.3 实验动物分组及处理
采用随机数字表法,将50只大鼠随机分为5组:对照组、Paclitaxel组、Paclitaxel+Que 30、 Paclitaxel+Que 50组及Paclitaxel+Que 100组,每组各10只。除对照组外,其余各组大鼠均建立大鼠化疗NP模型,分别于实验的第 1、3、5及7 天采用腹腔注射的方式灌注2 mg/kg的紫杉醇溶液。同时,Paclitaxel+Que 30、50及100 组每天灌胃30、50及100 mg/kg的槲皮素溶液,连续7天。对照组及Paclitaxel组灌服等体积生理盐水,连续7天。实验设计经动物保护委员会同意,动物使用和处理遵照美国国立卫生署颁布的“实验动物关护和使用指南”。
1.4 观察指标
1.4.1 Von Frey试验
在第一次给药之前和第2、4、6和8 天使用Von Frey试验评估机械性异常性疼痛。在给药前及第2、4和6 天按照文献报道的方法[7]将每只大鼠置于具有金属丝网地板的透明塑料盒(20×17×13 cm)中进行实验,并通过改良的上下法确定缩爪阈值[7]。
1.4.2 巨噬细胞迁移
将大鼠采用异氟烷麻醉后通过4%多聚甲醛(PFA)进行灌注固定,在第2、4或8天取出腰椎L4- 6背部神经节,并依次浸入4%PFA中,通过10%、20%和30%蔗糖缓冲液。使用最佳切割温度化合物制备DRG冷冻块,在低温恒温器上切割DRG冷冻切片(厚度:10 μm),使用4%PFA固定15 min,并在5%脱脂乳中封闭1 h,然后在4 ℃下与抗CD68抗体(美国Abcam公司)孵育过夜。然后将DRG切片与AlexaFluor®488- 结合的抗小鼠IgG一起孵育2小时,通过80%甘油进行防猝灭后在荧光显微镜下观察(德国蔡司公司)。通过使用图像分析软件Image J 测量的巨噬细胞(CD68阳性细胞)数并除以DRG细胞面积来计算巨噬细胞迁移。
1.4.3 神经突起生长
如上述1.2所述,取出腰椎L4- 6 背部神经节制备DRG细胞。DRG细胞采用美国Invitrogen公司生产的NG培养基进行培养。将DRG细胞接种到24 孔板上并培养一周以使神经突延伸。将两种细胞类型暴露于紫杉醇(10 ng/mL)和槲皮素(0、25或50 μM)24或168 h。在与紫杉醇和槲皮素一起孵育后,用台盼蓝(美国Gibco公司)染色死细胞。通过相差显微镜监测细胞,并通过分析软件Image J测量活细胞中的神经突长度。
1.4.4 酶联免疫吸附法检测炎症因子水平
在戊巴比妥钠(100 mg/kg)深度麻醉下,每只大鼠的L4- L6脊髓在实验的第8 天被快速分离并分成几个部分。部分脊髓用含苯甲基磺酰氟(PMSF)的RIPA缓冲液中在4 °C下匀浆。在4 ° C下4 000 rpm离心15 min后,通过BCA法测定上清液蛋白浓度。平衡后,将样品用于ELISA。根据制造商的说明,通过大鼠特异性ELISA试剂盒(中国康为生物公司)测量促炎因子的表达。
1.4.5 Western blotting
采用上述不同分组DRG细胞的蛋白分离后,采用Western blotting检测Wnt通路相关因子Wnt3α、β- catenin的表达。Western- blot方法简述如下:细胞蛋白采用SDS- PAGE胶电泳进行分析并转膜至PVDF膜上。将PVDF膜采用5%的脱脂牛奶封闭后,采用anti-β- catenin单克隆抗体进行孵育,采用GAPDH单克隆抗体作为内参。蛋白采用化学发光法进行检查。将获得的蛋白条带采用Image J软件进行定量后,分析蛋白水平。
1.5 统计学分析
所有数据以平均数±标准差(Means ± SD)表示,分别采用非配对t检验(双尾)和Two- way ANOVA 方法比较两组和多组之间的差异。P< 0.05 认为是具有统计学意义。所有统计学方法均采用GraphPad Prism 6.0和 SPSS 18.0 统计学软件分析。
2 结果
2.1 槲皮素处理对紫杉醇致神经病理学疼痛大鼠机械缩足阈值的影响
在第4、6和8天,紫杉醇(4 mg/kg,腹膜内注射)与溶剂DMSO相比显著降低了缩爪阈值(P<0.05,图1及表1)。重复给予槲皮素灌胃显著抑制紫杉醇诱导的机械缩足阈值降低(P<0.05,图1及表1)。
表1 不同组间机械缩足阈值的变化
注:Paclitaxel组vs Paclitaxel+Que 30 mg/kg组,*P<0.05;Paclitaxel组vs Paclitaxel+Que 50 mg/kg组,#P<0.05;Paclitaxel组vs Paclitaxel+Que 100 mg/kg组,+P<0.05。下文与此相同。
Note:Paclitaxel groupvsPaclitaxel+Que 30 mg/kg group,*P<0.05;Paclitaxel groupvsPaclitaxel+Que 50 mg/kg group,#P<0.05;Paclitaxel groupvsPaclitaxel+Que 100 mg/kg group,+P<0.05.The same as below.
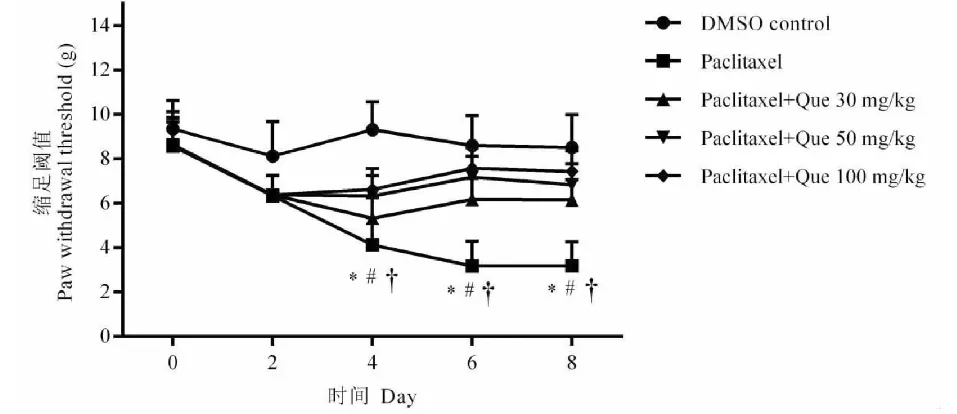
图1 槲皮素处理对紫杉醇致神经病理学疼痛大鼠机械缩足阈值的影响Fig.1 Effect of quercetin treatment on the mechanical withdrawal threshold of paclitaxel- induced neuropathic pain in rats
2.2 槲皮素处理对紫杉醇致巨噬细胞组大鼠背部神经节细胞上迁移影响
紫杉醇给药后,巨噬细胞在大鼠背部神经节细胞周围增加(图2及表2)。在第8天,巨噬细胞迁移显著增加(P<0.05,图2及表2)。槲皮素处理能够在第4天和第8天以浓度依赖的方式抑制紫杉醇诱导的巨噬细胞迁移增加(P<0.05,图2及表2)。
2.3 槲皮素处理对紫杉醇诱导大鼠脊髓炎症因子TNF- α及IL- 1β的影响
紫杉醇处理能够显著升高大鼠脊髓中炎症因子TNF-α及IL- 1β的水平(P<0.05;图3及表3),而槲皮素处理能够以浓度依赖的方式显著降低由紫杉醇处理引起的大鼠脊髓中炎症因子TNF-α及IL- 1β的水平升高的情况(P<0.05;见图3、表3)。
表2 各组细胞迁移比例
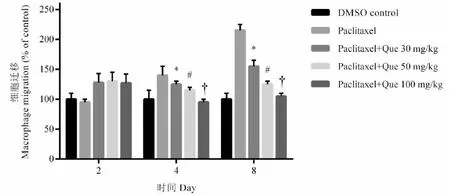
图2 槲皮素处理对紫杉醇致巨噬细胞组大鼠背部神经节细胞上迁移影响Fig.2 Effect of quercetin treatment on migration of dorsal ganglion cells in paclitaxel- induced macrophage rats
2.4 槲皮素处理对紫杉醇诱导大鼠背部神经节神经元突起退化的影响
我们进一步考察了紫杉醇处理对大鼠背部神经节神经元突起退化的影响,结果如图4及表4所示,从图中可见,紫杉醇处理能够显著增加神经元突起退化,而槲皮素处理能够以剂量依赖的方式抑制由紫杉醇引起的大鼠背部神经节神经元突起退化。
2.5 槲皮素处理对紫杉醇诱导大鼠背部神经节Wnt通路的影响
我们进一步对槲皮素处理的作用机制进行了研究,结果如图5所示,从图中可见,紫杉醇处理能够显著增加Wnt通路关键分子Wnt3a和β- catenin的水平变化,而槲皮素处理能够以剂量依赖的方式抑制由紫杉醇引起的大鼠背部神经节细胞中Wnt通路关键分子Wnt3a和β- catenin的水平增加。
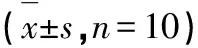
表3 各组TNF- α及IL- 1β的水平
图3 槲皮素处理对紫杉醇诱导大鼠脊髓炎症因子TNF- α及IL- 1β的影响Fig.3 Effect of quercetin treatment on paclitaxel- induced inflammatory factors TNF- α and IL- 1β in rats
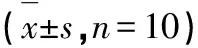
表4 各组背部神经节突起长度
图4 槲皮素处理对紫杉醇诱导大鼠背部神经节神经元突起退化的影响Fig.4 Effect of quercetin treatment on paclitaxel- induced degeneration of rat dorsal ganglion neurons

图5 槲皮素处理对紫杉醇诱导大鼠背部神经节Wnt通路的影响Fig.5 Effect of quercetin treatment on paclitaxel- induced Wnt pathway in the dorsal ganglion of rats
3 讨论
在本文中,我们通过建立紫杉醇诱导的神经痛模型并采用槲皮素进行处理来明确槲皮素对紫杉醇致神经病理学疼痛大鼠的改善作用并探索相关的机制。我们的结果显示槲皮素治疗组相较于模型能够以剂量依赖的方式的显著升高大鼠的缩抓阈值;并且能够以剂量依赖的方式显著降低巨噬细胞的迁移。槲皮素处理能够以浓度依赖的方式显著降低由紫杉醇处理引起的大鼠脊髓中炎症因子TNF-α及IL- 1β的水平升高。槲皮素处理能够以剂量依赖的方式抑制由紫杉醇引起的大鼠背部神经节神经元突起退化。另外,蛋白检测结果显示槲皮素能够以剂量依赖的方式抑制Wnt信号通路的关键分子Wnt3α和β- catenin的水平。
紫杉醇是一种常用的化学治疗药物,能够通过阻止有丝分裂来阻止肿瘤细胞的分裂。由于该药物的非选择性特性,在化学疗法期间经常发生不希望的副作用,例如痛觉过敏和异常性疼痛。紫杉醇引起的剂量依赖性神经性疼痛的特征是麻木,刺痛,烧灼感和其他症状,这些症状严重限制了紫杉醇的临床应用[8]。迄今为止,已经开发出很少的有效药物来解决这个问题。
目前已经采用了几种啮齿动物模型来研究紫杉醇引起的机械性异常性疼痛和热痛觉过敏的症状和潜在机制[9,10],因为大鼠中紫杉醇诱导的周围神经病变具有与人类相似的特征[11]。在本动物模型中,紫杉醇在第一次注射紫杉醇后第5天开始诱导大鼠超敏反应,有趣的是,大鼠在注射后几乎立即表现出神经性疼痛症状。注射紫杉醇的大鼠和小鼠被证明表现出典型的热痛觉过敏和机械性异常性疼痛。以前的证据表明,紫杉醇诱导的大鼠周围神经病变可持续35天[12]。单剂量的16或32 mg/kg紫杉醇也会在大鼠中引起短期伤害性神经病变[13]。目前的研究表明,长期用槲皮素治疗缓解了紫杉醇诱导的大鼠慢性神经性疼痛,如槲皮素增强热痛觉过敏和机械性异常性疼痛的阈值所示。此外,短期递送槲皮素减轻了紫杉醇在大鼠中产生的急性神经性疼痛。
研究发现,神经的炎性损伤可诱发巨噬细胞的迁移,导致巨噬细胞进入炎性损伤的中心区域,从而促进炎症细胞的招募,促进TNF-α及IL- 1β等炎症介质的释放,加重神经组织的病理损伤。我们发现,槲皮素抑制了紫杉醇诱导的巨噬细胞迁移增加。由于促炎细胞因子诱导的NF- κB活化[14],它还可以抑制大鼠DRG中紫杉醇诱导的炎性细胞因子。此外,已报道鞘内IL- 1受体拮抗剂和编码IL- 10的质粒DNA逆转紫杉醇诱导的大鼠机械性异常性疼痛[3],表明炎性细胞因子参与紫杉醇诱导的神经病变。最近,据报道减轻炎症糖尿病大鼠的周围神经病变[15]。有研究还发现,通过抑制炎性细胞因子,如锌通过诱导锌指蛋白A20与TNF受体相关因子(TRAFs)结合,能够抑制Iκ激酶-α(IKK-α)/NF- κB,并抑制NF- κB的激活[14]。此外,据报道,趋化因子如CCL3和CX3CL- 1参与紫杉醇诱导的周围神经病变[16- 18]。这些趋化因子也受NF- κB控制。因此,这些趋化因子可被降低炎症进行抑制。总之,炎症相关的 NF- κB信号传导的抑制可以抑制神经元抗炎反应和紫杉醇诱导的机械性异常性疼痛的发展。
Wnt信号传导对于背根神经节的感觉神经元的初始神经细胞的分化和突触形成是至关重要的。该信号传导途径在成人感觉神经元中也具有活性,并调节对伤害性刺激的敏感性[19]。先前的研究还表明,FZD3编码Wnt受体,其在神经突向外生长中具有促进生长的作用[20]。我们在这里的结果显示槲皮素能够以剂量依赖的方式抑制紫杉醇诱导的神经痛模型Wnt信号通路的关键分子Wnt3α和β- catenin的水平的升高。提示槲皮素可能通过调控Wnt/β- catenin信号通路来发挥作用的。
综上所述,槲皮素通过调控Wnt/β- catenin信号通路,影响脊髓中炎症因子的水平并降低炎症细胞的迁移对紫杉醇致神经病理学疼痛大鼠的发挥改善效应。
